响应面法优化黑果枸杞中原花青素提取工艺
2017-06-05赵文娟李文婧杨洪江
赵文娟,宋 扬,李文婧,杨洪江,*
(1.工业微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457; 2.齐鲁工业大学生物工程学院,山东济南 250353; 3.山东省食品发酵工业研究设计院,山东济南 250013)
响应面法优化黑果枸杞中原花青素提取工艺
赵文娟1,宋 扬2,李文婧3,杨洪江1,*
(1.工业微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457; 2.齐鲁工业大学生物工程学院,山东济南 250353; 3.山东省食品发酵工业研究设计院,山东济南 250013)
为了提高原花青素的得率,在单因素实验的基础上,采用响应面实验设计优化从黑果枸杞中提取原花青素的工艺。通过考察乙醇体积分数、提取温度、提取时间三个因素及其交互作用对原花青素得率的影响,建立了该工艺的二次多项数学模型。实验表明,曲面回归方程拟合性良好,乙醇体积分数、提取温度、提取时间对响应值均有极显著影响,在乙醇体积分数56%、提取温度46 ℃、提取时间48 min的条件下,黑果枸杞原花青素得率为4.315%,与响应面预测值相比,相对误差为1.5%,说明本研究方法是一种适合于从黑果枸杞中提取原花青素的方法。
黑果枸杞,原花青素,提取,响应面
黑果枸杞(LyciumruthenicumMurr.)是茄科(Solanaceae)枸杞属(Lycium)多年生耐盐、抗旱植物,天然生长于我国西北荒漠区,有极强的抗旱、抗寒、耐盐碱特性[1]。黑果枸杞的果实中含有大量的原花青素、花青素、多糖、维生素等成分,素有“软黄金”之称[2]。《晶珠本草》记录,黑果枸杞可用于治疗心热病、心脏病、月经不调等病症[3];《维吾尔药志》记载,其果实及根皮对尿道结石、癣疥、齿龈出血等疾病治疗效果显著,民间多用其作滋补强壮、明目降压之用[4]。汪洋等人研究表明黑果枸杞烘干果实中的原花青素含量高达1.426%~9.024%,远远高于其花青素含量0.069%~0.840%[5]。原花青素(Proanthocyanidins)是一种由黄烷-3-醇单体缩合而成的聚多酚类物质,广泛地存在于植物的核、皮或籽中,有水溶、无毒、安全性好等优点,有保护心血管、抗辐射、抗疲劳、清除自由基等作用,应用前景广泛[6]。葡萄籽和葡萄皮渣是葡萄酒生产的副产品,是提取原花青素的主要原料[7],已有以葡萄籽、葡萄皮渣中为原料提取原花青素的研究报道[8-9]。黑果枸杞中含有丰富的原花青素,孙楠等人对黑枸杞、枸杞、黑加仑中的原花青素含量进行比较,发现黑枸杞中的原花青素含量远高于红枸杞和黑加仑,黑枸杞是提取原花青素的理想资源[10]。随后张岩波等人[11]对比检测了不同产地,不同种植方式的黑果枸杞中的原花青素含量,表明产自青海和新疆地区的黑果枸杞中的原花青素含量较高,同时人工种植方式收获的黑果枸杞中也含有较多的原花青素,进一步证实了其研究和开发价值。任晓娜等人[12]利用正交实验法对黑果枸杞中的原花青素提取工艺进行优化,但是得率仅达到2.99%,本研究以新疆产黑果枸杞为原料,利用响应面设计优化了原花青素的提取工艺,旨在获得更高的原花青素得率,为黑枸杞的综合开发利用打下基础。
1 材料与方法
1.1 材料与仪器
天然黑果枸杞 购于新疆乌鲁木齐市场,自然晾干,实测水分含量为7.9%,密封、干燥、低温、避光储存;儿茶素(Cas:154-23-4)标准品 购自上海哈灵生物科技有限公司;无水乙醇,甲醇、香草醛均为分析纯 购自国药集团化学试剂有限公司;浓盐酸为分析纯 购自莱阳经济技术开发区精细化工厂。
FW80型高速万能粉碎机 天津泰斯特仪器有限公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限公司;SHA-C型水浴恒温震荡器 金坛市开发区吉特实验仪器厂;GB204型分析天平 Mettler-Toledo公司;XW-80A型旋涡混合器 上海青沪浦西仪器厂。
1.2 实验方法
1.2.1 标准曲线的绘制 准确称取儿茶素标准品25 mg,用甲醇定容至25 mL,混合均匀后静置,得到 1 mg/mL 的儿茶素标准品储备液,备用。从上述储备液中分别移取0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL加入10 mL的比色管中,并用甲醇定容。使用浓盐酸-香草醛法进行原花青素含量检测和标准曲线的绘制[9]。分别吸取上述浓度梯度的样品1 mL,并依次添加4%的香草醛-甲醇溶液3 mL、浓盐酸1.5 mL,将此反应体系置于40 ℃水浴锅内避光反应30 min,并以1 mL甲醇替代儿茶素溶液作为空白,于500 nm波长下测定吸光度,绘制标准曲线。
1.2.2 黑果枸杞原花青素的提取 用粉碎机将黑果枸杞粉碎至40目用于原花青素提取实验。称取0.3 g已经粉碎好的黑果枸杞置于比色管中,按照一定料液比加入一定体积分数的乙醇溶液,盖上比色管口,并迅速用锡箔纸包住比色管外壁避免光照。将比色管内料液混匀后置于电热恒温水浴震荡箱中,在一定温度和时间下进行震荡提取,转速为60 r/min。提取结束后,过滤并收集清液,滤渣在同样的条件下重复提取一次后合并滤液并定容至100 mL作为提取液,使用浓盐酸-香草醛法检测提取液中的原花青素的含量,并计算黑果枸杞中的原花青素得率。
原花青素得率(%)=提取液的原花青素浓度×提取液体积/黑果枸杞的质量×(1-黑果枸杞的水分含量)
1.2.3 单因素实验 采用1.2.2方法提取黑果枸杞中的原花青素,提取条件为:固化反应条件为料液比1∶30 g/mL,提取温度40 ℃、提取时间90 min,考察不同体积分数的乙醇对原花青素得率的影响(0、10%、20%、30%、40%、50%、60%、70%、80%、90%);固化反应条件为料液比1∶30 g/mL、乙醇体积分数50%,提取时间90 min,考察不同温度(30、40、50、60、70 ℃)对原花青素得率的影响;固化反应条件为料液比1∶30 g/mL、乙醇体积分数50%、提取温度50 ℃,考察不同的提取时间(15、30、45、60、75、90 min)对原花青素得率的影响;固化每次反应条件为乙醇体积分数50%,提取温度50 ℃、提取时间2 h,考察不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30 g/mL)对原花青素得率的影响。
1.2.4 Box-Behnken中心组合实验设计 在单因素实验的基础上,每个因素选取三个对原花青素得率影响较大的水平,建立三因素三水平的Box-Behken中心组合实验,以原花青素得率为响应值,各因素的三个水平采用-1、0、1进行编码,如表1。
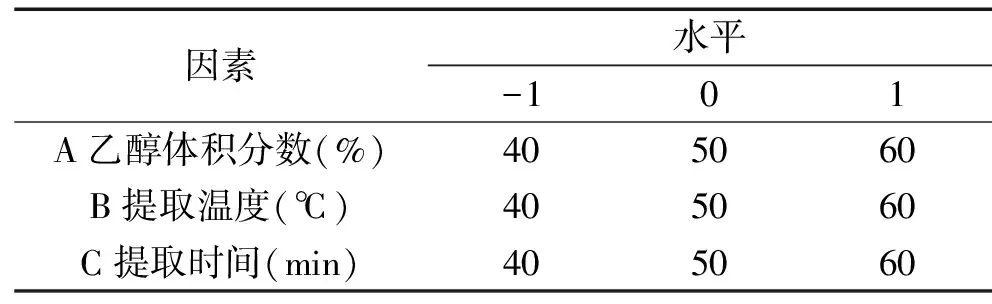
表1 响应曲面设计实验因素水平和编码
2 结果与分析
2.1 儿茶素标准曲线的绘制
实验得到回归方程为Y=0.0033X+0.0302,相关系数R2=0.9993,表明原花青素在0~400 μg/mL浓度范围内与吸光度值呈现良好的线性关系。以儿茶素浓度为横坐标,对应吸光度值为纵坐标建立标准曲线,如图1所示。

图1 儿茶素标准曲线Fig.1 Standurd curve of catechin
2.2 单因素实验
2.2.1 乙醇体积分数对原花青素得率的影响 从图2中可以看出,随着乙醇体积分数的不断增大原花青素得率呈先升高再下降趋势,当乙醇体积分数为50%时,得率最高。根据有机溶剂“相似相溶原理”,原花青素的溶出度与溶剂的极性和原花青素本身的极性相关,极性相似可达到最大溶出度。根据单因素实验结果,选择最佳的乙醇体积分数为50%。根据曲线变化规律,在Box-Behnken中心组合实验设计中,乙醇体积分数选取40%~60%范围。

图2 乙醇体积分数对原花青素得率的影响Fig. 2 Effect of alcohol concentration on yield of proanthocyanidins
2.2.2 提取温度对原花青素得率的影响 从图3中可以看出,温度在50 ℃以下时,原花青素得率呈现上升的趋势,后随着温度的增加,得率逐渐下降。这是因为高温虽然能促进物质的溶出,但同时也会使原花青素失活。温度在50 ℃时得率最高,在Box-Behnken中心组合实验设计中选取40~60 ℃为实验温度范围。
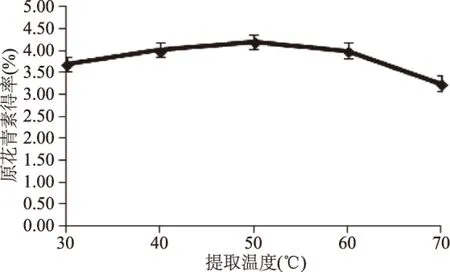
图3 提取温度对原花青素得率的影响Fig.3 Effect of temperature on yield of proanthocyanidins
2.2.3 提取时间对原花青素得率的影响 由图4可知,在初始阶段,原花青素得率随时间的延长而增加,提取时间在30~60 min时得率达到最高水平范围,此后继续延长提取时间,原花青素的提取量略有下降并趋于平稳。产生此结果的原因在于时间过短原花青素不能充分提取,时间过长导致原花青素酚羟基结构破坏,影响得率,且不够经济。为了充分提取出原料中所含的原花青素,提高原花青素得率,在Box-Behnken中心组合实验设计中选取提取时间为40~60 min。
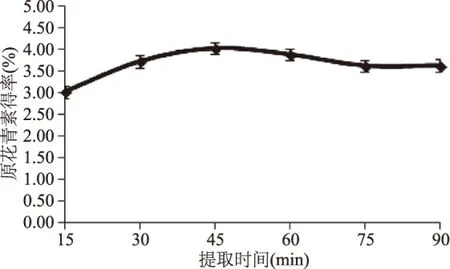
图4 提取时间对原花青素得率的影响Fig.4 Effect of time on extraction yield of proanthocyanidins
2.2.4 料液比对原花青素得率的影响 由图5可知,原花青素得率先随着料液比的增加而升高,但是料液比达到1∶20 g/mL时,原花青素得率变化极其缓慢,并在此后呈现较平稳趋势,这是随着料液比增加,浸提物与提取液的接触面积增大,从而使提取结束之后残留在料渣中的原花青素损失越来越少,当料液比达到一定数值后,这种损失会维持在较低水平并且较难继续降低而不再呈现明显的函数变化关系,不属于提取参数优化的显著性因素。因此,综合考虑料液比的增加带来效果、造成的资源和能源消耗等因素,最终选取料液比为1∶25 g/mL进行实验。
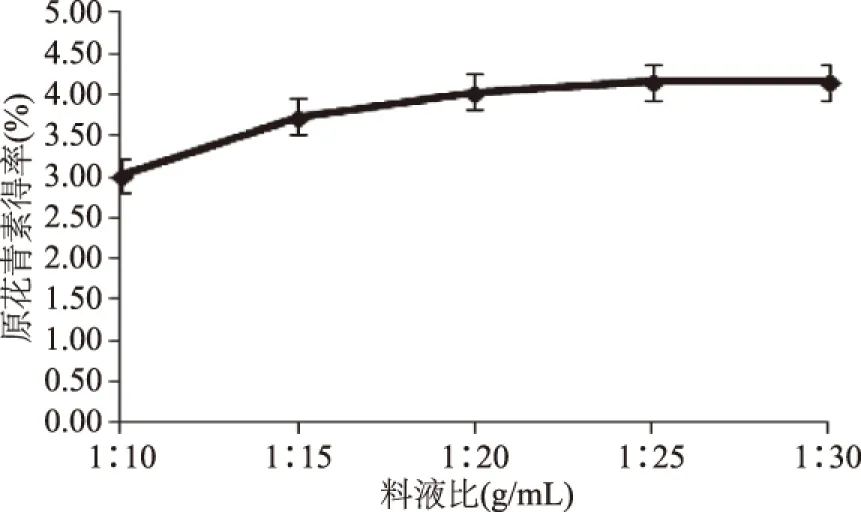
图5 料液比对原花青素得率的影响Fig.5 Effect of ratios of water to material on yield of proanthocyanidins
2.3 Box-Behnken实验设计(BBD)结果及数据分析
2.3.1 BBD实验结果 根据单因素实验结果,由Minitab 17统计分析软件设计出的实验方案及实验结果如表2所示,以原花青素得率为响应值,以乙醇体积分数,提取温度,提取时间为自变量,建立三因素三水平中心组合实验设计共包括15个实验方案,其中12个析因实验,3个中心点实验,用以计算实验误差。
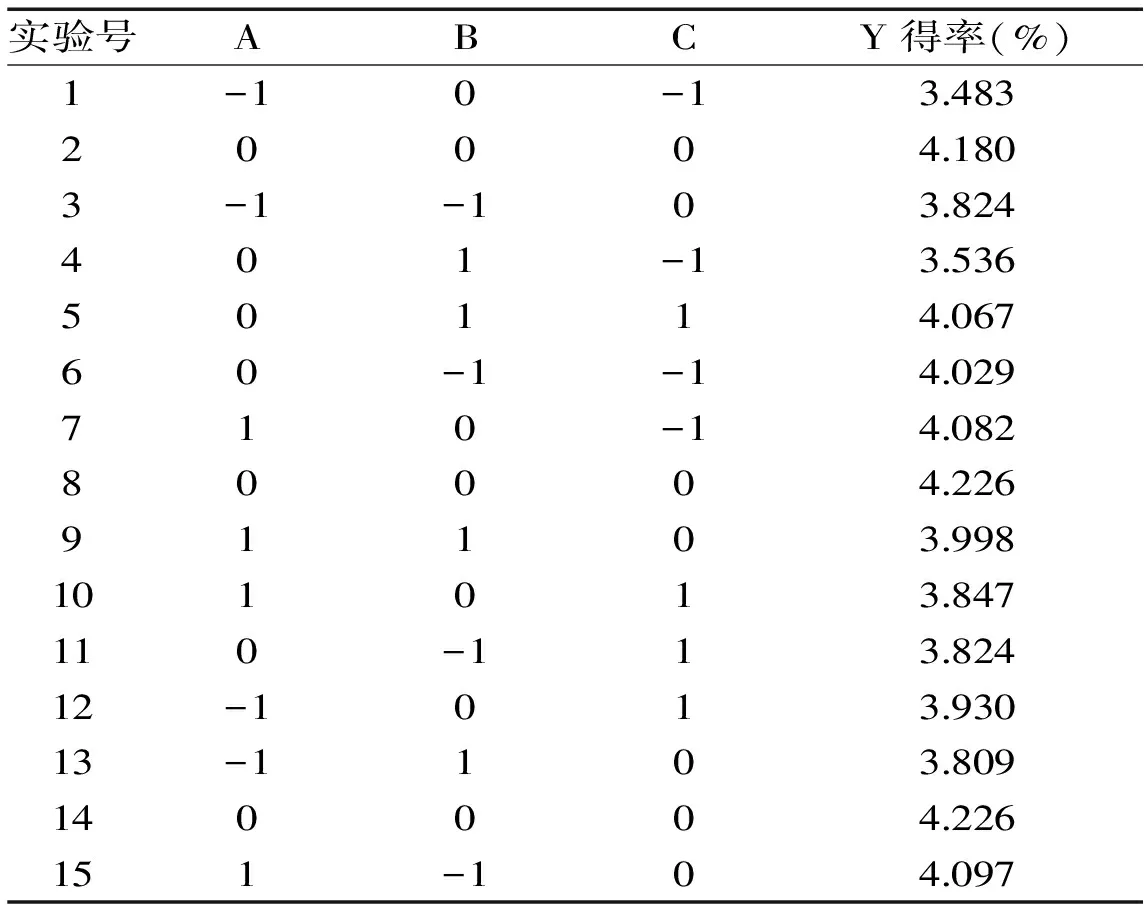
表2 响应面实验设计及原花青素得率
2.3.2 回归方程拟合及方差分析 采用Minitab17对所得数据进行回归分析,结果见表3,对各因素拟合后得到回归方程:
Y(%)=4.2107+0.1223A-0.0455B+0.0673C-0.1536A2-0.1251B2-0.2216C2-0.0210AB-0.1705AC+0.1840BC
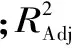
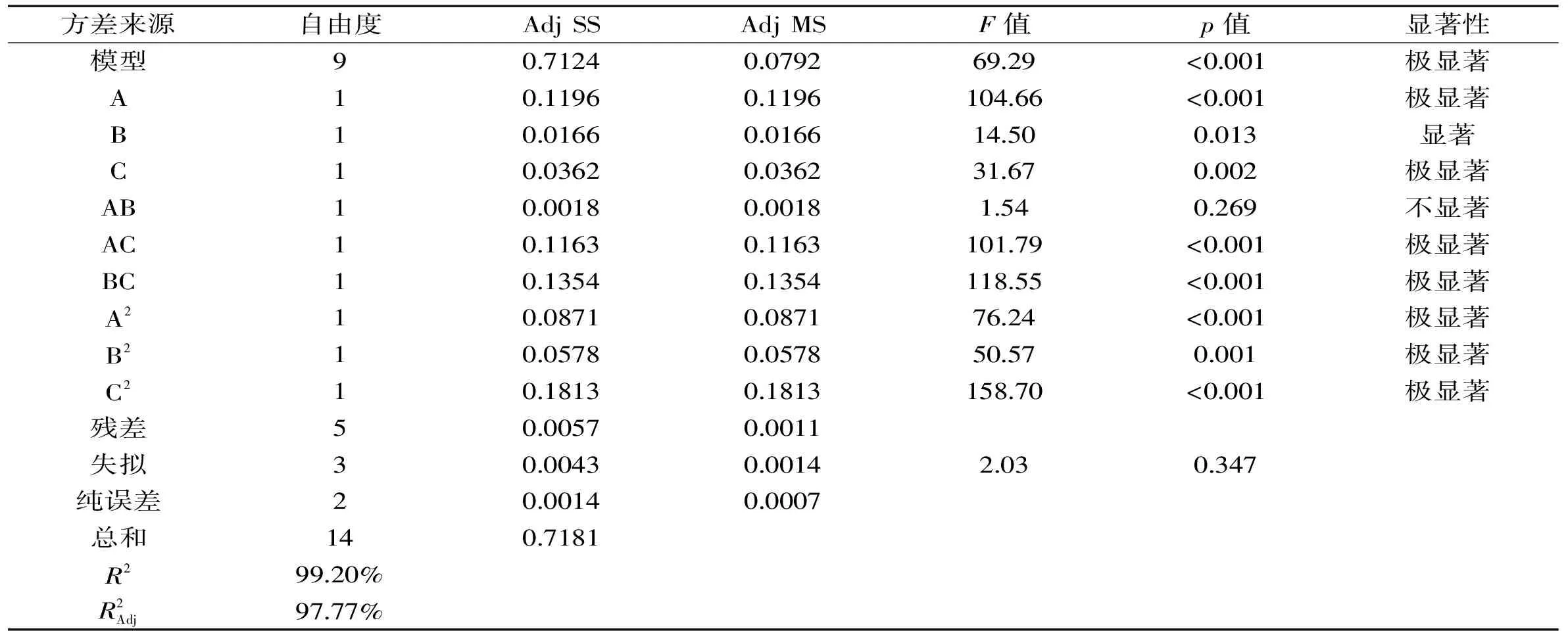
表3 回归模型及方差分析
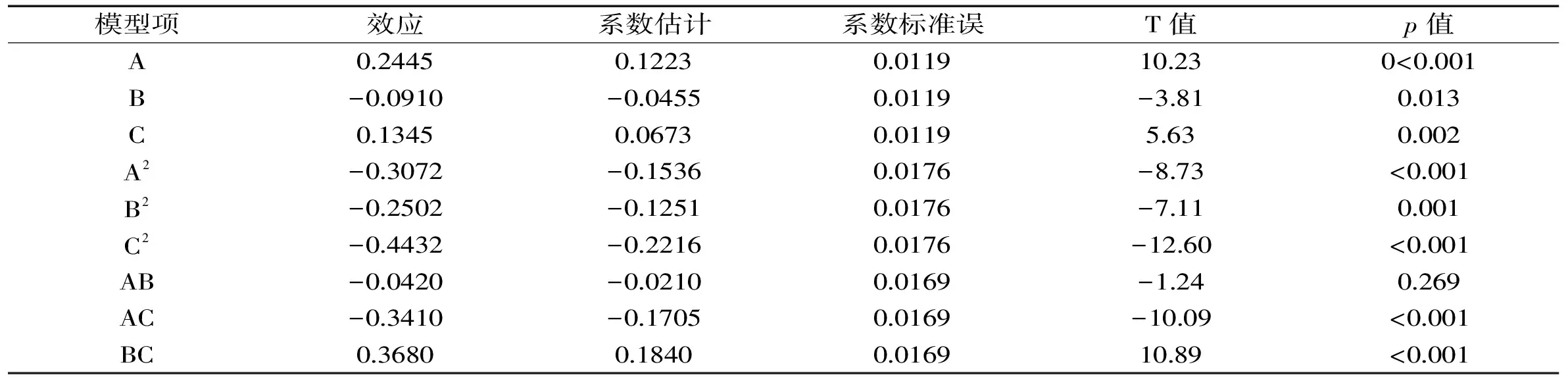
表4 回归方程系数显著性检验表
由表4可知,一次项和二次项的影响显著,交互项AC和BC对响应值影响也显著,这说明实验因子对响应值的影响不是直接线性关系,同时各因素对响应值显著性的排序为A>C>B。
2.3.3 响应面图分析 响应面是优化存在多因素影响实验条件的寻优方法,通过固定数量的实验次数可以连续的对实验因素进行分析,并得到直观的3D曲面图进而评估各因素间的交互作用。根据软件Minitab17获得响应值的3D曲面,分析各因素对原花青素得率的影响及各因素间的相互作用。图6~图8中所示为当乙醇的体积分数(A)、提取温度(B)、提取时间(C)中任意一个因素为零水平时,其余两个因素间的交互作用对原花青素得率的影响。
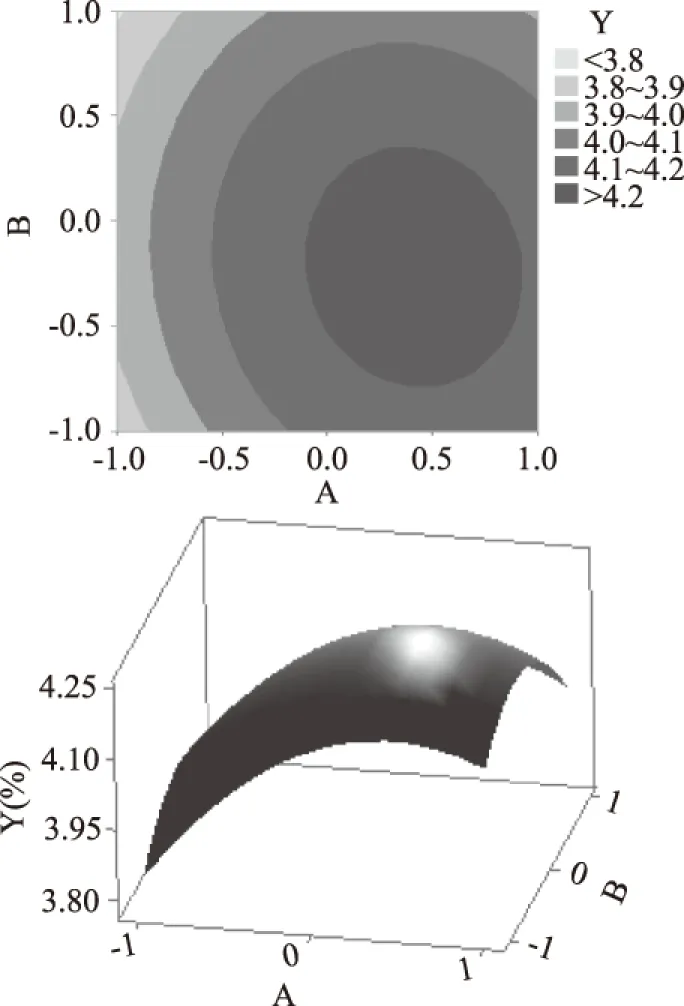
图6 Y=f(A,B)的响应面立体分析及其等高线图Fig.6 Response surface plots of variable parameters A and B on the yield of proanthocyanidins
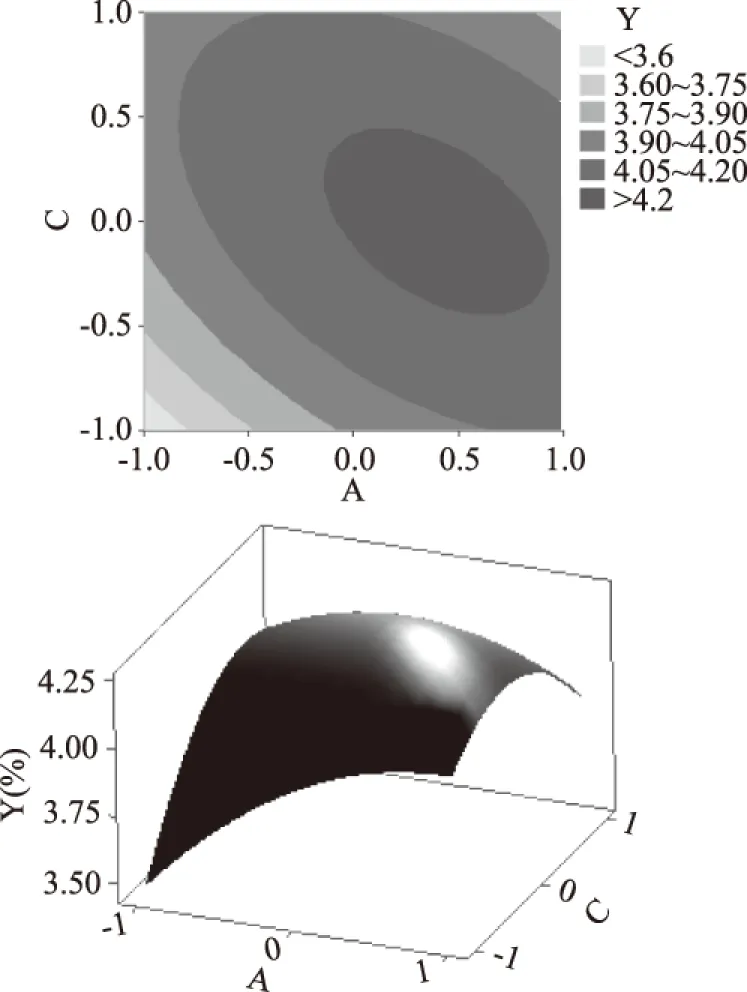
图7 Y=f(A,C)的响应面立体分析及其等高线图Fig.7 Response surface plots of variable parameters A and C on the yield of proanthocyanidins

图8 Y=f(B,C)的响应面立体分析及其等高线图Fig.8 Response surface plots of variable parameters B and C on the yield of proanthocyanidins
根据回归方程得出不同因素的响应面结果见图6~图8,从该组图可以分析出多个自变量对响应值的影响。在响应面图中,曲面越陡峭,则该因素对响应值的影响越显著。同时,在控制两个自变量之外的因素不变的情况下,两个有交互的自变量对响应值的影响也可以从响应面图的曲面上看出。图6所示为固定提取时间为零水平,乙醇体积分数和提取温度对原花青素得率的影响和两者之间的交互作用。乙醇体积分数较低时,得率随提取温度增加呈先上升后下降的趋势;乙醇体积分数较高时,得率随提取温度呈下降趋势,温度越高,下降幅度越大。虽然乙醇的体积分数和提取温度对响应值而言都具有显著影响,但是二者交互对响应值的影响不显著(p=0.269)。
图7所示为固定提取温度为零水平,乙醇体积分数和提取时间对原花青素得率的影响和两者之间的交互作用。在乙醇体积分数较低时,原花青素得率随提取时间延长呈上升趋势;随着乙醇体积分数的提高,原花青素得率转为下降的趋势,并且乙醇体积分数和提取时间的交互对响应值的影响极显著(p<0.001)。
图8所示为固定乙醇体积分数为零水平,提取温度和提取时间对原花青素得率的影响和两者之间的交互作用。在实验的提取温度范围内,随着提取时间的延长原花青素的得率呈先升高后下降的趋势,这是因为在较低温度条件下,黑果枸杞中原花青素稳定性较好;随着温度的升高和时间的延长,原花青素稳定性逐渐降低,其含量检测结果呈降低趋势,且温度越高,含量检测结果降低越快,因此提取温度和提取时间的交互会对原花青素的活性形成影响[13]。
2.3.4 验证实验 对回归方程求解,得率达到最大值时的提取条件为乙醇体积分数为55.60%,提取温度为45.77 ℃,提取时间为47.612 min,最高原花青素得率达到4.250%,为方便实际操作将实验条件定为乙醇体积分数为56%,提取温度为46 ℃,提取时间为48 min。取三等份黑果枸杞进行原花青素提取平行验证实验,验证实验所得得率分别为4.308%、4.312%、4.325%,平均得率为4.315%,与预测值相对误差为1.5%,结果表明,经过响应回归方程拟合出的理论值与实际值偏差小,证明用响应面法对优化黑果枸杞原花青素的提取工艺有指导意义。
3 结论
采用单因素-响应面法建立了原花青素得率的二次多项拟合方程及三维响应面图,由该模型优化的原花青素提取条件为:乙醇体积分数为56%,提取温度为46 ℃,提取时间为48 min,在此条件下黑果枸杞原花青素得率可达4.315%,RSD为1.5%,高于前期提取工艺优化后2.990%的得率[12]。优化后的工艺安全、操作简单,为黑果枸杞中原花青素的提取工业化提供了重要的参考依据。
[1]中国科学院中国植物志编辑委员会.中国植物志(第六十七卷第一分册)[M].北京:科学出版社,1978:10.
[2]Plump GW,Depascual TS,Santos BC,et al.Antioxidant properties of catechins and proanthocyanidins:effect of polymerisation,galloylation and glycosylation[J].Free Radic Res,1998,29(4):351.
[3]张绘芳,李霞,王建刚,等.塔里木河下游植物群落结构特征分析[J].生态环境,2007,16(4):1219-1224.
[4]刘新民.维吾尔药志(下)[M].乌鲁木齐:新疆科技卫生出版社,1999:478-485.
[5]汪洋,丁龙,王四清.不同产地黑果枸杞中原花青素和花青素含量研究[J].食品工业科技,2016(13):122-126.
[6]王建明,李早慧.高效液相法测定视力健咀嚼片中原花青素的含量[J].中国医药导刊,2012,14(1):167-168.
[7]张妍,吴秀香.原花青素研究进展[J].中药药理与临床,2011(6):112-116.
[8]董晓敏.葡萄籽原花青素的提取、抑菌活性及其对鸡肉保鲜研究[D].济南:齐鲁工业大学,2015.
[9]陈月英,王彦平,孙瑞琳,等.葡萄皮渣原花青素微波辅助提取工艺的优化及其抗氧化活性研究[J].北方园艺,2016(11):123-126.
[10]孙楠,杜连平,孙跃宁,等.黑果枸杞、枸杞、黑加仑中原花青素含量对比研究[J].食品与药品,2013(4):275-277.
[11]张岩波,王多东,张全礼.若羌人工种植黑果枸杞原花青素含量的测定[J].新疆农垦科技,2016(2):46-47.
[12]任小娜,陈志梅,曾俊,等.黑果枸杞中原花青素提取条件的优化与含量测定[J].食品与发酵工业,2015(1):147-150.
[13]任小娜,迪丽努尔,陈志梅,等.黑果枸杞中原花青素稳定性和抗氧化性研究[J].湖北农业科学,2016(14):3697-3700.
Optimization of extraction of proanthocyanidins fromLyciumruthenicumMurr. by response surface analysis
ZHAO Wen-juan1,SONG Yang2,LI Wen-jing3,YANG Hong-jiang1,*
(1.Key Lab of Industrial Fermenting Microbiology,Ministry of Education, Tianjin University of Science and Technology,Tianjin 300457,China; 2.College of Biotechnology,Qilu University of Technology,Jinan 250353,China; 3.Research & Design Institute of Food and Fermentation Industry of Shandong Province,Jinan 250013,China)
In order to improve the yield,based on the single factor experiments,the response surface methodology was employed to optimize the extraction conditions of proanthocynidins fromLyciumruthenicumMurr.. The process of quadric polynomial mathematics model was established by investigating the effect of ethanol concentration,extraction temperature,extraction time and their interaction on proanthocyanidins. Experiments showed that regression equation fit well with experimental data and the effect of investigated parameters were extremely significant. The optimal of extraction conditions including ethanol concentration,extraction temperature,extraction time were 56%,46 ℃ and 48 min respectively. The content of proanthocyanidins extracted fromLyciumruthenicumMurr. under the conditions was 4.315%. Compared with the predicted value of response surface,the error was 1.5%,which indicates that it is suitable for proanthocyanidins extracts fromLyciumruthenicumMurr.
LyciumruthenicumMurr.;proanthocyanidins;extraction;response surface
2016-12-08
赵文娟(1982-),女,在读博士研究生,高级工程师,研究方向:发酵工程,E-mail:15550033656@163.com。
*通讯作者:杨洪江(1966-),男,博士,教授,研究方向:微生物学,E-mail:hongjiangyang@tust.edu.cn。
山东省优秀中青年科学家科研奖励基金(2014BSB01118)。
TS255.1
B
1002-0306(2017)09-0252-06
10.13386/j.issn1002-0306.2017.09.039
