铁皮石斛多糖液态发酵工艺及其抗氧化活性研究
2017-06-05刘光荣王笑月王巧娥董银卯
薛 燕,李 丽,刘光荣,王笑月,王巧娥,董银卯,*
(1.北京市植物资源重点实验室,北京工商大学,北京 100048; 2.无限极(中国)有限公司,广东广州 510623)
铁皮石斛多糖液态发酵工艺及其抗氧化活性研究
薛 燕1,李 丽1,刘光荣2,王笑月1,王巧娥1,董银卯1,*
(1.北京市植物资源重点实验室,北京工商大学,北京 100048; 2.无限极(中国)有限公司,广东广州 510623)
探讨液态发酵铁皮石斛多糖的最佳工艺及其抗氧化活性。采用单因素及正交实验研究了发酵温度、转速、pH和发酵时间对发酵工艺的影响,得到了液态发酵的最优条件:发酵温度28 ℃,pH4.5,转速170 r/min,发酵时间54 h;发酵后铁皮石斛水提多糖的总抗氧化能力、清除DPPH及ABTS自由基能力均有所提高,而且均具有很强的量效关系;发酵后石斛多糖的平均分子量由4.234×105降为1.077×105,推测发酵多糖抗氧化能力的提高可能与微生物发酵过程导致石斛多糖分子量的减小有关。
铁皮石斛,水提法,液态发酵法,多糖,抗氧化活性
铁皮石斛(DendrobiumofficinaleKimuraetMigo)是兰科石斛属多年生附生草本植物的干燥茎[1],为我国传统的名贵中药材,是石斛中的极品,民间称作“救命仙草”,国际药用植物界称其为“药界大熊猫”。铁皮石斛具有益胃生津、滋阴清热、免疫调节、延缓衰老等功效,用于治疗阴伤津亏,口干烦渴,食少干呕,病后虚热,目暗不明等[2]。铁皮石斛中主要含有多糖、生物碱、芳香族化合物以及小分子物质等,其中多糖是其主要的功效物质。现有研究表明,铁皮石斛多糖具有调节免疫、抗肿瘤、调节血糖、抗氧化及抑菌等功效[3-7],在医疗方面应用较为广泛。对于铁皮石斛中多糖成分的提取方法,文献报道较多的有水提法、超声法和酶解法等。铁皮石斛作为我国名贵中药材,如何更高效的利用铁皮石斛是目前研究中应该解决的问题。在中药发酵过程中,由于微生物的生长代谢和生命活动具有强大分解转化物质的能力,并能产生多种次生代谢产物,可以比一般的物理或化学手段更大幅度地改变药性,产生新的化学成分或活性更强的先导化合物[8-9],达到提高药效、改变药性、降低毒副作用等目的[10],因此,本研究旨在探讨液态发酵法制备铁皮石斛多糖的最佳工艺,并对比发酵前后多糖抗氧化活性及分子量变化,以提高铁皮石斛多糖的抗氧化活性,并初步探讨多糖抗氧化活性差异的原因,为铁皮石斛的进一步开发利用提供基础数据。
1 材料与方法
1.1 材料与仪器
铁皮石斛 采购于云南普洱,粉碎成粉末,30目过筛;酿酒酵母(Saccharomycescerevisiae) 编号:2.3880,分离源:壳斗科植物树皮,109CFU/mL,购于中国普通微生物菌种保藏中心;葡萄糖(生物试剂)、蛋白胨(生物试剂)、酵母膏(生物试剂)、抗坏血酸 北京百灵威试剂公司;DPPH(1,1-二苯基-2-三硝基苯肼)及ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐] sigma试剂公司;TPTz(2,4,6-三吡啶基三嗪) 阿达玛斯试剂公司;过二硫酸钾、三水合醋酸钠、醋酸、六水合氯化铁、亚硫酸铁、盐酸苯酚、浓硫酸、无水乙醇 均为分析纯。
空气恒温摇床 上海福玛实验设备有限公司;TECAN酶标仪 奥地利TACAN有限公司;磁力搅拌电热套 天津市泰斯特仪器有限公司;雷磁PHS-3C型pH计 上海仪电科学仪器股份有限公司;洁净工作台 北京世安科林净化技术有限公司;立式压力蒸汽灭菌器 上海博迅实业有限公司;真空冷冻干燥机 美国Virtis公司;凝胶色谱仪e2695 美国Waters公司;十八角度激光光散射仪 美国Wyatt技术公司。
1.2 实验方法
1.2.1 多糖含量测定方法 采用苯酚硫酸法[11]测定葡萄糖标准曲线,得到方程y=11.138x-0.0068,相关系数R2=0.9981,式中y为吸光度,x为葡萄糖的质量浓度(mg/mL),线性范围是0.01~0.1 mg/mL。
铁皮石斛多糖得率计算公式:
石斛多糖得率(%)=(多糖质量/铁皮石斛干质量)×100。
1.2.2 发酵原液制备 石斛发酵液的制备:通过前期研究,已得到水提法最优工艺,故利用最优水提工艺(料液比1∶100 g/mL,提取温度100 ℃,提取时间3 h)制备石斛提取液[11-14],并加入酵母生长所需培养基(每100 mL石斛提取液中加入1 g葡萄糖,1 g蛋白胨,0.5 g酵母膏),用于后续发酵工艺研究。
1.2.3 单因素实验选择石斛多糖最佳发酵工艺 准备适量石斛发酵原液,灭菌后加入2%的酿酒酵母种子液,以发酵pH5.0,转速120 r/min,发酵温度30 ℃,发酵时间20 h为发酵一次的条件。当变动一因素时,其他因素与上述提取一次的条件一致。变动的因素:发酵pH为5.0、6.0、7.0、8.0、9.0,转速为100、120、140、160、180 r/min,发酵温度为25.0、27.5、30.0、32.5、35.0 ℃,发酵时间为每2 h测一次,并在600 nm下测定其吸光值[15-17]。
1.2.4 正交实验选择石斛多糖最佳发酵工艺 单因素实验表明影响菌生长的主要因素有pH、转速、温度和时间,选择pH、转速、温度和时间四个因素为考察因素,每个因素各取3个较优水平做四因素三水平正交实验设计(见表1)。
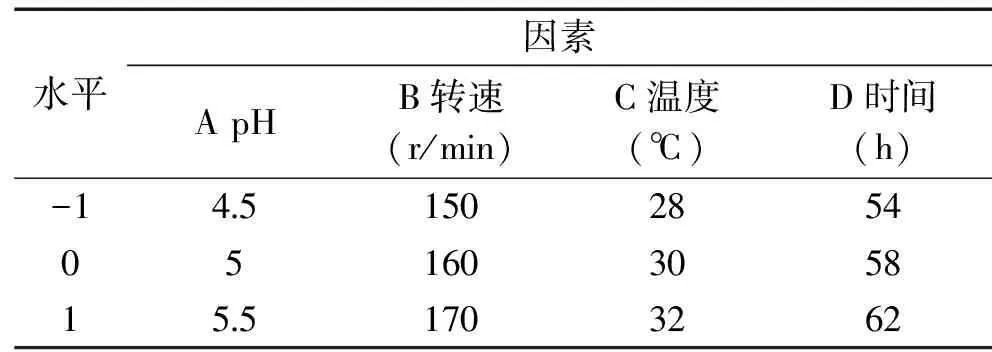
表1 正交实验因素水平表
1.2.5 石斛多糖发酵液清除DPPH自由基能力测定 DPPH在乙醇溶液中呈紫色,且在517 nm处有最大吸收值。加入抗氧化剂后,DPPH与抗氧化剂中的氢结合,颜色发生改变,吸光度值也随之发生变化,从而用来评价其清除自由基能力的强弱[18-19]。本实验在试管中加入不同质量浓度的铁皮石斛多糖水溶液及等体积的0.2 mmol/L DPPH乙醇溶液,混匀后于暗处静置30 min,以无水乙醇为参比,在波长517 nm处测定其吸光度值。平行测定3次,取平均值。
清除率(%)=[(B+A-C)/B]×100
式中,A-1 mL乙醇溶液加1 mL样品溶液的吸光度;B-1 mL乙醇溶液加1 mL DPPH溶液的吸光度;C-1 mL样品溶液加1 mL DPPH溶液的吸光度。
1.2.6 石斛多糖发酵液清除ABTS自由基能力测定 ABTS,化学命名为2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐,在适当的氧化剂作用下会生成蓝绿色水溶性的ABTS·,其在734 nm处有吸收峰。当有抗氧化剂存在时,ABTS·的产生受到抑制,溶液颜色变浅,吸光值降低,因此可采用吸光光度法评价样品清除ABTS自由基的能力[20]。本实验在试管中加入0.2 mL不同浓度的待测液和0.8 mL ABTS·工作液,充分混匀后,在室温条件下避光反应30 min,用酶标仪测定其在734 nm下的吸光值A,以水为参比。平行测定3次,取平均值。
清除率(%)=[(A0-A)/A0]×100
式中,A-0.2 mL样品加0.8 mL ABTS·工作液的吸光度;A0-0.2 mL水加0.8 mL ABTS·工作液的吸光度。
1.2.7 石斛多糖发酵液总抗氧化能力测定 TPTz中的Fe3+可被样品中还原物质还原为Fe2+,呈现出明显的蓝色,并于593 nm处具有最大吸收峰,由吸光度大小可计算样品抗氧化活性的强弱[21-22]。本实验在试管中分别加入不同浓度的样品溶液30 μL,加入900 μL的FRAP工作液,再加入90 μL蒸馏水混合均匀,对照中样品替代成水即可,37 ℃避光反应30 min,在593 nm下测定其吸光值,样品总抗氧化能力用亚硫酸铁溶液浓度来表示。平行测定3次,取平均值。
1.2.8 多糖平均分子量的测定 采用凝胶渗透色谱——十八角度激光散射联用系统(GPC-MALS系统)检测其分子量。将水提多糖与微生物发酵多糖配制成3 mg/mL的溶液后经0.22 μm的水系过滤头,经GPC-MALS法测定。实验具体条件如下:
输液系统:Waters e 2695系统;
凝胶色谱柱:Shodex SUGER KS-805/KS-803联用;
检测器:十八角度激光光散射仪与示差检测器联用;
进样体积:0.1 mL;
流速:0.8 mL/min;
柱温:60 ℃;
示差折光检测器温度:50 ℃;
流动相:0.1 mol/L硝酸钠溶液与0.02%叠氮化钠溶液的混合溶液(流动相经0.22 μm水系过滤膜低真空度过滤)。
2 结果与分析
2.1 单个因素对液态发酵工艺的影响
2.1.1 pH对发酵工艺的影响 pH的变化会影响酿酒酵母的生长情况,结果如图1所示。

图1 pH对酵母菌生长的影响Fig.1 Effect of pH on the growth of Saccharomyces cerevisiae
从图1可以看出,随着pH的增加,酵母菌的生长趋势下降,这可能是因为酵母菌适宜在偏酸性环境生长的原因。pH为5.0时,酵母菌的生长情况最佳。
2.1.2 转速对发酵工艺的影响 转速的变化会影响酿酒酵母的生长情况,结果如图2所示。
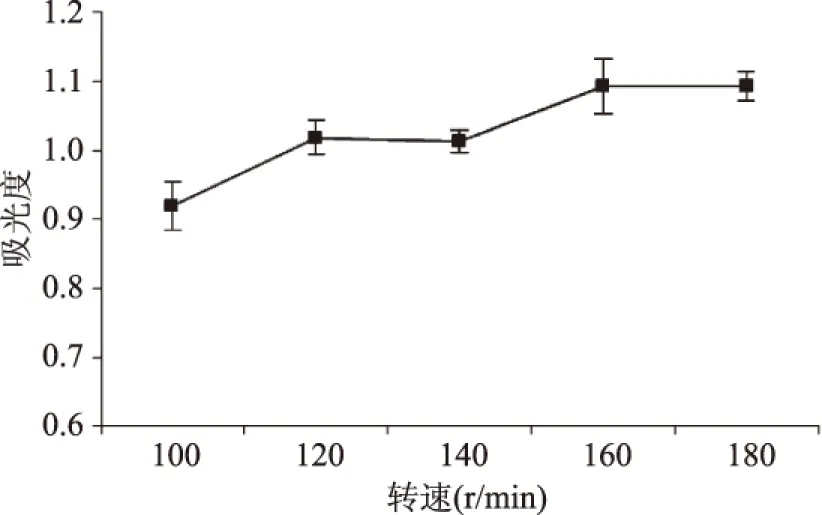
图2 转速对酵母菌生长的影响Fig.2 Effect of agitation speed on the growth of Saccharomyces cerevisiae
从图2可以看出,随着转速的增加,菌的生长旺盛,当转速大于160 r/min时,菌的生长不明显。这可能是因为摇床能够加速发酵过程中产生的CO2的排出,并能够使酵母悬浮在培养液中,在一定程度上增加菌液浓度。低转速情况下酿酒酵母的生长和发酵情况较差可能由于CO2未能及时排除,胁迫酿酒酵母,影响到其生长和发酵。转速为160 r/min时,酵母菌的生长情况最佳。
2.1.3 发酵温度对发酵工艺的影响 发酵温度的变化会影响酿酒酵母的生长情况,如图3所示。
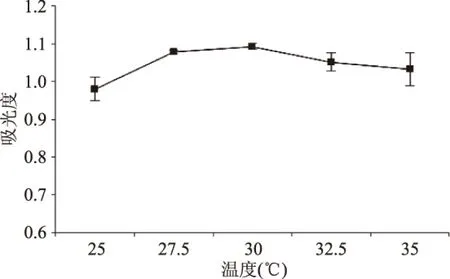
图3 温度对酵母菌生长的影响Fig.3 Effect of temperature on the growth of Saccharomyces cerevisiae
从图3可以看出,当温度小于30 ℃时,酵母菌的OD值随温度升高而增加;当温度大于30 ℃时,酵母菌的OD值随温度升高反而缓慢降低。其原因可能是低温度影响了酵母菌中酶的活性,糖的转运速度下降,较高温度下酿酒酵母对酒精的敏感性升高,可能是由于培养温度升高导致发酵不完全造成。温度为30 ℃时,酵母菌的生长情况最佳。
2.1.4 发酵时间对发酵工艺的影响 发酵时间的变化会影响酿酒酵母生长情况,结果如图4所示。
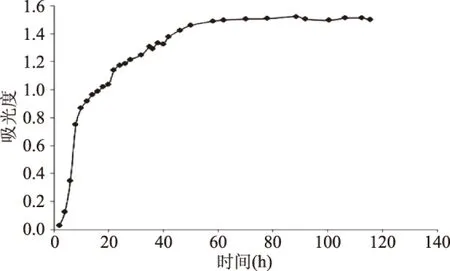
图4 时间对酵母菌生长的影响Fig.4 Effect of time on the growth of Saccharomyces cerevisiae
由图4可知,4 h内,酵母菌处于生长迟缓期,菌种增长缓慢;酵母菌在4~58 h内处于生长对数期,菌种生长较快;58 h之后逐渐趋于平缓,属于稳定期;所以发酵58 h为最佳培养时间。
2.2 最佳发酵工艺的优化
液态发酵制备铁皮石斛多糖的正交实验结果见表2。
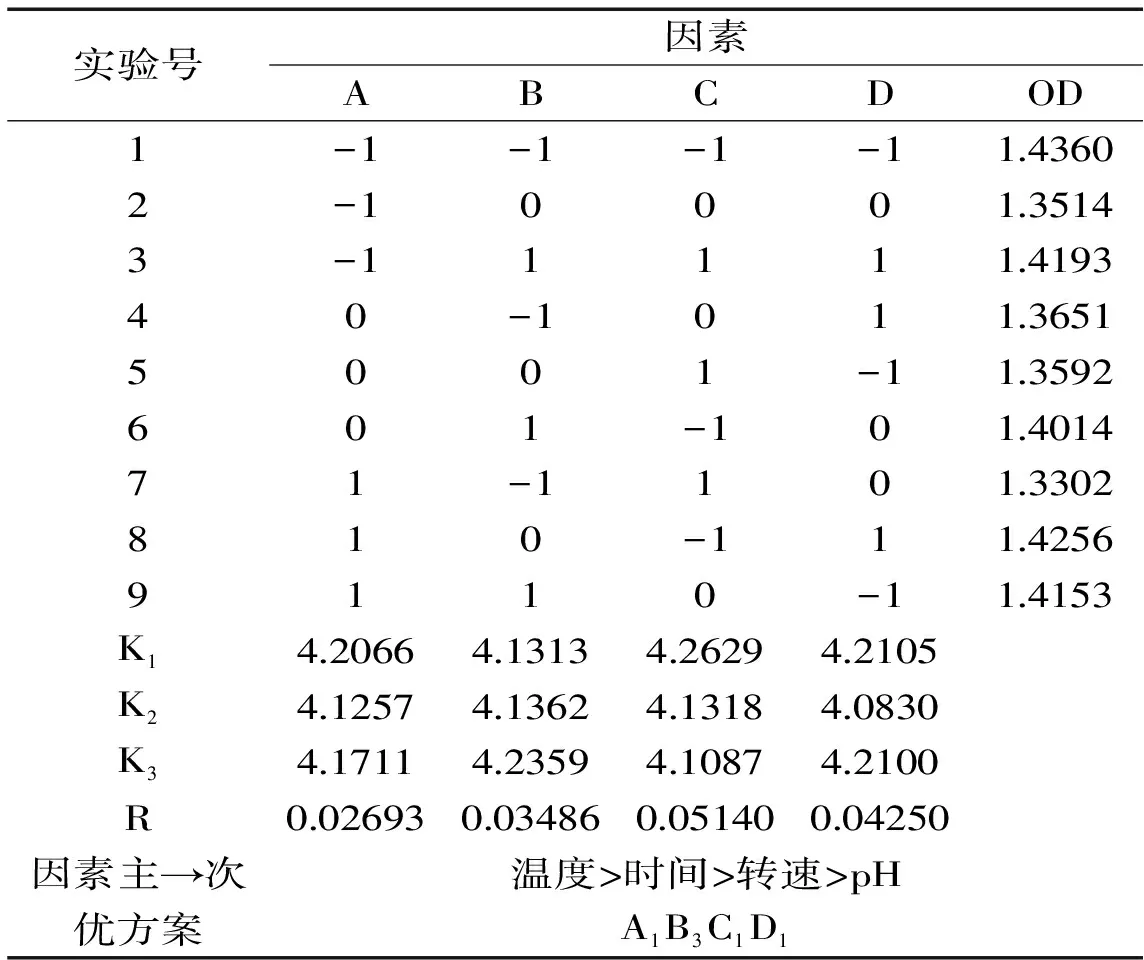
表2 正交实验结果及分析
由表2中R值可知,这4个因素的主次顺序为发酵温度、时间、转速、pH。最优组合为A1B3C1D1,即温度28 ℃,pH为4.5,转速在170 r/min时酵母发酵54 h,对得到的工艺条件做验证实验,重复3次,此条件下测得酿酒酵母的OD值是1.539±0.03631。
2.3 发酵对石斛多糖抗氧化活性的影响
2.3.1 发酵前后石斛多糖清除DPPH自由基的能力 石斛多糖提取液发酵前后清除DPPH自由基的能力见图5。
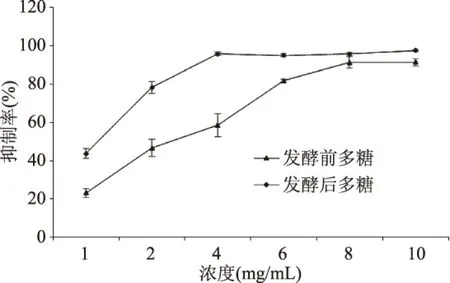
图5 发酵前后石斛多糖清除DPPH自由基的能力Fig.5 The scavenging DPPH ability of DOP before and after fermentation
由图5可以看出,铁皮石斛多糖发酵前后清除率均随着质量浓度的增加而逐渐升高,而当发酵前多糖浓度到达8 mg/mL时,发酵后多糖到达4 mg/mL时,清除率随质量浓度的增加趋于平缓。根据发酵前多糖清除率拟合曲线y=-0.0006x4+0.0127x3-0.0991x2+0.4076x-0.0771,R2=0.9868,计算得到发酵前多糖对DPPH自由基的IC50为2.226 mg/mL;根据发酵后多糖清除率拟合曲线y=0.003x3-0.063x2+0.4196x+0.0768,R2=0.9946,计算得到发酵后多糖对DPPH自由基的IC50为1.162 mg/mL。
2.3.2 发酵前后石斛多糖清除ABTS自由基的能力 石斛多糖提取液发酵前后清除ABTS自由基的能力见图6。
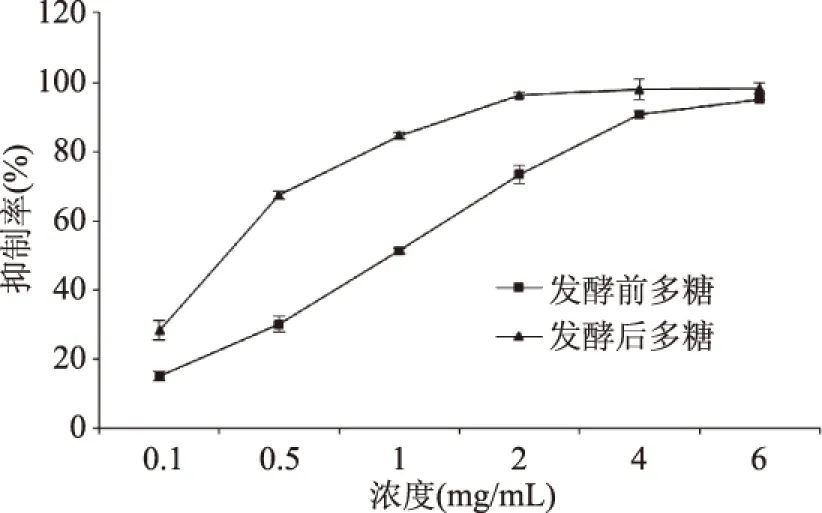
图6 发酵前后石斛多糖清除ABTS自由基的能力Fig.6 The scavenging ABTS ability of DOP after fermentation
由图6可以看出,发酵前后多糖对ABTS自由基的清除能力随着浓度的增加而升高,当发酵前多糖浓度为4 mg/mL时,发酵后多糖浓度为2 mg/mL时,清除率随着质量浓度的增加趋于平缓。根据发酵前多糖清除率拟合曲线y=0.0073x3-0.1036x2+0.4999x+0.093R2=0.9988,计算得到发酵前多糖对ABTS自由基的IC50为0.79 mg/mL;根据发酵后多糖清除率拟合曲线y=-0.0111x4+0.1484x3-0.6734x2+1.2299x+0.1776,R2=0.9951,计算得到发酵后多糖对ABTS自由基的IC50为0.235 mg/mL。
2.3.3 发酵前后石斛多糖的总抗氧化能力 石斛多糖提取液发酵前后总抗氧化能力见图8。
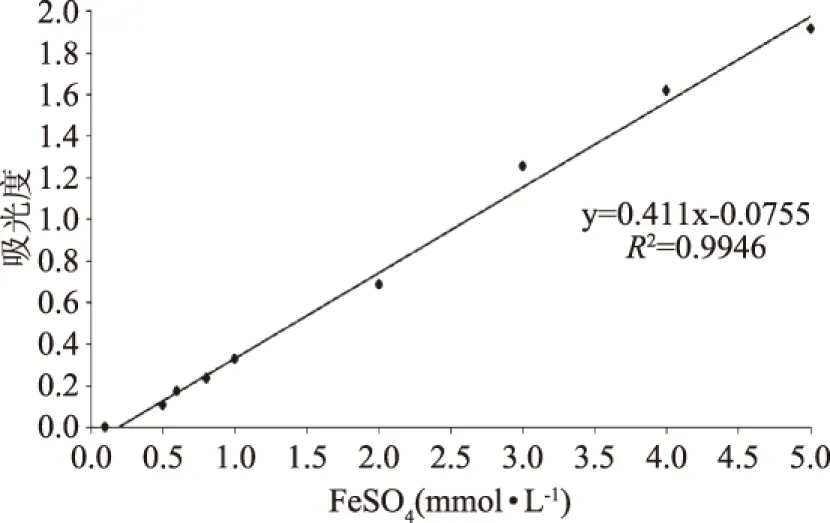
图7 总抗氧化测定标准曲线Fig.7 Standard curve of total antioxidant power
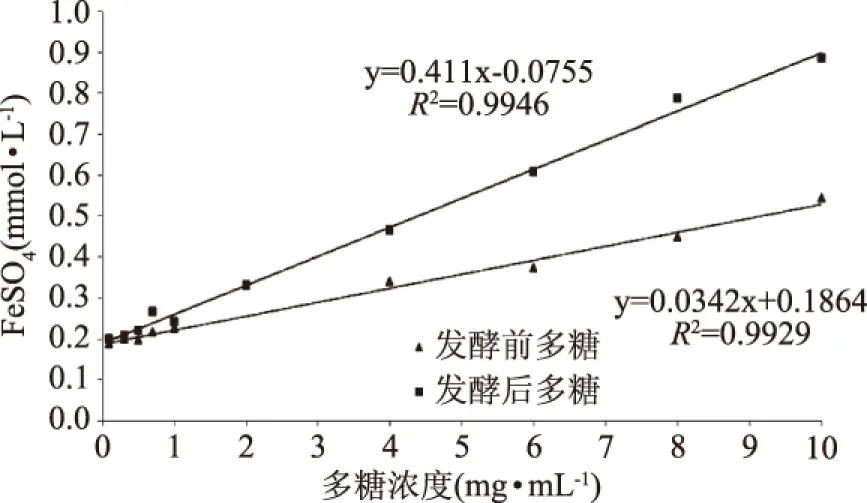
图8 发酵前后石斛多糖总抗氧化能力Fig.8 The total antioxidant of DOP after fermentation
由图7可以看出,FeSO4浓度在0.1~5 mmol/L范围内与吸光值呈良好的线性关系。拟合方程y=0.411x-0.0755,R2=0.9946。
由图8可以看出,发酵前后多糖总抗氧化活性随着质量浓度的增大而逐渐提高。
2.4 多糖分子量测定结果
由GPC-MALS系统测定发酵前后多糖分子量,结果显示发酵前多糖的平均分子量为4.234×105,发酵后多糖的平均分子量为1.077×105;发酵后多糖平均分子量与发酵前多糖相比缩小了4倍,经由微生物转化发酵多糖得到水解,使得裸露的羟基较多,可能是使其抗氧化活性比发酵前多糖好的原因。
3 结论
通过对铁皮石斛多糖液态发酵法的工艺进行研究,考察发酵pH、温度、转速及时间对酵母菌生长情况的影响,获得液态发酵适宜的参数,即温度28 ℃,pH为4.5,转速在170 r/min时酵母发酵54 h。
通过测定发酵前后多糖的总抗氧化能力、清除DPPH、ABTS自由基的能力,评价其抗氧化活性。发酵前多糖对DPPH、ABTS自由基的IC50分别为2.226、0.79 mg/mL;发酵后多糖对DPPH、ABTS自由基的IC50分别为1.162、0.235 mg/mL,表明发酵前后多糖均具有一定的抗氧化活性,且发酵后多糖抗氧化活性优于发酵前多糖。
通过GPC-MALS系统测定发酵前后多糖分子量,结果显示发酵前多糖的平均分子量为4.234×105,发酵后多糖的平均分子量为1.077×105,发酵后多糖平均分子量与发酵前多糖相比缩小了4倍。
[1]中国药典[S]. 2010 年版. 一部. 265-266.
[2]李桂锋,李进进,许继勇,等. 铁皮石斛研究综述[J]. 中药材,2010,33(1):150-153.
[3]He T B,Huang Y P,Yang L,et al. Structural characterization and immunomodulating activity of polysaccharide fromDendrobiumofficinale[J]. International Journal of Biological Macromolecules,2015,83(10):34-41.
[4]Zhang G,Nie S,Huang X,et al. Study onDendrobiumofficinaleO-acetyl-glucomannan(Dendronan®):Part VII. Improving Effects on Colonic Health of Mice.[J]. Journal of Agricultural & Food Chemistry,2016,64(12):2485-2491.
[5]Hou S Z,Liang C Y,Liu H Z,et al.DendrobiumofficinalePrevents Early Complications in Streptozotocin-Induced Diabetic Rats[J]. Evidence-based Complementary and Alternative Medicine,2016,2016(2):1-10.
[6]Luo Q L,Tang Z H,Zhang X F,et al. Chemical properties and antioxidant activity of a water-soluble polysaccharide from Dendrobium officinale[J]. International Journal of Biological Macromolecules,2016,89:219-227.
[7]Wu L S,Jia M,Chen L,et al. Cytotoxic and Antifungal Constituents Isolated from the Metabolites of Endophytic Fungus DO14 from Dendrobium officinale.[J]. Molecules,2015,21(1).
[8]王延年,董雪,乔延江,等. 中药发酵研究进展[J]. 世界科学技术(中医药现代化),2010,12(3):437-441.
[9]王兴红,李祺德,曹秋娥. 微生物发酵中药应成为中药研究的新内容[J]. 中草药,2001,32(3):267-268.
[10]李羿,刘忠荣,吴洽庆,等. 发酵中药——拓展中药新药研究开发的新空间[J]. 天然产物研究与开发,2004,16(2):179-181.
[11]范传颍,陶正明,吴志刚. 苯酚硫酸法与蒽酮硫酸法测定铁皮石斛中多糖含量的比较[J]. 浙江农业科学,2013,(7):799-801.
[12]杨娜,王鸿飞,许凤,等. 蕨麻多糖提取及抗氧化活性研究[J]. 中国食品学报,2014,14(2):60-66.
[13]张锐,曾冬云,龚兴国,等. 羊栖菜多糖的提取工艺研究[C]中国食品科学技术学会东西方食品业高层论坛. 2007:14-18.
[14]刘利娥,张浩勤,刘金盾,等. 芝麻叶多糖的提取及抗氧化活性研究[J]. 中国食品学报,2010,10(5):160-165.
[15]贾士儒,殷海松,邓桂芳,等. 裂褶菌液态深层培养条件的研究[J]. 中国食品学报,2006,6(2):46-49.
[16]朱双杰,向玉勇,罗侠,等. 酵母发酵法提取石耳粗多糖工艺优化[J]. 北京农学院学报,2012,27(1):65-68.
[17]李聪. 酿酒酵母培养条件及发酵培养基的优化[J]. 中国农学通报,2014,30(9):302-306.
[18]Brand-Williams W,Cuvelier M E,Berset C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology,1995,28(1):25-30.
[19]鲍素华,查学强,郝杰,等. 不同分子量铁皮石斛多糖体外抗氧化活性研究[J]. 食品科学,2009,30(21):123-127.
[20]Li X,Lin J,Han W,et al. Antioxidant ability and mechanism of rhizoma Atractylodes macrocephala.[J]. Molecules,2012,17(11):13457-13472.
[21]Benzie I F F,Strain J J. The Ferric Reducing Ability of Plasma(FRAP)as a Measure of “Antioxidant Power”:The FRAP Assay[J]. Analytical Biochemistry,1996,239(1):70-6.
[22]Nilsson J,Pillai D,Önning G,et al. Comparison of the 2,2′-azinobis-3-ethylbenzotiazo-line-6-sulfonic acid(ABTS)and ferric reducing anti-oxidant power(FRAP)methods to asses the total antioxidant capacity in extracts of fruit and vegetables[J]. Molecular Nutrition & Food Research,2005,49(3):239-246.
Study on polysaccharides submerged fermentation fromDendrobiumofficinaleand its antioxidant activity
XUE Yan1,LI Li1,LIU Guang-rong2,WANG Xiao-yue1,WANG qiao-e1,DONG Yin-mao1,*
(1.Beijing Key Laboratory of Plant Resources Research and Development, Beijing Technology and Business University,Beijing 100048,China; 2.Wuxianji(China)Co.,Ltd,Guangzhou 510623,China)
In this paper,the suitable submerged fermentation method and antioxidant activity ofDendrobiumofficinalepolysaccharide(DOP)were studied. The effects of temperature,agitation speed,pH and time on yield ofcerevisiaewere investigated on the basis of single-factor experiments and orthogonal test for fermentation. The optimum fermentation process parameters were fermentation temperature 28 ℃,pH 4.5,agitation speed 170 r/min,fermentation time 54 h. The total antioxidant capacity,DPPH and ABTS free radical scavenging capacity ofDendrobiumofficinalepolysaccharide has been improved by fermentation,and has very strong dose-response relationship. Average molecular weight of polysaccharide by water extraction and fermentation measured by the GPC-MALLS system showed that it was decreased from 4.234×105to 1.077×105after fermentation. The improvement of antioxidant capacity may be related to the decrease of molecular weight.
Dendrobiumofficinale;water extraction;submerged fermentation;polysaccharides;antioxidant activity
2016-11-11
薛燕(1993-),女,硕士研究生在读,研究方向:化妆品植物原料,E-mail:15632374533@163.com。
*通讯作者:董银卯(1963-),男,博士,教授,研究方向:植物源化妆品功效成分研究与应用,E-mail:ymdong2008@163.com。
TS201.3
A
1002-0306(2017)09-0155-05
10.13386/j.issn1002-0306.2017.09.021
