仿生硅化固定化胰蛋白酶用于控制生物粘泥的研究
2017-06-05宋玉品刘玲君范梦姣刘春雨张一凡吴欣蕊
周 冉,宋玉品,刘玲君,范梦姣,刘春雨,张一凡,吴欣蕊
(1.石家庄学院化工学院,河北石家庄 050035; 2.河北三元食品有限公司,河北石家庄 050000;3.河北工业大学化工学院,天津 300130)
仿生硅化固定化胰蛋白酶用于控制生物粘泥的研究
周 冉1,宋玉品1,刘玲君2,范梦姣1,刘春雨1,张一凡1,吴欣蕊3
(1.石家庄学院化工学院,河北石家庄 050035; 2.河北三元食品有限公司,河北石家庄 050000;3.河北工业大学化工学院,天津 300130)
目的:采用仿生硅化法实现对胰蛋白酶的固定,并将固定化酶与聚甲基丙烯酸甲酯(PMMA)相结合用于抗生物粘泥复合膜的制备。方法:研究了正硅酸甲酯(TMOS)与酶的浓度比、介孔氧化硅(MPS)与酶的质量比、有机溶剂等因素的影响。并以MPS固定化酶为对照实验,对复合膜酶的稳定性、催化活性、重复使用性、抗蛋白质吸附性能等进行了分析。结果:通过仿生硅化法制备的仿生氧化硅-酶-聚甲基丙烯酸甲酯复合膜(SiO2-Enzyme-PMMA film),与介孔氧化硅-酶-聚甲基丙烯酸甲酯复合膜(MPS-Enzyme-PMMA film)相比,具有更好的稳定性,在25 ℃和50 ℃储藏30 d后,两种膜酶活性分别为86.3%和81.2%。SiO2-Enzyme-PMMA film在重复使用6次之后,复合膜的酶活剩余89.1%。将复合膜浸泡在牛血清白蛋白(BSA)溶液中18 d后,其表面蛋白质吸附量仅为不含酶PMMA的三分之一。两种复合膜均具有良好的抗蛋白吸附性能。结论:仿生硅化制备固定化酶,与介孔氧化硅载体相比,在提高固定化酶的包埋率和稳定性方面有更显著的优势,其条件温和,操作简便,活性高,应用于抗生物粘泥涂层具有更好的防污效果。
胰蛋白酶,仿生硅化,介孔氧化硅,生物粘泥
生物粘泥是由微生物及其产生的胞外聚合物与其它有机和无机杂质混在一起,粘着在物体表面的粘滞性物质,主要成分为蛋白质及多糖,在循环冷却水系统的管道、冷却塔、船体及水下作业的设备壁上广泛存在。其胞外聚合物的粘性使得它易于附着在设备表面,附着速度可以达到每月数毫米。生物粘泥的附着会导致设备严重腐蚀和结垢、缩短设备使用寿命,严重的还会影响生产装置的正常运行,增加生产成本;船舶底部和水下作业设备表面形成生物粘泥,影响船舶速度,增加油耗,设备腐蚀,还可能导致一些重要水下检测设备失灵,在经济和安全方面造成更严重的危害和损失[1-2]。其产生的危害远比设备腐蚀或结垢严重[3-6]。因此,对生物粘泥控制、剥离清洗十分必要。通过合适高效的处理方法,达到控制生物粘泥生长的目的,延长设备的使用寿命,保障设备正常运行,提高生产效率,是工业化生产的必然要求和迫切需要解决的问题。有效的控制生物粘泥的生成和积累同时也是保证海上运输和水下作业安全进行的基本前提[7]。
目前,控制生物粘泥的方法很多,可分为物理法、化学法和生物酶法[8]。物理法和化学法去除生物粘泥的效果并不理想。而且化学药剂会造成环境水体的污染,且大多数杀菌剂、杀生剂都难以被降解,不符合现在倡导的绿色环保的要求。而将酶直接溶于水系统中以降解生物粘泥,这种方法使酶易失活且不利于重复使用。因此针对生物粘泥的主要成分-蛋白质,将蛋白酶进行固定化并与有机材料相结合制备具有催化活性的生物材料,通过分解蛋白质来达到去除生物粘泥的目的,这种生物材料在防污领域具有广阔的研究前景。
氧化硅是目前常见的无机纳米载体材料,其亲水性和多孔结构在为酶分子提供适宜稳定的微环境,保证酶催化活性的同时也有利于底物的扩散,增加其与酶活性位点的接触,提高酶促反应效率。
生物矿化是生物体选择性地从周围环境中吸取元素,在体内形成无机物的过程。在该过程中细胞分泌的有机物指导形成具有一定尺寸、形状、结构和取向的无机物。仿生矿化主要研究生物体中矿物质的形成,在对该过程了解的基础上模仿合成具有相似结构和功能的材料。通过特定的有机模板的调控指导无机物在有机-无机界面处成核并缓慢增长,最终得到具有一定结构和形状的复合材料。由于仿生硅化模拟了生物硅化过程,所以其可以在室温、中性和常压条件下进行,并且过程容易调控,操作简便、反应条件温和、酶活保持率高,以仿生硅化制备的固定化酶,在提高固定化酶的包埋率和稳定性方面也有显著的优势[9-17]。但未见仿生硅化固定化蛋白酶用于抗生物粘泥涂层制备的报道。
因此,本研究以仿生硅化法固定化胰蛋白酶,并用于构建抗生物粘泥涂层,并与传统介孔氧化硅载体材料(MPS)物理吸附固定酶作对比,形成抗生物粘泥复合膜,对复合膜的稳定性、催化活性、重复使用性、抗蛋白质吸附性能等进行了研究。
1 材料与方法
1.1 材料与仪器
正硅酸甲酯(TMOS) 天津市化学试剂研究所;聚二甲基二烯丙基铵[PDADMA(20 wt% in H2O)] Sigma公司;聚甲基丙烯酸甲酯(PMMA) 日本住友化学HT50Z;胰蛋白酶、牛血清白蛋白(BSA) 上海鼎国生物技术有限公司;乙醇、异丙醇、丙酮、盐酸、甲苯、磷酸二氢钠、磷酸氢二钠、氢氧化钠、三氯乙酸(TCA)、干酪素、考马斯亮蓝G250 天津市风船化学试剂科技有限公司。
XW-80A微型旋涡混合仪 上海沪西分析仪器有限公司;冷冻高速离心机 SIGMA公司;UV1100紫外可见分光光度计 上海美谱达仪器有限公司;Brukervector22傅里叶红外光谱仪 德国Bruker公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;电子天平、pH计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 固定化酶的制备
1.2.1.1 SiO2-Enzyme的制备 用pH7.0的磷酸盐(PBS)缓冲液配制一定浓度的酶液,向其中依次加入400 μL TMOS前驱体溶液和1 mL 5 mg/mL的PDADMA溶液,摇匀。25 ℃,200 r/min摇床震荡15 min,取下后静置5 min,5000 r/min下离心5 min,弃上清。加入pH7.0的PBS缓冲液洗去未被固定的游离酶。再离心,重复上述步骤三次。向得到的固定化酶中加入2 mL丙酮溶剂,混合振荡1 min后离心弃上清,重复三次,使有机相完全置换出固定化酶中的水相后,将固定化酶置于通风处2 h左右,待有机溶剂完全挥发后,即得到干燥的固定化酶[18]。
1.2.1.2 MPS-Enzyme的制备 称取5 mg胰蛋白酶粉末,用pH7.0的PBS缓冲液溶解完全,加入5 mg MPS粉末,25 ℃,200 r/min下摇床震荡15 min,8000 r/min离心5 min,弃上清。洗涤方法同SiO2-Enzyme的制备。
1.2.1.3 TMOS与酶的浓度比的影响 保持酶浓度为0.41 mol/L不变,依次按比例加入不同浓度的TMOS,在相同的条件下进行吸附固定,检测酶活性。
1.2.1.4 MPS与酶的质量比的影响 MPS的加入量为2 mg不变,依次按比例加入不同质量胰蛋白酶,在相同的条件下进行吸附固定,检测酶活性,优化酶的固定化条件。
1.2.1.5 有机溶剂种类的影响 用易溶于水的有机溶剂做洗涤剂洗固定化酶,易挥发的有机相可以置换出固定化酶中的水相,然后在自然条件下,待有机溶剂挥发完全,即可得到干燥的固定化酶粉。此法较其他干燥方法而言,具有简便,低成本的特点。甲苯虽然不能与水互溶,但其作为制膜的主要溶剂,本实验也研究了其对酶活性的影响情况。分别取2 mL甲醇、乙醇、丙酮、异丙醇和甲苯加入到用PBS缓冲液洗好的固定化酶中,振荡1 min,使有机相和水相充分混合,5000 r/min下离心5 min,弃上清,重复上述步骤三次以完全除去固定化酶中的水相,将酶置于通风处2 h,有机溶剂挥发后即可得到干燥的固定化酶粉。检测对比其活性。
1.2.2 酶活测定方法 在25 ℃下,向固定化酶中加入2 mL 1%的酪蛋白溶液,反应5 min,加入2 mL 20%的TCA溶液终止反应。8000 r/min离心5 min,过滤上清液,在275 nm紫外光下测上清液的吸光度值。以标准酪氨酸溶液的光吸收作对照,根据活力单位的定义,确定样品中胰蛋白酶的活性。酶活力单位的定义:25 ℃,pH7.0条件下,单位时间内生成1 μg酪氨酸所需要的酶量为1 U。
1.2.3 抗生物粘泥复合膜的制备 称取10 mg胰蛋白酶粉两份,按上述方法分别制备两种固定化酶,风干后得到干燥的酶粉,研磨均匀。取1 g PMMA颗粒,加入到3 g甲苯中,在80 ℃ 恒温磁力搅拌水浴锅中溶解完全,稍冷却至室温后加入制备好的SiO2-Enzyme(或MPS-Enzyme),混合均匀,平铺在玻璃板上,晾干即可。Enzyme-PMMA-film的制备方法同上,即向溶解好的PMMA中加入10 mg胰蛋白酶粉末,混合均匀后平铺晾干。
1.2.4 抗生物粘泥复合膜的酶活性检测 将复合膜置于20 mL 1%的酪蛋白溶液中,35 ℃下反应30 min,取出膜片向反应液中加入5 mL TCA终止反应,离心过滤上清液,在275 nm波长下测吸光度值。
1.2.5 抗生物粘泥复合膜的热稳定性研究 分别将刚制备好的SiO2-Enzyme-PMMA film、MPS-Enzyme-PMMA film和Enzyme-PMMA film置于25 ℃和50 ℃的干燥恒温环境中储藏,每隔3 d取出一次,放入已在35 ℃水浴中预热5 min的20 mL酪蛋白溶液中,反应30 min后取出膜片,用蒸馏水淋洗干净晾干,再放回原恒温环境中储藏。向反应液中加入5 mL TCA终止反应,8000 r/min离心取上清液,在275 nm处测其吸光度值。以第1 d所测复合膜的活性为初始活性,观察加入不同固定化酶和游离酶的复合膜的活性变化情况。
1.2.6 抗生物粘泥复合膜的重复使用性研究 将制备好的SiO2-Enzyme-PMMA film、MPS-Enzyme-PMMA film和Enzyme-PMMA film分别置于35 ℃的恒温水浴中与20 mL的酪蛋白溶液反应30 min。取出复合膜后向反应液中加入5 mL的TCA终止反应。将反应液在8000 r/min下离心5 min,留上清液待测。反应后的复合膜轻轻用蒸馏水淋洗,去掉表面残留反应液,晾干后再次置于新鲜的酪蛋白溶液中反应30 min,重复之前步骤,连续操作六次,将得到的六组待测液在275 nm的紫外光下测吸光度值。
1.2.7 抗蛋白质吸附实验 配制10 mg/mL的BSA溶液,将面积为2.5×4 cm2的抗生物粘泥复合膜完全浸没其中,4 ℃下冷藏保存。用Bradford法分别测复合膜表面的蛋白质吸附量,即将复合膜在蒸馏水中轻蘸3次后,用PBS缓冲液反复淋洗复合膜,以洗下膜表面吸附的蛋白质。取1 mL待测液加入到5 mL考马斯亮蓝溶液中,反应5 min,在595 nm波长下测吸光度值。
1.2.8 红外表征 采用傅立叶变换红外光谱仪(FTIR)分别测定SiO2-Enzyme、MPS-Enzyme和游离酶的红外光谱,扫描范围500~4000 cm-1。将冻干后的待测物与KBr混合,充分研磨均匀后压制成薄片,采用透射法进行测定。
2 结果与讨论
2.1 TMOS与酶的浓度比
当酶液浓度和TMOS浓度比值从0.4∶1变化到1∶1过程中,随着TMOS浓度的增加,二氧化硅沉淀的生成量和酶的固定量显著增多,酶活性也逐渐增大。当酶液浓度和TMOS浓度比值达到1∶1时,酶活性也达到最高值。之后继续增加酶液浓度和TMOS浓度比值至1.4∶1,酶活性不再增加且有一定程度的下降。如图1所示。
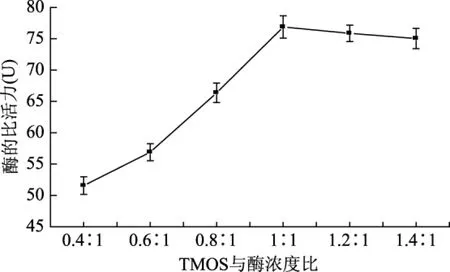
图1 正硅酸甲酯与酶浓度比的影响Fig.1 Effect of the concentration ratio of TMOS and enzyme
固定酶活性达到最高值之后,继续增加TMOS浓度,过量的二氧化硅沉淀会阻碍酶和底物之间的传质速率,也有可能增厚酶分子的包裹层,阻碍酶和底物的接触,从而导致酶活性的降低。所以实验选择TMOS浓度和酶浓度比值为1∶1,浓度为0.41 mol/L。
2.2 MPS与酶的质量比
MPS与酶的质量比对固定化酶活性的影响如图2所示。结果表明,当MPS与酶的质量比从0.25∶1变化到1∶1过程中,随着酶浓度的增加,MPS对酶的负载量也呈现上升趋势。在MPS与酶的质量比达到1∶1时,固定酶活性最高,继续增大酶浓度至2.5∶1,固定化酶活性不再有明显的变化,说明此时MPS达到吸附饱和。所以实验选择载体与酶质量比为1∶1。
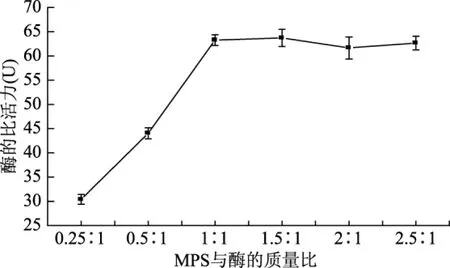
图2 MPS与酶质量比的影响Fig.2 Effect of the mass ratio of MPS and enzyme
2.3 有机溶剂对固定化酶活性的影响
有机溶剂对固定化酶活性的影响如表1所示。结果表明,异丙醇、甲醇、甲苯、乙醇都在不同程度上降低了固定酶的活性,只有丙酮有助于酶活性的提高。这是因为丙酮在夺取酶分子中水分的同时,可以通过改变酶分子的空间构象,使其处于活化状态,为酶催化提供更多的活性位点,从而很大程度提高固定化酶的活性。

表1 不同有机溶剂对固定化酶活性的影响
2.4 固定化酶的红外表征
本实验采用傅里叶红外光谱仪分别测定SiO2-Enzyme、MPS-Enzyme和载体的红外光谱。图3(a)为仿生硅化法制备固定化酶和不含酶的二氧化硅载体的红外光谱图,可以看出二氧化硅载体在970 cm-1和1100 cm-1处表现出Si-O-H伸缩振动吸收峰和Si-O-Si反对称伸缩振动吸收峰。对于SiO2-Enzyme,除了具有上述两处特征峰之外,在1587 cm-1处有胺基弯曲振动吸收峰,说明胰蛋白酶已经被包埋在二氧化硅内。图3(b)为MPS和MPS-Enzyme的红外光谱图,对于MPS,960 cm-1和1100 cm-1为Si-O-H伸缩振动吸收峰和Si-O-Si反对称伸缩振动吸收峰,而对于MPS-Enzyme,1590 cm-1处表现出胺基弯曲振动吸收峰,同样说明胰蛋白酶已经固定在MPS载体上。
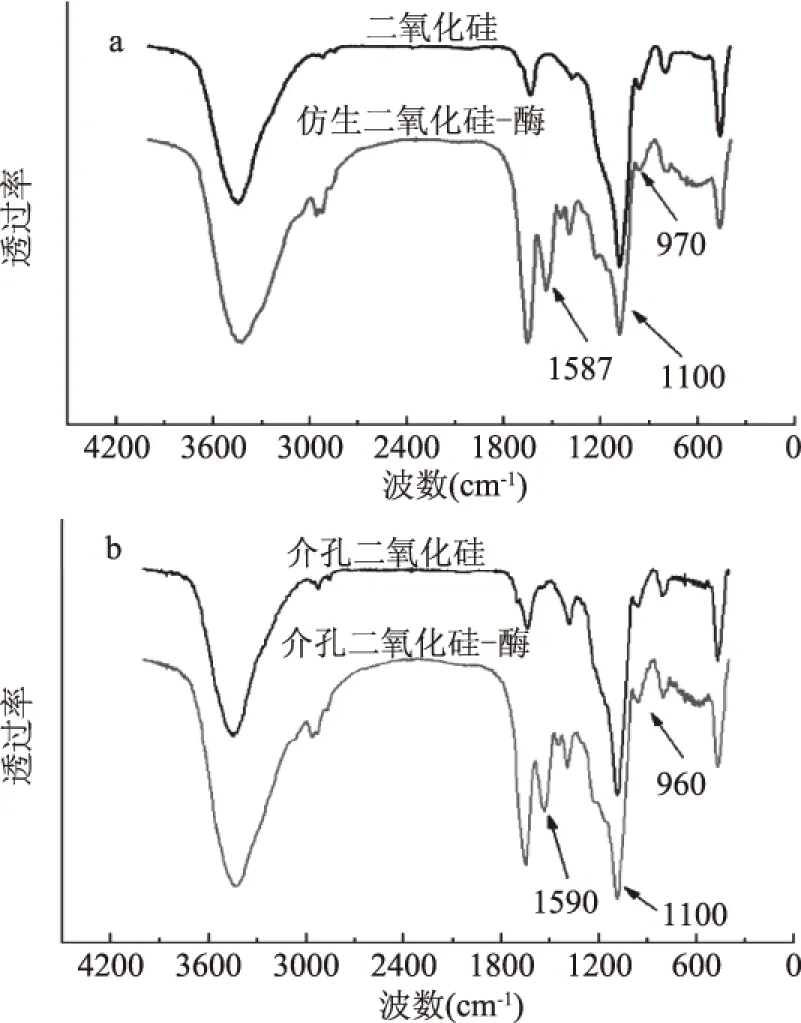
图3 仿生二氧化硅-酶(a)和介孔二氧化硅-酶(b)的红外光谱图Fig.3 FT-IR spectra of SiO2-Enzyme(a) and MPS-Enzyme(b)
2.5 抗生物粘泥复合膜的储藏稳定性
本实验对复合膜的储藏稳定性进行了考察。以加入游离酶的PMMA复合膜作对照实验,将MPS-Enzyme-PMMA film、SiO2-Enzyme-PMMA film和Enzyme-PMMA film分别放入25 ℃和50 ℃的干燥恒温环境中储藏,每3 d取出一次,测复合膜的酶活性。如图4所示。

图4 复合膜的储藏稳定性Fig.4 The storage stability of films注:a为SiO2-Enzyme-PMMA膜,b为MPS-Enzyme-PMMA膜。
实验表明,对胰蛋白酶固定化后制备成抗生物粘泥复合膜,可以有效的提高复合膜的催化稳定性。例如,加入游离酶的复合膜在第9 d时,基本已经丧失全部活性。SiO2-Enzyme-PMMA film表现出较优秀的储藏稳定性,其在25 ℃和50 ℃下储藏30 d后的相对酶活分别为86.3%和81.2%。而MPS-Enzyme-PMMA film在25 ℃下储藏30 d后,复合膜活性为初始酶活性的83%左右,50 ℃下储藏的为76%。相比较而言,SiO2-Enzyme-PMMA film稳定性更好,这是因为仿生硅化法包埋酶可以在酶分子表面形成一层二氧化硅“隔热层”,再加上包埋产生的笼效应,均能降低了温度对酶活性的影响[19]。
2.6 抗生物粘泥复合膜的重复使用性
将MPS-Enzyme-PMMA film、SiO2-Enzyme-PMMA film和Enzyme-PMMA film分别连续六次放入新鲜的酪蛋白底物中,测其酶活。实验结果表明(如图5),经过六次的重复使用后,SiO2-Enzyme-PMMA film的酶活为初始活性的89.1%,而MPS-Enzyme-PMMA film的剩余酶活为86.7%。加入游离酶粉的复合膜酶活损失严重,在第6次对其进行实验时,酶活仅剩30%左右。
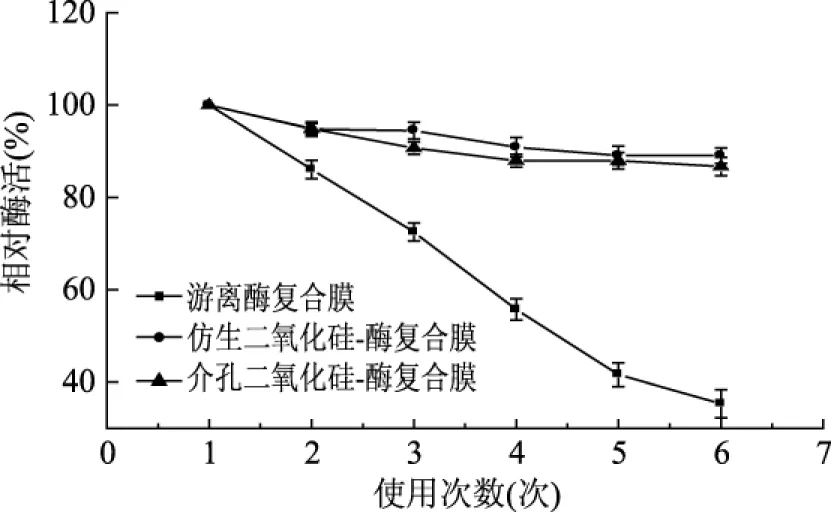
图5 复合膜的重复使用性Fig.5 The number of reuses of the films
可见,仿生硅化包埋固定化酶制备的复合膜稳定性略优于MPS吸附法制备固定化酶,是由于MPS将酶吸附固定在介孔中,可以在一定程度上对酶分子结构和催化活性起到保护作用,但是吸附法固定酶不够稳定。而仿生硅化法将酶分子包埋在氧化硅内部,酶分子所处的微环境具有明显的笼效应,更有利于保持分子构象使其不易被外界环境改变[20-21]。
2.7 抗生物粘泥复合膜的抗蛋白质吸附性能
对复合膜的抗蛋白质吸附性能进行研究。由于牛血清白蛋白BSA具有较强的附着性,极易黏着在材料表面,实验考察了MPS-Enzyme-PMMA film、SiO2-Enzyme-PMMA film和不含酶的PMMA膜在抗BSA吸附方面的性能。将若干面积相等的复合膜分别浸泡在高浓度的BSA溶液中每3 d取出一片,测其表面的蛋白质吸附量。以三种复合膜单位面积上蛋白质的吸附量为纵坐标,时间为横坐标作图,得到图6。
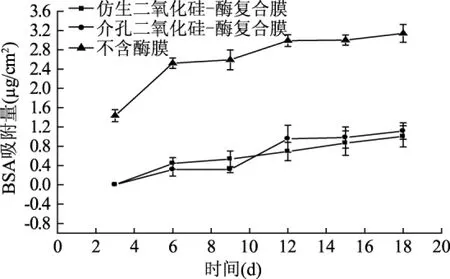
图6 复合膜表面牛血清白蛋白吸附量Fig.6 Adsorption capacity of bovine serum albumin on the surface of composite films
由图6可知,不含酶的PMMA膜在第18 d时,表面蛋白质吸附量为3.14 μg/cm2,而同等条件下MPS-Enzyme-PMMA film和SiO2-Enzyme-PMMA film的蛋白吸附量仅为1.11 μg/cm2和1.00 μg/cm2,是不含酶PMMA膜的三分之一。可见固定化酶的加入,有效的降低了膜表面蛋白质的附着。而且,SiO2-Enzyme-PMMA film的性能要优于MPS-Enzyme-PMMA film。
3 结论
仿生硅化法制备固定化酶,并制备SiO2-Enzyme-PMMA film,复合膜有良好的稳定性。在25 ℃和50 ℃储藏30 d后其酶活性分别为86.3%和81.2%。在重复使用6次之后,复合膜的酶活剩余89.1%,酶活泄漏不明显。MPS-Enzyme-PMMA film在25 ℃和50 ℃储藏30 d后其酶活性分别为82.8%和75.9%,重复使用6次后酶活剩余86.7%。与SiO2-Enzyme-PMMA相比,稳定性欠佳。将复合膜浸泡在BSA溶液中18 d后其表面蛋白质吸附量仅为不含酶PMMA的三分之一。仿生硅化制备固定化酶,与介孔氧化硅载体相比,在提高固定化酶的包埋率和稳定性方面有更显著的优势,其条件温和,操作简便,活性高,应用于抗生物粘泥涂层具有更好的防污效果。
[1]Zhou W,Li H W. Industrial circulating cooling water system anti-corrosion study[J]. Science & Technology for Development,2012:184-189.
[2]Dafforn K A,Lewis J A,Johnston E L. Antifouling strategies:history and regulation,ecological impacts and mitigation[J]. Marine Pollution Bulletin,2011,62(3):453-465.
[3]夏璐,刘芳,薛松,等. 复合型杀菌剂对生物粘泥处理效果的研究[J]. 环境工程学报,2011,5(10):2215-2220.
[4]Schultz M P,Bendick J A,Holm E R,et al. Economic impact of biofouling on a naval surface ship[J]. Biofouling,2011,27(1):87-98.
[5]Carl C,Poole A J,Vucko M J,et al. Enhancing the efficacy of fouling-release coatings against fouling byMytilus galloprovincialisusing nanofillers[J]. Biofouling,2012,28(10):1077-1091.
[6]Donald L S,Robert F,Brady J,et al. Contact angle hysteresis,adhesion,and marine biofouling[J]. Langmuir,2004,20(7):28-30.
[7]Banerjee I,Pangule R C,Kane R S. Antifouling coatings:recent developments in the design of surfaces that trevent fouling by proteins,bacteria,and marine organisms[J]. Advanced Materials,2011,23(6):690-718.
[8]Schultz M P,Bendick J A,et al. Economic impact of biofouling on a naval surface ship[J]. Biofouling,2011,27(1):87-98.
[9]Cloete T E,Brozel V S,Holy A V. Practical aspects of biofouling control in industrial water systems[J]. International Biodeterioration and Biodegradation,1992,29(3):299-341.
[10]Brutchey R L,Morse D E. Silicatein and the translation of its molecular mechanism of biosilicication into low temperature nanomaterial synthesis[J]. Chemical Reviews,2008,108(11):4915-4923.
[11]Shchipunov Y A,Karpenko T Y,Bakunin I Y,et al. A new precuosor for the immobilization of enzymes inside sol-gel-derived hybrid silica nanocomposites containing polysaccharides[J]. Journal of Biophysical Methods,2004,58(1):25-38.
[12]Begu S,Girod S,Lerner D A,et al. Characterization of a phospholipid bilayer entrapped into non-porous silica nanospheres[J]. J Mater Chem,2004,14(8):1316-1320.
[13]Steinberg Y,Schroeder A,Talmon Y,et al. Triggered release of aqueous content from liposome-derived sol-gel nanocapsules[J]. Langmuir,2007,23(24):12024-12031.
[14]Galarneau A,Sartori F,Cangiotti M,et al. Sponge mesoporous silica formation using disordered phospholipid bilayers as template[J]. J Phys Chem B,2010,114(6):2140-2152.
[15]Phuoc L T,Laveille P,Chamouleau F,et al. Phospholipid-templated silica nanocapsules as efficient polyenzymatic biocatalysts[J]. Dalton Trans,2010,39(36):8511-8520.
[16]Robert A. Scism,Bachmann B. Five-component cascade synthesis of nucleotide analogues in an engineered self-immobilized enzyme aggregate[J]. Chem Bio Chem,2010,11:67-70.
[17]Patwardhan S V. Biomimetic and bioinspired silica:Recent developments and applications[J]. Chem Commun,2011,47:567-7582.
[18]Lai J K,Chuang T H,Jan J S,et al. Efficient and stable enzyme immobilization in a block copolypeptide vesicle-templated biomimetic silica support[J]. Colloids and Surfaces B:Biointerfaces,2010,80(1):51-58.
[19]Luan P P,Jiang Y J,Zhang S P,et al. Chitosan-mediated formation of biomimetic silica nanoparticles:an effective method for manganese peroxidase immobilization and stabilization[J]. Journal of Bioscience and Bioengineering,2014,118(5):575-582.
[20]Wang H W,Yanjun Jiang Y J,Liya Zhou L Y,et al. Bienzyme system immobilized in biomimetic silica for application in antifouling coatings[J]. Chinese Journal of Chemical Engineering,2015,23(8):1384-1388.
[21]Rai A,Prabhune A,Perry C C. Entrapment of commercially important invertase in silica particles at physiological pH and the effect of pH and temperature on enzyme activity[J].Materials Science and Engineering:C,2012,32(4):785-789.
Study on the immobilization of trypsin in biomimetic silica particles for controlling biological slim
ZHOU RAN1,SONG Yu-pin1,LIU Ling-jun2,FAN Meng-jiao1,LIU Chun-yu1,ZHANG Yi-fan1,WU Xin-rui3
(1.School of Chemical Engineering,Shijiazhuang University,Shijiazhuang 050035,China; 2.Hebei San Yuan Food Co.,Ltd.,Shijiazhuang 050000,China; 3.School of Chemical Engineering,Hebei University of Technology,Tianjin 300130,China)
Objective:Trypsin was immobilized on the SiO2by biomimetic silicification process. The catalytic films were prepared by suspending the immobilized trypsin directly into a poly(methyl methacrylate)solution in toluene. Methods:The concentration ratio of TMOS and enzyme,mass ratio of MPS and enzyme and the type of organic solvents were studied. Compared with mesoporous silica(MPS)immobilized enzyme,the storage stability of the composite films,catalytic activity,reusability,and resistant to protein adsorption properties was studied. Results:The results indicated that the SiO2-Enzyme-PMMA film showed the better stability. After 30 days,the residual activity of SiO2-Enzyme-PMMA film and MPS-Enzyme-PMMA film were 86.3% and 81.2% of the initial activity,respectively. The SiO2-Enzyme-PMMA film also showed good operational stabilities in six times of continuous operations. The enzyme residual activity was 89.1%. The surface protein adsorption capacity of SiO2-Enzyme-PMMA film immersed in BSA solution for 18 days was only 1/3 of the PMMA film without enzyme. The two films both had good adsorption properties resistant to protein. Conclusion:Compared with the mesoporous silica carrier,SiO2prepared by biomimetic silicification process had higher stability and embedding rate. The method had the advantages of mild condition,simple operation and high activity,and can be used in the anti fouling coating.
trypsin;biomimetic silicification;MPS;biological slim
2016-10-21
周冉(1981-),女,博士,讲师,主要从事化工材料制备研究工作,E-mail:helly30072004@163.com。
TS201.3
A
1002-0306(2017)09-0150-06
10.13386/j.issn1002-0306.2017.09.020
