食源性致泻大肠杆菌血清型及毒力基因的研究
2017-06-05余晓丰梅玲玲陈国刚
余晓丰,杨 勇,占 利,梅玲玲,陈国刚,*
(1.石河子大学食品学院,新疆石河子 832000; 2.浙江省疾病预防与控制中心微生物所,浙江杭州 310051)
食源性致泻大肠杆菌血清型及毒力基因的研究
余晓丰1,杨 勇2,占 利2,梅玲玲2,陈国刚1,*
(1.石河子大学食品学院,新疆石河子 832000; 2.浙江省疾病预防与控制中心微生物所,浙江杭州 310051)
了解浙江地区食源性致泻大肠杆菌的血清型分布特点及毒力基因携带状况。收集食品安全风险监测点的致泻大肠杆菌分离株,采用玻片凝集法对受试菌株进行血清分型,运用多重PCR检测其携带的毒力基因。在69株受试菌株中,优势血清型包括O148(16株)、O159(11株)、O6(4株)、O15(4株)、O63(4株)和O78(3株),这六种血清型菌株共计42株,占菌株总数的60.9%。菌株主要携带的毒力基因为astA(42株)、estIb(25株)、pic(15株)、escV(14株)、aggR(14株);最常见的毒力基因组合为astA+estIb(25株)。进一步分析发现,携带astA、estIb基因的O148和O159的菌株对食品安全存在较大威胁。浙江地区食源性致泻大肠菌的类型以EAEC和ETEC为主,携带的主要毒力基因为astA和estIb,优势血清型为O148和O159。
食源性致泻大肠杆菌,多重PCR,血清型,毒力基因
大肠埃希氏菌(Escherichiacoli)通常被称为大肠杆菌,是存在于食物、温血动物肠道和环境中的常见细菌[1]。大肠菌群数能够反映食品是否被污染以及被污染的程度,是评价食品卫生质量的重要指标[2]。尽管普通大肠杆菌属于正常肠道菌群的组成部分,但是获得特殊毒力因子的大肠杆菌可引起食物中毒,临床表现为腹泻和败血症,引起腹泻的这类菌株称之为致泻大肠杆菌[3-4]。根据携带毒力基因的不同,致泻大肠杆菌分为:肠粘附性大肠杆菌(EAEC)肠出血性大肠杆菌(EHEC)、肠侵袭性大肠杆菌(EIEC)、肠致病性大肠杆菌(EPEC)和肠产毒性大肠杆菌(ETEC)[5]。
近年来,食源性致泻大肠杆菌引起的食物中毒事件屡见不鲜,尤其是在发展中国家[6]。其中,饮用水、面制品和肉制品,是致泻大肠杆菌引起人类食物中毒的主要媒介[7]。一直以来,对这类高危食品中致泻大肠杆菌进行监测是预防食物中毒事件发生的有效手段[8]。之前关于食品中致泻大肠杆菌的研究,关注点是食品的卫生状况,很少有对分离株基因型和表现型的研究。本研究收集浙江地区2014年以来的分离株,运用玻片凝集法和多重PCR,首先对菌株进行血清分型,然后并对其种属基因(uidA)和毒力基因(pic、bfpB、invE、elt、escV、aggR、stx2、stx1、estIb、astA)进行检测,最后对其血清型分布特点及毒力基因携带状况进行统计和分析,为食物中毒事件的防控提供数据支撑。
1 材料和方法
1.1 材料和仪器
致泻大肠杆菌 均由浙江省疾病预防与控制中心从食品安全风险监测点收集的样本中分离;营养琼脂培养基 青岛海博生物技术有限公司;组织和血液DNA提取试剂盒 德国Qiagen公司;五种致泻性大肠埃希氏菌多重PCR检测试剂盒 北京卓诚惠生生物科技股份有限公司;100 bp DNA Ladder 日本TaKaRa公司;琼脂糖 上海生工;病原大肠菌免疫血清 日本生研。
PCR扩增仪 德国Eppendorf公司;稳压电泳仪,水平电泳槽,凝胶成像系统 美国Bio-Rad公司。
1.2 实验方法
1.2.1 DNA模板提取 实验菌株接种于普通营养琼脂平板37 ℃培养18 h后,按试剂盒说明书操作步骤提取细菌基因组DNA,并存于-20 ℃冻存备用。
1.2.2 毒力基因的测定多重PCR 采用25 μL的反应体系:2×PCR Buffer 12.5 μL、10×Multiplex Assay 2.5 μL、25×PCR Enzyme 1 μL、Nuclease-free Water 7 μL和DNA模板2 μL。扩增条件:95 ℃预变性4 min;95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸90 s,共30个循环;最后72 ℃延伸5 min[9]。取4 μL扩增产物在含1%琼脂糖凝胶中以6 V/cm恒压电泳40 min。用凝胶成像系统拍摄图片,观察扩增条带。在含有uidA条带的基础上,根据100 bp DNA Mark和阳性对照判断扩增条带大小,进而确定毒力基因种类,结合毒力基因的组合方式最终判定菌株的致泻类型。
1.2.3 血清分型 实验菌株接种于普通营养琼脂平板37 ℃培养18 h,用无菌棉签挑取单菌落均匀磨到含3 mL无菌生理盐水的比色管中,使得菌悬液的终浊度为4;然后置于121 ℃高压2 h,8000 r/min离心10 min后去上清;最后将米粒大小菌体重悬于含500 μL无菌生理盐水的离心管中备用。取20 μL免疫血清于洁净载玻片,将20 μL菌悬液滴在血清上混匀,缓慢摇动载玻片30 s后观察,同时以无菌生理盐水作为对照。在1 min内,若实验组明显凝集现象,对照组无凝集现象,则为实验阳性;若两者均出现明显凝集现象,则该菌株为自凝型(Orough);若两者未现明显凝集现象,则为实验阴性(ONT)。
2 结果与分析
2.1 菌株类型及毒力基因的分布

图1 12种代表性菌株的多重PCR产物凝胶电泳图Fig.1 Agarose gel electrophoresis of 12 isolates that were selected as the representatives of the strains tested注:泳道1~7对应的毒力基因片段分别为astA、aggR、astA+pic、pic+aggR、astA+pic+aggR、escV、elt;泳道8~12对应的毒力基因片段分别为astA+estIb、astA+elt+estIb、escV+stx2、escV+bfpB、astA+escV;泳道13对应参考菌株ATCC25922的种属基因片段uidA;M为100 bp DNA Ladder Mark。
在69株致泻大肠杆菌中,42株astA基因阳性;25株estIb基因阳性;15株pic基因阳性;14株escV基因阳性;14株aggR基因阳性;6株elt基因阳性;1株bfpB基因阳性;1株stx2基因阳性;未检出invE和stx1基因。携带stx1基因的致泻大肠杆菌通常会导致温血动物肠道出血,但是这类菌株在食品样本中阳性率很低。之前李毅等也报道在食品样本未发现携带该毒力基因的菌株,这与本实验结果一致[10]。此外,根据实验结果可以得出:浙江地区食源性致泻大肠菌株主要携带的毒力基因是astA;常见的毒力基因组合为astA+estIb,两者都属于热稳定肠毒素基因。由于热稳定肠毒素分子量小,无免疫原性,这无疑增加了防控的难度。
根据毒力基因的组合方式的不同,实验菌株可分为EAEC 25株(36.2%)、EPEC 11株(15.9%)、ETEC 5株(7.2%)、EHEC 1株(1.4%)、EAEC和ETEC 25株(36.2%)、EAEC和EPEC 2株(2.9%)、未检出EIEC。多重PCR产物电泳后共得到12种不同的条带组合如图1所示;各种毒力基因组合菌株的种类和数量见表1。由实验结果可知,根据各类菌株的数量,可以得出EAEC和ETEC是浙江地区食品中的致泻大肠杆菌的主要类型。尽管EAEC的检出率高于ETEC,但是由于ETEC易引起婴幼儿和旅行者腹泻,更常见于报道。Canizalez等对墨西哥城市锡那罗亚州的5162份食品样本进行调查后发现当地ETEC阳性率为1.7%,而张淑红等对国内24个城市559份食品样本进行研究,结果显示ETEC的阳性率为6.4%[11-12]。遇晓杰等报道黑龙江地区食源性致泻性大肠埃希氏菌中EAEC、ETEC、EPEC的占比分别为38.8%、37.5%、15.0%[13]。这些数据表明,EAEC、ETEC和EPEC是目前威胁我国食品安全的主要致泻大肠杆菌类型。
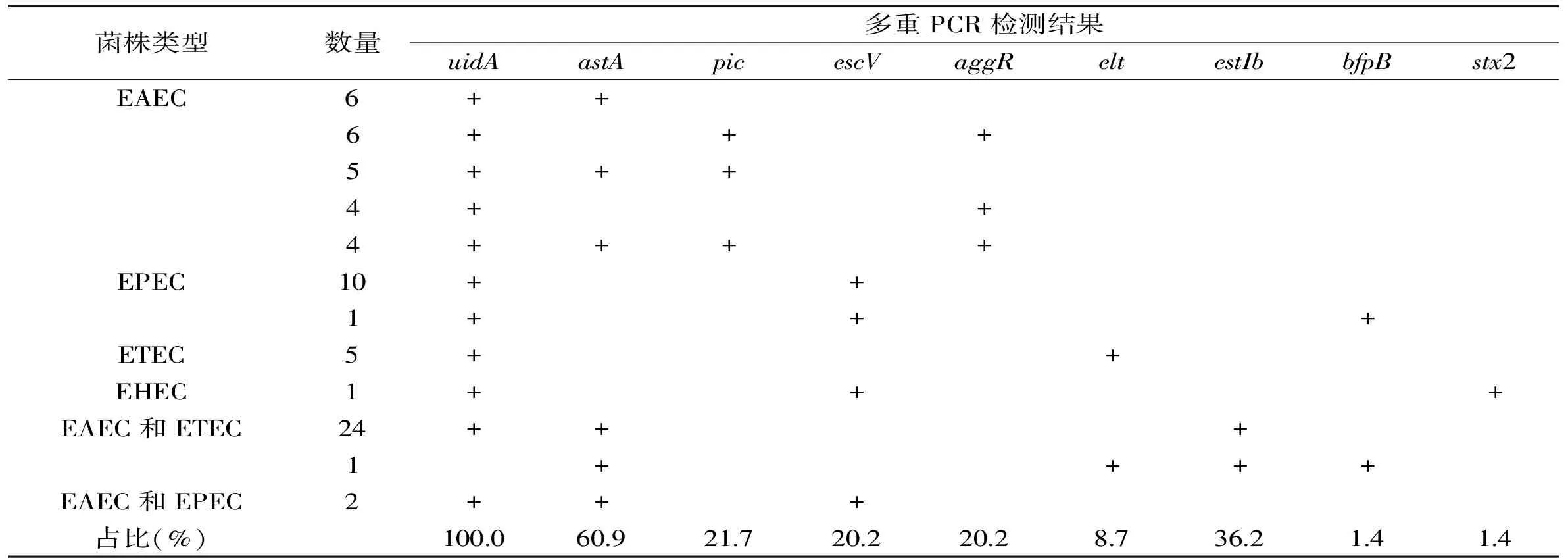
表1 不同类型食源性致泻大肠杆菌的毒力基因分布
注:“+”表示相应的基因检测结果为阳性。
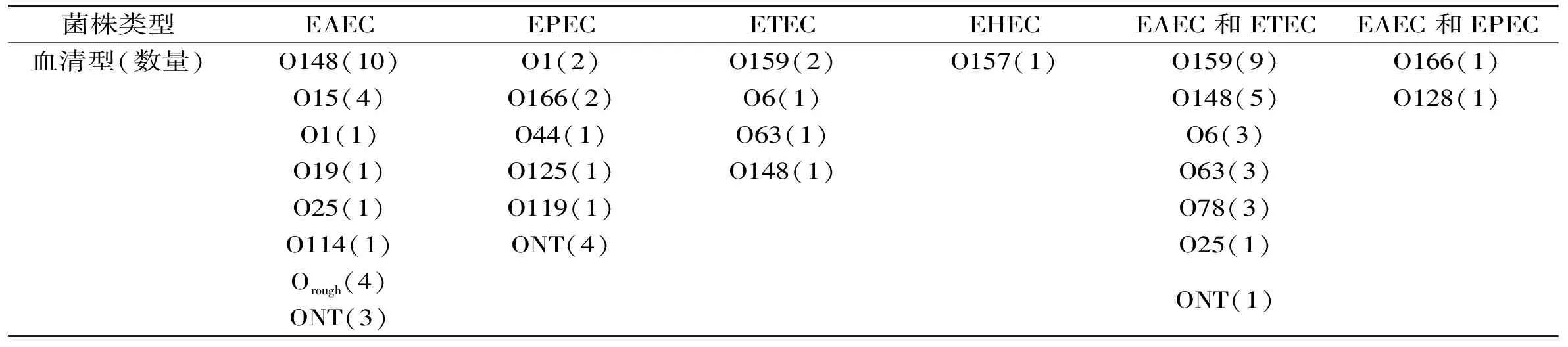
表2 不同类型食源性致泻大肠杆菌的血清型分布
注:“Orough”表示菌株为自凝型;“ONT”表示血清分型时菌株无凝集现象。
2.2 血清型分布
在69株致泻大肠杆菌中,O148有16株、O159有11株、O6有4株、O15有4株、O63有4株、O78有3株、以上6种血清型合计42株,占总数的60.9%。11株O159中,81.8%菌株为EAEC和ETEC杂合株中;16株O148中,62.5%的菌株为EAEC,31.3%的菌株为EAEC和ETEC杂合株;血清型的分布特点详见表2。
实验结果表明,浙江地区食品中致泻大肠杆菌的优势血清型为O148和O159。作为致泻大肠杆菌的保护性抗原,O-抗原能激发宿主产生抗体从而发挥免疫作用,是疫苗的靶点[14]。由此可以推测,浙江地区市面上针对O148和O159菌株的疫苗效果并不明显,需要作进一步评估。临床上关于这两种血清型阳性分离菌株也有报道,并证实这类菌株会导致感染者腹泻[15-16]。在日本,这两种血清型菌株也曾多次引起食物中毒事件的发生,经证实水龙头和井水是病原体污染食品的主要途径[17-18]。众所周知,郊区和偏远农村的生活用水很少经过杀菌处理,很多农副产品经过简单清洗处理后直接销售到城市,一旦被污染,很容易引起集体食物中毒事件,因此,加强这类食品的监测很有必要。此外,在食源性致泻大肠杆菌的监测中,对这两种血清型进行针对性鉴定,可以节约时间成本。
2.3 毒力基因与血清型的关系
结合多重PCR和血清分型的实验结果可知,16株优势血清型O148阳性菌株的毒力基因分布如下:astA(6株)、astA+estIb(5株)、astA+pic(2株)、astA+pic+aggR(1株)、pic+aggR(1株)、elt(1株);11株O159阳性菌株的毒力基因分别为:astA+estIb(9株),elt(2株)。
O-抗原多糖由细菌染色体上的抗原合成基因簇编码合成,该基因簇易获取噬菌体或质粒上抗原修饰基因;在基因的水平转移过程中,菌株可能同时获得某种毒力基因[19]。因此,菌株携带的毒力基因和血清表型之间存在一定的关联。本研究发现某些毒力基因集中出现在几种血清型中;例如,阳性率较高的astA、estIb基因主要出现在O148和O159菌株中。之前也有研究表明大肠杆菌的携带的毒力基因和血清表型之间存在密切的联系[20-21]。尽管如此,并不能根据菌株携带的毒力基因直接推测出该菌株的血清型;例如本研究中,携带estIb基因的两株菌,血清表型可能一致(同为O148或同为O159),也可能不一致(一株为O159,另一株为O148)。由此可知,毒力基因会集中出现在几种血清型中,但是不存在严格对应关系。可能是由于抗原多糖由多个基因协同编码合成,存在其他未知基因的调控[22]。
3 结论
浙江地区食源性致泻大肠菌的类型以EAEC和ETEC为主;携带的主要毒力基因为astA(60.9%)和estIb(36.2%);优势血清型为O148(23.2%)和O159(15.9%);未发现携带invE、stx1基因的菌株。尽管毒力基因astA在血清型O148、O159菌株中检出率高达87.5%、81.8%,但是两者不存在严格对应关系。
[1]姬华,张玫,卢士玲,等.食源性大肠杆菌耐药性与毒力特征的研究进展[J].食品工业科技.2014,35(07):364-367.
[2]武娟,张祺,李丹,等.青岛市售双壳贝类大肠菌群/大肠杆菌检出水平与当地气温的相关性[J].食品工业科技.2014,35(17):147-150.
[3]Hemmatinezhad B,Khamesipour F,Mohammadi M,et al.Microbiological investigation of O-serogroups,virulence factors and antimicrobial resistance properties of shiga toxin-producingEscherichiacoliisolated from Ostrich,Turkey and Quail meats[J]. Journal of Food Safety.2015,35(4):491-500.
[4]Da S S A,Gomes R F,Yukie S L,et al.Escherichiacolifrom Crohn’s disease patient displays virulence features of enteroinvasive(EIEC),enterohemorragic(EHEC),and enteroaggregative(EAEC)pathotypes[J].Gut Pathogens.2015,7(1):2.
[5]Levin R E.Molecular methods for detecting and discriminating Shigella associated with foods and human clinical infections-A review[J].Food Biotechnology.2009,23(3):214-228.
[6]Gould L H,Walsh K A,Vieira A R,et al.Surveillance for foodborne disease outbreaks-United States,1998-2008[J]. Morbidity and Mortality Weekly Report.Surveillance Summaries. 2013,62(2):1-34.
[7]Macdonald E,Moller K E,Wester A L,et al.An outbreak of enterotoxigenic Escherichia coli(ETEC)infection in Norway,2012:a reminder to consider uncommon pathogens in outbreaks involving imported products[J].Epidemiology and Infection.2015,143(3):486-493.
[8]郭玉梅,秦丽云,徐保红,等.2003至2012年石家庄地区细菌性食物中毒病原菌特征研究[J].微生物学杂志.2013,33(5):73-77.
[9]Muller D,Greune L,Heusipp G,et al.Identification of unconventional intestinal pathogenicEscherichiacoliisolates expressing intermediate virulence factor profiles by using a novel single-step multiplex PCR[J].Applied and Environmental Microbiology.2007,73(10):3380-3390.
[10]李毅,章乐怡,洪程基,等.温州市食品中肠出血性大肠杆菌O157∶H7污染状况调查[J].中国食品卫生杂志.2012,24(4):369-371.
[11]Canizalez-Roman A,Gonzalez-Nunez E,Vidal J E,et al.Prevalence and antibiotic resistance profiles of diarrheagenicEscherichiacolistrains isolated from food items in northwestern Mexico[J].International Journal of Food Microbiology.2013,164(1):36-45.
[12]Zhang S,Wu Q,Zhang J,et al.Prevalence,genetic diversity,and antibiotic resistance of enterotoxigenicEscherichiacoliin retail ready-to-eat foods in China[J].Food Control.2016,68:236-243.
[13]遇晓杰,闫军,薛成玉,等.黑龙江省食品风险监测致泻性大肠埃希氏菌致病性分析[J].中国公共卫生管理.2016,02(32):250-252.
[14]潘超,朱力,王恒樑.病原细菌多糖疫苗和多糖结合疫苗研究进展[J].生物技术通讯.2013,24(05):705-709.
[15]罗淑华,黄鹏飞,李燕,等.产毒性大肠埃希菌血清型与毒力流行特征及耐药分析[J].中国卫生检验杂志.2013,23(09):2176-2179.
[16]Hussain M I,Wani S A,Nagamani K,et al.Isolation and characterization of enteroaggregative,enterotoxigenic,diffusely adherentEscherichiacoliand Salmonella Worthington from human diarrhoeic faecal samples in Kashmir and Secunderabad,India[J]. World Journal of Microbiology and Biotechnology.2010,26(10):1883-1889.
[17]Konishi N,Obata H,Monma C,et al.Bacteriological and epidemiological characteristics of enterotoxigenicEscherichiacoliisolated in Tokyo,Japan,between 1966 and 2009[J].Journal of Clinical Microbiology.2011,49(9):3348-3351.
[18]Konishi N,Obata H,Shimojima Y,et al.Colony-sweep PCR efficacy in food-borne outbreak associated with six types of enterotoxigenicEscherichiacoli[J].The Journal of the Japanese Association for Infectious Diseases.2009,83(5):490-495.
[19]蔡成松,郭晓奎.细菌O抗原基因簇的研究进展[J].微生物学杂志.2008,28(03):64-67.
[20]Rodas C,Mamani R,Blanco J,et al.Enterotoxins,colonization factors,serotypes and antimicrobial resistance of enterotoxigenicEscherichiacoli(ETEC)strains isolated from hospitalized children with diarrhea in Bolivia[J].Brazilian Society of Infectious Diseases.2011,15(2):132-137.
[21]陈祥,赵李祥,高崧,等.猪源大肠杆菌(ETEC、STEC、AEEC)毒力基因及其与O抗原型的关系[J].微生物学报.2008,48(7):857-862.
[22]刘璨颖,张济培,王丙云,等.大肠杆菌O-抗原血清型鉴定研究进展[J].中国人兽共患病学报.2016,32(10):928-933.
Study on serotypes and virulence genes of foodborne diarrheogenicEscherichiacoli
YU Xiao-feng1,YANG Yong2,ZHAN Li2,Mei Ling-ling2,CHEN Guo-gang1,*
(1.College of Food,Shihezi University,Shihezi 832000,China; 2.Department of Microbiology,Zhejiang Provincial Center for Disease Control and Prevention,Hangzhou 310051,China)
The main purpose of the research is to define serotypes and virulence factors of foodborne diarrheogenicEscherichiacoliin Zhejiang Province. The distribution characteristics of serotypes and virulence factors of strains collected from food surveillance were detected by serotyping and multiple polymerase chain reaction(PCR).Of all 69 strains,the most frequent identified serotypes were O148(16),O159(11),O6(4),O15(4),O63(4)and O78(3),the total number of these serotypes was 42,which accounted for 60.9% of the strains. And 42,25,15,14,14 strains were positive forastA,estIb,pic,escV,aggRgene,respectively. Among these,25 strains harbored bothastAandestIbgenes,representing the common type. Furthermore,O148 and O159 strains harboringastAandestIbgenes posed a potential threat to food safety. Results showed that EAEC and ETEC harboringastAandestIbgenes were the dominant bacteria types,mainly belonging to serotype O148 and O159,among foodborne diarrheogenicEscherichiacoliin Zhejiang Province.
foodborne diarrheogenicEscherichiacoli;multiplex polymerase chain reaction;serotypes;virulence genes
2016-11-14
余晓丰(1990-),男,硕士,研究方向:食源性致病微生物,E-mail:yuxiaofeng@foxmail.com。
*通讯作者:陈国刚(1977-),男,博士,教授,研究方向:食品微生物及果蔬贮藏,E-mail:cgg611@163.com。
国家自然基金(31560468);中国博士后科学基金(2015M570525)。
TS201.1
A
1002-0306(2017)09-0124-04
10.13386/j.issn1002-0306.2017.09.015
