丹参内生真菌产生淀粉酶菌株的筛选鉴定及酶学性质分析
2017-06-05李艳玲樊鲁玉侯衍英王玉婷史仁玖常正尧张显忠郝岗平
李艳玲,樊鲁玉,侯衍英,刘 超,王玉婷,史仁玖,常正尧,田 园,张显忠,郝岗平
(1.泰山医学院生命科学学院,山东泰安 271016; 2.内蒙古大学生命科学学院,内蒙古呼和浩特 010021)
丹参内生真菌产生淀粉酶菌株的筛选鉴定及酶学性质分析
李艳玲1,樊鲁玉2,侯衍英1,刘 超1,王玉婷1,史仁玖1,常正尧1,田 园1,张显忠1,郝岗平1
(1.泰山医学院生命科学学院,山东泰安 271016; 2.内蒙古大学生命科学学院,内蒙古呼和浩特 010021)
目的:从丹参内生真菌中筛选耐热性强的酸性生淀粉酶菌株,并对其酶学性质进行初步研究。方法:以50株丹参内生真菌作为筛选对象,通过淀粉固体培养基初筛、液体发酵复筛,筛选产生淀粉酶活力较高的菌株;通过形态学观察和ITS序列分析对产酶菌株进行鉴定。结果:从50株丹参内生真菌中,筛选出5株产生淀粉酶活力较高的菌株,其中菌株ZDH2-2-1-1为产淀粉酶活性最强的菌株,酶活力达到117.63 U/mL,经鉴定为互隔链格孢(Alternariaalternata)。该淀粉酶最适pH为4.0,最适反应温度为55 ℃,具有较好的热稳定性和pH稳定性,对生淀粉具有广谱的降解能力。通过薄层层析发现,ZDH2-2-1-1所产淀粉酶的酶解产物为葡萄糖。结论:丹参内生真菌能产生高活性的耐热性酸性生淀粉酶,在生淀粉深加工中具有极大的开发潜力。
丹参,内生真菌,生淀粉酶,降解能力
生淀粉酶(Raw starch-degrading enzyme,RSDE)是指对不经过蒸煮糊化的生淀粉颗粒能够表现出强水解活性的一类酶,包括α-淀粉酶、β-淀粉酶、葡萄糖淀粉酶、脱枝酶等[1]。生淀粉酶可以将传统淀粉制糖工艺的淀粉糊化、液化、糖化合并为一步直接进行糖化,它比传统高温蒸煮糖化节约25%~30%的能量[2-3]。近年来,随着淀粉质原料深加工工业的发展,工艺条件的改变,生淀粉酶这种节能和工艺简化的特点在医药、酿造、食品、造纸、纺织等领域应用中具有潜在的应用价值。目前已报道的真菌生淀粉酶适用温度范围为30~50 ℃,但为了与淀粉糖化条件相适应,需将温度至少升至60 ℃[4]。此外,淀粉水解过程中的pH通常在5.0左右,而淀粉加水形成的乳浊液的pH一般为5.5~6.5范围,采用酸性α-淀粉酶可减少普通α-淀粉酶使用时先将物料pH上调至6.0再下调至4.5所需的酸碱量,既节约了成本,也减少了产品提纯时去盐的压力[3-4]。因此,寻找具有一定耐热性能的酸性生淀粉酶,可提高我国淀粉原料的利用率,对淀粉资源的加工产业具有重要的意义。
目前报道的能产生淀粉酶的真菌主要是从土壤中分离筛选的黑曲霉[5-6]、根霉[2]和青霉[3,7],有关植物内生真菌报道较少。植物内生真菌(Plant endophytic fungi)是生长在健康植物内部,与宿主植物互惠共生的一类真菌,能产生丰富的纤维素酶、果胶酶、淀粉酶、木聚糖酶和蛋白酶等胞外酶[8]。因此,本研究从前期分离的丹参内生真菌[9]中筛选耐热性强的酸性生淀粉酶高产菌株,并对其酶学性质进行初步研究。
1 材料与方法
1.1 材料与仪器
50株丹参内生真菌菌株 由泰山医学院中药生物技术省级重点实验室保存并提供。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1000 mL,自然pH;初筛培养基:可溶性淀粉30.0 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,NaNO32.0 g,K2HPO4·3H2O 1.0 g,蒸馏水1000 mL,自然pH;复筛培养基:可溶性淀粉10 g,酵母提取物0.4 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,NaNO32.0 g,FeSO4·7H2O 0.01 g,KH2PO4·3H2O 0.5 g,蒸馏水1000 mL,pH5.0。马铃薯、葡萄糖、酵母提取物、可溶性淀粉、琼脂等试剂均为国产分析纯。
YX280A手提式数字高压灭菌锅 上海三申医疗器械有限公司;UV-3600紫外分光光度计、FA2004N电子天平 日本津岛公司;A236414电热鼓风干燥箱 上海艾测电子科技有限公司;QYC-211摇床 上海三申医疗器械有限公司;SW-CJ-2F型超净工作台术 江苏奥华仪器厂;GNP-9050型隔水式恒温培养箱 湖南凯达科学仪器厂。
1.2 实验方法
1.2.1 丹参内生真菌的菌种活化 将实验室放在冰箱保存的50株丹参内生真菌接种到PDA固体平板上活化,28 ℃恒温培养5~7 d,备用。
1.2.2 丹参内生真菌产酸性α-淀粉酶菌株的初筛 将活化的50株丹参内生真菌接种到固体初筛培养基中,28 ℃恒温培养5~7 d,观察是否长出透明圈。
1.2.3 产酸性α-淀粉酶菌株的复筛及粗酶液制备 用直径为0.5 cm打孔器打取均匀大小的菌块接种于100 mL液体复筛培养基中,28 ℃ 150 r/min摇床培养7 d。每株内生真菌做3个重复。
将各菌株发酵液分装到50 mL离心管中,5000 r/min离心10 min。将上清液收集在无菌离心管中,即为粗酶液。4 ℃保存备用。将离心后获得的菌丝用滤纸吸干水分,包在已称重的滤纸中放入烘箱,60 ℃烘干直至重量前后变化不大于0.004 g。采用干重法测定各菌株的重量。
1.2.4 酸性α-淀粉酶活力的测定 取10 mL的底物溶液放入一个试管,50 ℃水浴保温10 min后加入粗酶液1 mL,混匀,精确保温10 min,吸取0.5 mL混合液,加入盛有10 mL、0.1 mol/L的HCl的试管中,然后再取该混合液0.5 mL,加入盛有10 mL的碘液试管中摇匀,用紫外分光光度计于660 nm测定吸光值。对照组用同样的方法测定,只是将粗酶液事先于沸水中煮10 min后再加入,以蒸馏水作为比色的参比[10-11]。
酶活力定义:在上述条件下,反应10 min使1%淀粉溶液显蓝强度减低1%所需酶量为1个酶活力单位(U)。
酶活=(D0-D)×100/D0×稀释倍数
式(1)
式(1)中,D0为空白值吸光度,D为主值吸光度,100为系数(%)。
1.2.5 丹参内生真菌产酸性α-淀粉酶菌株的鉴定 根据培养特征和孢子形态对丹参内生真菌产酸性α-淀粉酶菌株进行形态鉴定。采用改良SDS法[9]提取丹参内生真菌基因组DNA,参照已报道的方法对扩增ITS序列[9]。核酸测序由上海铂尚生物科技有限公司完成。测序后经Blast在线比对分析,并构建系统发育树。
1.2.6 酸性α-淀粉酶酶学性质的研究
1.2.6.1 最适作用温度 为了确定酶的最适反应温度,将酶与底物在pH4.5的条件下分别在30~70 ℃不同温度下测定α-淀粉酶活力。在相对稳定的pH4.5的条件下再将此反应液在35,40,45,50,55,60,65,70,75 ℃反应1 h后测定酶活力。以某一温度下的最高淀粉酶活性定为100%,后者与之相比计算相对酶活力,确定酶的稳定性。
1.2.6.2 最适作用pH 为了确定酶的最适反应pH,用不同pH的0.1 mol/L的磷酸-柠檬酸缓冲液配制淀粉底物溶液,在50 ℃的条件下测定不同pH时淀粉酶活力。将反应液在50 ℃不同pH条件下再反应1 h后测定酶活力。以某一pH下的最高淀粉酶活性定为100%,后者与之相比计算相对酶活力,确定酶的稳定性。
1.2.6.3 对不同生淀粉底物的降解 底物分别为1%的玉米淀粉颗粒悬浮液、马铃薯淀粉悬浮液、红薯淀粉悬浮液、小麦淀粉悬浮液和糯米淀粉悬浮液。用pH4.5的磷酸氢二钠-柠檬酸缓冲液配制。1.5 mL离心管中分别加入1 mL底物、0.1 mL酶液,在50 ℃恒温振荡下(150 r/min)反应1 h后,再加入2 mol/L NaOH溶液0.05 mL终止反应,反应液5000 r/min离心5 mim,取上清液。于660 nm测定还原糖的量(以葡萄糖计)。生淀粉酶活力定义:在上述条件下,每分钟水解生淀粉产生1 μg葡萄糖的酶量为1个酶活力单位(U)[4]。
酶的糊化淀粉酶活力测定方法与生淀粉酶活力测定方法相同,作用底物为糊化的玉米淀粉底物。将pH4.5的磷酸氢二钠-柠檬酸缓冲液配制的1%玉米淀粉颗粒悬浮液在沸水浴中加热使其淀粉颗粒完全溶解,此溶液为1%糊化淀粉溶液[3,12]。比较酸性生淀粉酶对不同淀粉底物的降解能力强弱以及其糊化玉米淀粉后酶活力与降解各生淀粉的最适酶活力的比值。
1.2.6.4 淀粉酶酶解产物的薄层层析(TLC)分析 取一定量的粗酶液,以商品α-淀粉酶酶解产物为参照,用毛细吸管进行点样。展开剂为正丁醇∶吡啶∶水=6∶4∶1,将样品置层析缸内在室温下展开,待展开剂前沿走至距板上端1 cm处取出自然晾干,喷显色剂(20%硫酸-甲醇溶液),于85 ℃烘箱中干燥10 min左右,直到薄板上显示出清晰的斑点[12]。将薄层层析图谱与葡萄糖展开图对比进行分析。
2 结果与分析
2.1 产酸性α-淀粉酶丹参内生真菌的筛选
根据初筛培养基平板上有无透明圈及其透明圈是否明显、透明圈直径的大小,共从50株丹参内生真菌中筛选出20株对淀粉具有较强水解作用的菌株,见表1。再通过摇瓶复筛,获得α-淀粉酶酶活力较高的10株菌,见表2。其中5株菌株(图1)淀粉酶酶活力较高(p<0.05),分别是ZDH-2-2-1-1为117.63 U/mL,JGLY1-1为102.38 U/mL,JGLJ1-2-1为94.35 U/mL,BDG2-1-1为88.64 U/mL,BDF-15为84.54 U/mL。

图1 丹参内生真菌在淀粉初筛培养基中的生长状态Fig.1 Endophytic fungi from Salvia miltiorrhiza Bge.grow in the starch medium

表1 酸性α-淀粉酶产生菌的初筛结果
注:其中“+”表示透明圈明显程度,“+”越多表示越透明。

表2 酸性α-淀粉酶产生菌的复筛结果
2.2 产酸性α-淀粉酶丹参内生真菌的鉴定
将上述产淀粉酶活性高的五株菌ZDH-2-2-1-1、JGLY1-1、JGLJ1-2-1、BDG2-1-1和BDF-15通过形态学和分子方法进行鉴定。ZDH2-2-1-1和JGLJ1-2-1在PDA培养基上的菌落表面呈黑色绒状、背面灰色至黑色,生长迅速。光学显微镜镜检发现其分生孢子梗单生或成簇,分生孢子倒棒状,有壁砖状分隔,成链状排列,初步将这两株菌鉴定为链格孢属(Alternariasp.)。JGLY1-1、BDG2-1-1和BDF-15为不产孢真菌,可进一步进行分子鉴定。

图2 根据丹参内生真菌rDNA-ITS序列构建的系统发育树Fig.2 Phylogenetic trees of endophytic fungi from based on rDNA-ITS sequence analysis
利用通用引物ITS1和ITS4,经PCR扩增五株丹参内生真菌的ITS序列,提交至GenBank获得Accession number,并在Gen Bank数据库中进行Blast比对,选择同源性高于97%的菌株进行系统发育分析。基于邻接法(Neighbor joining,NJ)构建其系统进化树(图2),结果发现,JGLY1-1与Trameteshirsuta聚在同一分支中,它们ITS序列的相似性达到99%;BDF-15与Psathyrellacandolleana以99%的相似性聚在一起。BDG2-1-1与Schizophyllumcommune高度聚类(自展值为99%)。JGLJ1-2-1与Alternariaalternata,ZDH2-2-1-1与Alternariasp.被分在同一个分支中。因此,将丹参内生真菌ZDH-2-2-1-1、JGLY1-1、JGLJ1-2-1、BDG2-1-1和BDF-15鉴定为互隔链格孢(Alternariaalternata)、粗毛栓菌(Trameteshirsuta)、链格孢属(Alternariasp.)、裂褶菌(Schizophyllumcommune)和白黄小脆柄菇(Psathyrellacandolleana)。目前我国产酸性α-淀粉酶的真菌主要是根霉、曲霉和青霉[2-3,5-7],本研究所分离的内生真菌可扩大淀粉酶生产菌种的来源。
2.3 酸性α-淀粉酶酶学性质研究
2.3.1 酶的最适温度及其热稳定性结果 分别在35~70 ℃测定α-淀粉酶活力。由图3可知,ZDH-2-2-1-1的最适温度为55 ℃,JGLY1-1为45 ℃,JGLJ1-2-1为40 ℃,BDG2-1-1为50 ℃,BDF-15为50 ℃,其中ZDH-2-2-1-1在60~70 ℃之间其活力可达最高活力的60%以上,而JGLY1-1、JGLJ1-2-1、BDG2-1-1和BDF-15高于50 ℃后酶活力急剧下降。由图4可知,在反应液保温1 h后,菌株ZDH-2-2-1-1在60 ℃以内的范围具有较好的稳定性,55 ℃保温1 h后,残余酶活仍达到86.2%(p<0.05),而在60 ℃以上时热稳定性较差,70 ℃保温1 h酶活仅剩不足50%,而其它菌株热稳定性较差。

图3 温度对5株丹参内生真菌淀粉酶活性的影响Fig.3 Effect of temperature on amylase activity
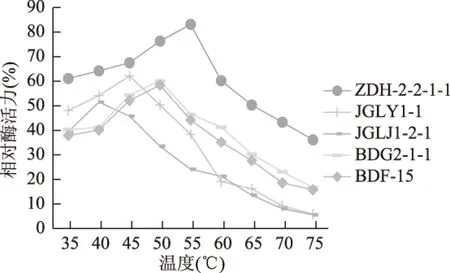
图4 温度对5株丹参内生真菌淀粉酶稳定性的影响Fig.4 Effect of temperature on the stability amylase activity
目前国内外有关耐热生淀粉酶的报道较少,从国内外报道的耐热生淀粉酶看,最适温度一般在50~60 ℃[4]。本研究中ZDH-2-2-1-1最适温度都50 ℃以上,具有潜在的工业应用价值。
2.3.2 酶的最适pH及其pH稳定性结果 用不同pH的0.1 mol/L的磷酸-柠檬酸缓冲液配制淀粉底物溶液,pH范围为3.5~7.0,测定不同pH时α-淀粉酶活力,结果如图5。可以看出,ZDH-2-2-1-1为4.0,JGLY1-1和BDF-15的最适pH为4.5,JGLJ1-2-1和BDG2-1-1为5.0。这5株菌株的最适pH都在酸性范围内,为酸性α-淀粉酶。在反应液保温1 h后,菌株ZDH-2-2-1-1在pH3.0~5.0的范围具有较好的稳定性,pH4.0保温1 h后,残余酶活仍达到87.9%,其它4株菌的pH稳定性较差(p<0.05)(图6)。
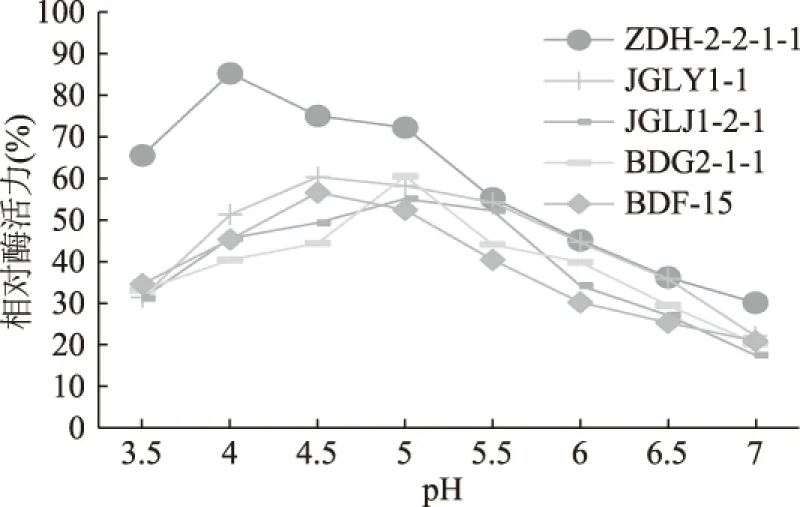
图5 pH对5株丹参内生真菌淀粉酶活性的影响Fig.5 Effect of pH on amylase activity

图6 pH对5株丹参内生真菌淀粉酶稳定性的影响Fig.6 Effect of pH on the stability amylase activity
2.3.3 酶对不同生淀粉底物降解及其稳定性结果 在1.5 mL离心管中分别加入5株丹参内生真菌的粗酶液0.1 mL和已配制的1%玉米淀粉、马铃薯淀粉、红薯淀粉、小麦淀粉和糯米淀粉颗粒悬浮液以及糊化后的玉米淀粉悬浮液。测定淀粉酶对不同生淀粉及其糊化玉米淀粉的降解能力。由表3可知,ZDH-2-2-1-1对各种生淀粉降解的强弱顺序为:糯米淀粉>马铃薯淀粉>红薯粉>小麦淀粉>玉米淀粉;JGLY1-1为糯米淀粉>小麦淀粉>玉米淀粉>红薯淀粉>马铃薯淀粉;JGLJ1-2-1为红薯淀粉>糯米淀粉>小麦淀粉>马铃薯淀粉>玉米淀粉;BDG2-1-1为糯米淀粉>马铃薯淀粉>玉米淀粉>红薯淀粉>小麦淀粉;BDF-15为玉米淀粉>马铃薯淀粉>糯米淀粉>小麦淀粉>红薯淀粉。这5株菌株降解糊化玉米淀粉与降解最适底物溶液的酶活力比值分别为:ZDH-2-2-1-1为1.11,JGLY1-1为1.21,JGLJ1-2-1为1.19,BDG2-1-1为1.18,BDF-15为1.14。上述结果表明,ZDH-2-2-1-1、JGLY1-1及BDG2-1-1菌株的最适降解底物为糯米淀粉,JGLJ1-2-1为红薯淀粉,BDF-15为玉米淀粉,其中ZDH-2-2-1-1底物最为丰富且其酶学特性最为符合现代工业要求,在工业淀粉深加工有极大的开发潜力。
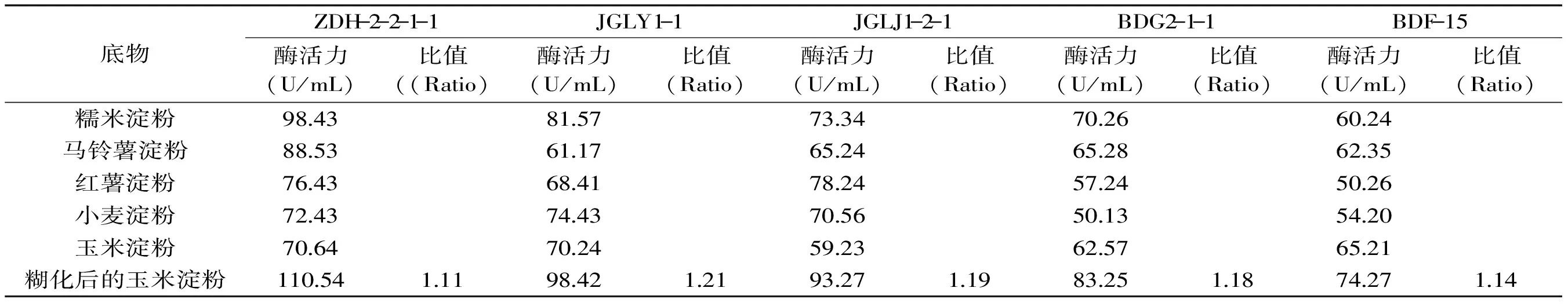
表3 酶对不同底物的水解情况
注:(Ratio指的是糊化玉米淀粉为底物淀粉酶活力与降解最适生淀粉的酶活力的比值。
2.3.4 淀粉酶酶解产物的薄层层析分析 取一定量ZDH-2-2-1-1淀粉酶粗酶液,按照酶活力测定的方法进行酶解反应,以薄层层析法鉴定酶解产物。由图7可知,ZDH-2-2-1-1的淀粉酶和商品α-淀粉酶一样,其酶解产物中有葡萄糖,说明此菌产生的淀粉酶能将可溶性淀粉降解成葡萄糖,即粗酶液中含有淀粉糖化酶组分。
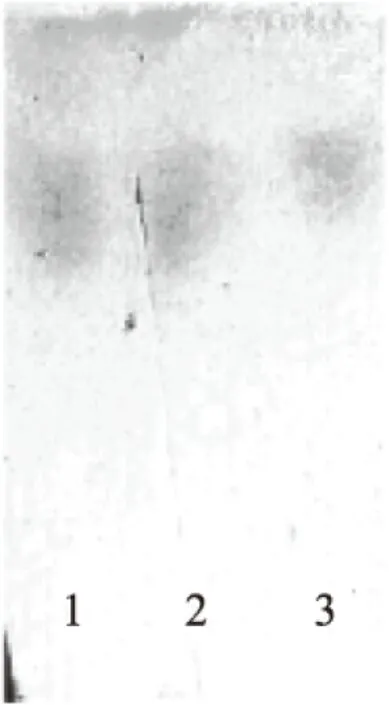
图7 丹参内生真菌ZDH-2-2-1-1的淀粉酶酶解液TLC分析结果Fig.7 TLC of hydrolysis products by endophytic fungus ZDH-2-2-1-1 strains注:1:ZDH-2-2-1-1淀粉酶酶解产物,2:商品α-淀粉酶酶解产物,3:1%的葡萄糖标准品。
3 结论
本研究从丹参内生真菌筛选出5株耐热性强的酸性生淀粉酶菌株ZDH-2-2-1-1、JGLY1-1、JGLJ1-2-1、BDG2-1-1和BDF-15,经形态学观察和ITS序列分析,将其鉴定为互隔链格孢、粗毛栓菌、链格孢属、裂褶菌和白黄小脆柄菇。在对其耐热性及耐酸性测定时发现,ZDH-2-2-1-1的最适温度为55 ℃,JGLY1-1为45 ℃,JGLJ1-2-1为40 ℃,BDG2-1-1为50 ℃,BDF-15为50 ℃,其中,ZDH-2-2-1-1在60~70 ℃之间仍有酶活力,且最适pH为4.0,为耐热性酸性淀粉酶。通过对不同生淀粉底物的降解发现ZDH-2-2-1-1、JGLY1-1及BDG2-1-1菌株的最适降解底物为糯米淀粉,JGLJ1-2-1为红薯淀粉,BDF-15为玉米淀粉,其中ZDH-2-2-1-1具有广谱的生淀粉降解能力且其酶学特性最为符合现代工业生产要求,在工业淀粉深加工领域具有很大的应用前景,经淀粉酶酶解产物的薄层层析分析确定为α-淀粉酶。
由于本研究中的野生菌株产酶量和时间等因素的限制,未涉及到淀粉酶的分离纯化、分子量的测定及基因序列分析等工作,在今后的研究中应对其分子量及其基因序列进行分析,进而可通过诱变育种和基因工程育种等方法提高产酶量,来满足现代淀粉深加工工业生产的需求。
[1]Anitha G,Muralikrighna G.α-Amylase:structure and function relationship[J]. Trends Carbohydr Res,2009,1(4):1-11.
[2]Sun HY,Zhao PJ,Ge XY,et al. Recent advances in microbial raw starch degrading enzymes[J]. Appl Biochem Biotechnol,2010,160(4):988-1003.
[3]Lin HJ,Xian L,Zhang QJ,et al. Production of raw cassava starch-degrading enzyme byPenicilliumand its use in conversion of raw cassava flour to ethanol[J]. J Ind Microbiol Biotechnol,2011,38(6):733-742.
[4]董永存,刘洋,陈源源,等. 嗜热菌来源的生淀粉酶分离纯化及其酶学性质[J].微生物学报,2008,48(2):169-175.
[5]Mamo G and Gessesse A. Production of raw-starch digesting amyloglucosidase byAspergillussp GP-21 in solid state fermentation[J]. Journal of Industrial Microbiology & Biotechnology,1999,22(6):622-626.
[6]Sun HY,Zhao PJ,Peng M. Application of maltitol to improve production of raw starch digesting glucoamylase byAspergillusnigerF-08[J]. World J Microbiol Biotechnol,2008,24(11):2613-2618.
[7]Sun HY,Ge XY,Zhang WG. Production of a novel raw-starch-digesting glucoamylase byPenicilliumsp. X-1 under solid state fermentation and its use in direct hydrolysis of raw starch[J]. World J Microbiol Biotechnol,2007,23(5):603-613.
[8]Corrêa RCG,Rhoden SA,Mota TR,et al. Endophytic fungi:expanding the arsenal of industrial enzyme producers[J]. J Ind Microbiol Biotechnol,2014,41(10):1467-1478.
[9]李艳玲,史仁玖,郝岗平,等. 泰山产丹参内生真菌的分离鉴定和多样性分析[J].时珍国医国药,2012,23(1):114-117.
[10]刘旭东,徐岩. 一种新的中温酸性α-淀粉酶的分离纯化及酶学性质[J].应用与环境生物学报,2008,14(2):235-239.
[11]杨培华,李忠海,刘永乐,等. 耐酸性α-淀粉酶的开发与应用[J].食品与机械,2006,12(5):132-136.
[12]Marlida Y,Saari N,Hassan Z,et al.Raw starch-degrading enzyme from newly isolated strains of endophytic fungi[J].World Journal of Microbiology & Biotechnology,2000,16(6):573-578.
Screening,identification of endophytic fungus produing raw starch-degrading enzyme fromSalviamiltiorrhizaBge. and its enzymatic properties
LI Yan-ling1,FAN Lu-yu2,HOU Yan-ying1,LIU Chao1,WANG Yu-ting1, SHI Ren-jiu1,CHANG Zheng-yao1,TIAN Yuan1,ZHANG Xian-zhong1,HAO Gang-ping1
(1.College of Life Sciences,Taishan Medical University,Tai’an 271016,China; 2.School of Life Sciences,Inner Mongolia University,Huhhot 010021,China)
Objective:Acid amylase producing endophytic fungus was screened fromSalviamiltiorrhizaBge. And its enzymatic properties were studied. Method:Amylase producing strains with high activity were screened by starch solid medium and fermentation medium,and identified by morphological observation and ITS sequence analysis. Results:5 strains with higher amylase activity were screened from 50 endophytic fungi. Among them,the strain ZDH2-2-1-1 produced the highest activity of amylase,and the enzyme activity reached 117.63 U/mL,which was identified asAlternariaalternata. The enzyme properties showed that the optimal reaction pH of amylase from the strain ZDH2-2-1-1 was 4.0,the optimal reaction temperature was 55 ℃,and the strain ZDH2-2-1-1 had good thermal stability,pH stability and a wide spectrum degradation ability of raw starch. By thin layer chromatography,the results showed that the enzymatic hydrolysis product of amylase produced by ZDH-2-2-1-1 was glucose. Conclusion:Endophytic fungi fromSalviamiltiorrhizaBge. can produce heat-resistant acid amylase,which has great development potential in the deep processing of raw starch.
SalviamiltiorrhizaBge.;endophytic fungi;raw starch-degrading enzyme;degradation ability
2016-10-19
李艳玲(1977-),女,博士,副教授,主要从事药用植物内生真菌次级代谢产物研究,E-mail:lingl816@163.com。
国家自然科学基金(81403036);山东省自然科学基金(ZR2014HM048);山东省重点研发计划(2016GSF202002);山东省教育厅课题(J15LM56);泰山医学院高层次课题培育计划(2015GCC15);泰安市科技发展计划(2015NS1121,2016NS1218);山东省中医药科技发展计划项目(2015-246);国家大学生创新创业训练计划(201510439063,201610439258,201610439259,201610439263)。
TS201.3
A
1002-0306(2017)09-0108-06
10.13386/j.issn1002-0306.2017.09.012
