晚期结直肠癌患者5-Fu AUC理想区间值的研究
2017-06-05杨东海
杨东海
(邢台医学高等专科学校第二附属医院普外科,河北邢台 054000)
晚期结直肠癌患者5-Fu AUC理想区间值的研究
杨东海
(邢台医学高等专科学校第二附属医院普外科,河北邢台 054000)
目的 探讨基于mFOLFOX6化疗方案晚期结直肠癌(CRC)患者外周静脉血5-氟尿嘧啶(5-Fu)血药浓度-时间曲线下面积(AUC)的理想区间值。方法 将接受mFOLFOX6化疗方案治疗的120例CRC患者按AUC计算结果分成两组:AUC≤20 mg·h·L-1组与AUC>20 mg·h·L-1组,比较两组疗效及不良反应发生情况。结果 AUC>20 mg·h·L-1组的客观缓解率为59.7%,显著高于AUC≤20 mg·h·L-1组的31.3%,组间比较差异有统计学意义(χ2=9.349 3,P=0.003 8);AUC>25 mg·h·L-1组患者其Ⅰ~Ⅱ度与Ⅲ~Ⅳ度骨髓抑制发生率均显著高于AUC≤25 mg·h·L-1组,同时Ⅲ~Ⅳ度腹泻与Ⅲ~Ⅳ度口腔黏膜炎发生率也显著高于AUC≤25 mg·h·L-1组,以上数据的组间比较差异均有统计学意义(P<0.01)。结论 20~25 mg·h·L-1可能为接受mFOLFOX6化疗方案治疗晚期CRC患者外周静脉血5-FU AUC的理想区间值。
结肠肿瘤;直肠肿瘤;化疗
结直肠癌(colorectal cancer,CRC)是全球范围内的第2高发恶性肿瘤,其年均新增病例已超过100万例,占全部恶性肿瘤的9.4%。最新统计数据显示,CRC在我国发病率的年递增速度大概为2.4%,已上升至癌症疾病谱第3位[1]。外科手术是临床首选的CRC治疗途径,但有20%~30%的患者在初诊时已为晚期,难以通过手术达到根治目的,对此类患者,化疗则成为其主要治疗手段[2]。虽然应用于晚期CRC化疗的药物种类在增多,但普遍认为氟尿嘧啶仍是此疾病领域的基石性药物,5-氟尿嘧啶(5-fluorouracil,5-FU)应用于临床已将近50年之久[3]。相关研究表明,目前临床所应用的5-FU给药剂量在很大部分患者中并不能实现理想的血药浓度,其中偏低者达40%~60%,偏高者为10%~20%。而国外的新研究则初步揭示了5-FU药物动力学参数稳态血药浓度(concentration at steady state,Css)-时间曲线下面积(area under the curve,AUC)与临床疗效及不良反应之间的关系,并认为基于AUC检测进行个体化5-FU剂量调整对提高药物疗效及控制不良反应有益[4]。为验证上述结论,本研究对在本院接受mFOLFOX6化疗方案治疗的晚期CRC患者AUC与近期疗效及不良反应的相关性进行了考察,并确定出AUC的理想区间值,继而为规范临床5-FU给药剂量调整方案提供理论参考,现报道如下。
1 资料与方法
1.1 一般资料 选取于2011年10月至2016年3月在本院接受mFOLFOX6化疗方案治疗的晚期CRC患者120例作为研究对象,包括男73例,女47例;年龄23~81岁,平均(58.4±12.7)岁;参考美国肿瘤综合协作网《临床肿瘤治疗指南》,Ⅲb期64例,Ⅳ期56例;其中有15例患者有既往化疗史,但所有患者在本次治疗前1个月内均未接受过其他任何抗肿瘤药物治疗。本研究获得本院伦理委员会批准且有获得所有受试者知情并签署知情同意书。纳入标准:(1)经病理检查证实为晚期CRC者;(2)医学影像检查提示至少包含有1个可测量病灶,且发现有不可切除的转移灶;(3)预计存活时间不低于3个月;(4)本次治疗前经实验室检查具备相对理想的骨髓功能、肝功能(总胆红素1.5倍正常值上限,碱性磷酸酶3.0倍正常值上限,丙氨酸氨基转移酶和天门冬氨酸氨基转移酶小于或等于3.0倍正常值上限)及肾功能(肌酐小于或等于135 μmol/L);(5)WHO体能状态评分小于或等于2分。排除标准:(1)已发生有中枢神经系统转移者;(2)合并有除CRC以外的其他原发性肿瘤者;(3)合并肠梗阻者。
1.2 方法
1.2.1 化疗方法 120例患者全部接受mFOLFOX6化疗方案治疗,具体方法为:每个化疗周期第1天,奥沙利铂(浙江海正药业股份有限公司,国药准字H20093487,规格50 mg/s)持续静脉滴注,85 mg/m2,滴注时间2 h;亚叶酸钙(国药一心制药有限公司,国药准字H20053382,规格100 mg/s)持续静脉滴注,400 mg/m2,滴注时间2 h;5-FU(上海旭东海普药业有限公司,国药准字H31020593,规格10 mL:0.25 g)静脉推注,400 mg/m2。在完成5-FU静脉推注后再以2 400 mg/m2持续静脉泵注,持续泵注时间(TCI)为46 h。既定每个化疗周期的时间为2周。
1.2.2 5-FU血药浓度检测与AUC值计算 于第1个化疗周期内取5-FU静脉泵注13~30 h时间段,采集每位患者外周静脉血2 mL行15 cm半径离心处理,转速3 000 r/min,10 min后将分离获得的血浆放置到-20 ℃冰箱内保存待检。所有血浆样本均在1周内完成检测。具体检测方法采用董秋美等[5]与邓杨林等[6]报道的高效液相色谱法进行,采用外标一点法通过峰面积计算Css值。5-FU AUC=Css×TCI。
1.2.3 分组 参考国外数篇临床研究报道[5-8],将5-FU最佳药物暴露靶向范围即5-FU AUC治疗窗初步确定在20~30 mg·h·L-1,另结合临床实际检测结果,对不同AUC检测计算结果进行两个不同梯度值的分组对比考察,即分别考察AUC≤20 mg·h·L-1组与AUC>20 mg·h·L-1组的疗效差异,以及AUC≤25 mg·h·L-1组与AUC>25 mg·h·L-1组的不良反应发生情况差异。
1.3 效果评价
1.3.1 疗效标准 化疗2个周期后参考WHO相关标准进行近期疗效评价。完全缓解(CR):所有病灶完全消失;部分缓解(PR):病灶最大径乘积之和较基线状态缩小50%以上;无变化(NC):各病灶最大径乘积之和较基线状态缩小不足50%,或增大不超过25%;疾病进展(PD):各病灶最大径乘积之和较基线状态增大超过25%或出现新病灶。客观缓解率(ORR)=(CR+PR)/总例数×100%。
1.3.2 不良反应 参考美国国立癌症研究所(National Cancer Institute,NCI)通用不良反应分级标准(common terminology criteria for adverse events,CTCAE 3.0)对2个化疗周期内出现的不良反应进行评价,分为Ⅰ~Ⅳ度,为方便统计分析,本研究将不良反应分为Ⅰ~Ⅱ度与Ⅲ~Ⅳ度两个梯度进行统计学分析。不良反应主要考察骨髓抑制、腹泻、口腔黏膜炎、胃肠道反应以及手足综合征等5项。

2 结 果
2.1 不同一般性临床特征患者的Css水平比较 按性别、年龄、分期及既往化疗史等一般性临床特征因素进行分析,不同因素组别患者的Css水平组间比较差异均无统计学意义(P>0.05),见表1。
2.2 5-FU AUC值分布特点及不同梯度值分组下的临床特征比较 120例患者的5-FU AUC值呈正态分布,不同5-FU AUC梯度值分组下的性别、年龄、分期及既往化疗史等一般性临床特征组间比较差异无统计学意义(P>0.05),见表2。
2.3 AUC≤20 mg·h·L-1组与AUC>20 mg·h·L-1组的疗效比较 AUC>20 mg·h·L-1组的ORR为59.7%,显著高于AUC≤20 mg·h·L-1组的31.3%,组间比较差异有统计学意义(χ2=9.349 3,P=0.003 8),见表3。
2.4 AUC≤25 mg·h·L-1组与AUC>25 mg·h·L-1组的不良反应发生情况比较 AUC>25 mg·h·L-1组患者其Ⅰ~Ⅱ度与Ⅲ~Ⅳ度骨髓抑制发生率均显著高于AUC≤25 mg·h·L-1组,同时Ⅲ~Ⅳ度腹泻与Ⅲ~Ⅳ度口腔黏膜炎发生率也显著高于AUC≤25 mg·h·L-1组,以上数据的组间比较差异均有统计学意义(P<0.01),见表4。

表1 不同一般性临床特征患者的Css水平比较

表2 5-FU AUC值分布特点及不同梯度值分组下的临床特征比较
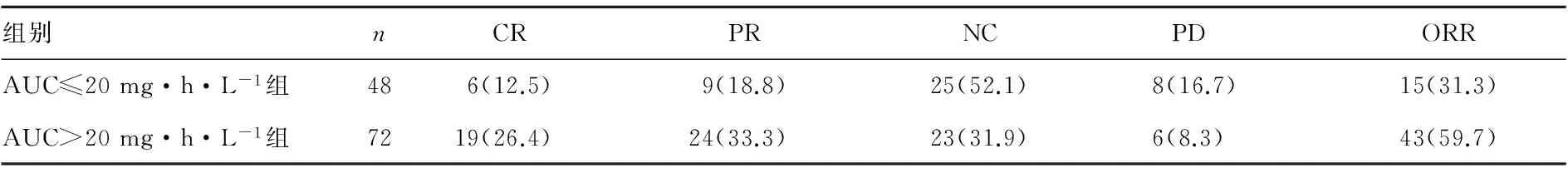
表3 AUC≤20 mg·h·L-1组与AUC>20 mg·h·L-1组的疗效比较[n(%)]
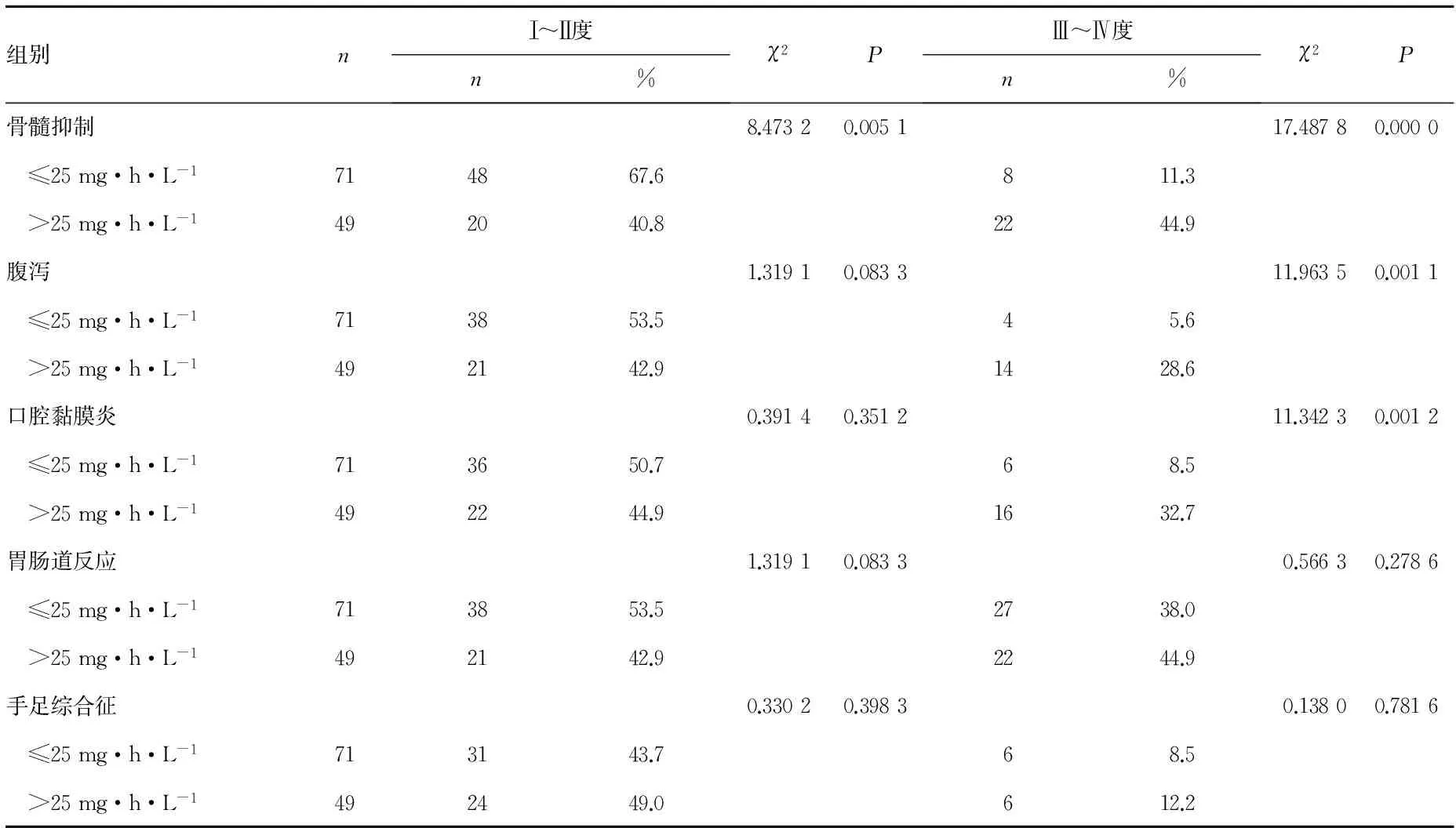
表4 AUC≤25 mg·h·L-1组与AUC>25 mg·h·L-1组的不良反应发生情况比较
3 讨 论
在大部分医院中,现行采用的5-FU用药剂量方案仍是基于传统的体表面积计算方法,而关于体表面积是否与5-FU的药代动力学存在一定关联性,是目前颇受关注的一个学术问题。Milano等[7]研究发现,380例头颈部肿瘤患者在接受顺铂联合5-FU化疗治疗过程中,5-FU在给药后的血浆清除率呈正态分布,不同患者个体的清除率差异最高可达100倍左右,且5-FU清除率与体表面具并无明显相关性。有研究针对体表面积给药方案选用了33个抗肿瘤药物品种进行了更为广谱化的研究,结果发现,基于体表面积给药仅降低了5个药物品种的个体差异,占总品种数的15.2%,同时清除率差异的降低程度大概为15~35%,该结果提示大概仅有1/3的差异可能为不同体表面积所致[8]。另外国内学者宋卫峰等[9]发现,5-FU给药后的血药浓度与基于体表面积的给药剂量之间无明显相关性(r=0.056,P=0.217),同时与5-FU的实际持续输注剂量也无相关性(r=0.066,P=0.146)。以上国内外的相关研究结果均提示基于体表面积计算5-FU给药剂量存在有明显缺陷。
实则在Saam等[4]的研究之前,已有多位学者对5-FU给药后的AUC值与其所表现出的生物学效应进行过尝试性探索。如Capitain等[8]与Saif等[10]认为,晚期CRC患者在接受5-FU化疗治疗后的AUC值与ORR、无进展生存期及总生存率均存在有高度相关性;Ciccolini等[11]对AUC与5-FU给药后不良反应发生情况之间的关系进行了研究,结果显示AUC值与骨髓抑制、腹泻及口腔黏膜炎等不良反应发生率均具相关性。在静脉持续泵注的给药模式中,5-FU的血药浓度一般在2 h左右即可达到稳态,故只需在此时间点之后的任何时间点进行Css检测,为确保准确性可将血液样本的采集时间较2 h适当延后,一般建议在12 h后进行[12]。本研究中患者的采血时间均在5-FU给药后的18~30 h内。在获得Css后,AUC可通过关系公式进行计算。故理论上可以作如下推测:在获取AUC值后,可分别通过适当增加或减少5-FU给药剂量来对应提高AUC值偏低患者的疗效,或降低AUC值偏高患者的不良反应,以此为接受5-FU化疗治疗患者提供一个更为理想的AUC区间值。5-FU在不同患者之间存在较大的药代动力学差异[13],但本研究结果显示,按性别、年龄、分期以及既往化疗史等一般性临床特征因素进行分析,不同因素组别患者的Css水平组间比较差异无统计学意义(P>0.05)。与此同时,本研究参考国外数篇临床研究报道并结合临床实际检测结果,对不同AUC检测计算结果进行两个不同梯度值的分组对比考察,即分别考察AUC≤20 mg·h·L-1组与AUC>20 mg·h·L-1组的疗效差异及AUC≤25 mg·h·L-1组与AUC>25 mg·h·L-1组的不良反应发生情况差异。不同5-FU AUC梯度值分组下的一般临床特征比较结果显示:AUC≤20 mg·h·L-1组与AUC>20 mg·h·L-1组及AUC≤25 mg·h·L-1组与AUC>25 mg·h·L-1组的性别、年龄、分期以及既往化疗史等一般临床特征组间比较差异无统计学意义(P>0.05),这也为本研究提供了必要的可比性基础。
本研究结果显示,AUC>20 mg·h·L-1可帮助患者获得相对更为满意的疗效,在低于该水平值时则应考虑增加5-FU给药剂量。就不良反应的发生情况来看,AUC>25 mg·h·L-1的情况下不良反应明显加重,此时应考虑降低5-FU给药剂量以减轻Ⅲ~Ⅳ度毒性反应,帮助患者提高治疗耐受性。综合上述结果笔者认为,与国外文献的报道一致,20~25 mg·h·L-1可能即为5-FU AUC的理想区间值。
综上所述,在国外研究成果的基础上,本研究进一步验证20~25 mg·h·L-1可能是接受mFOLFOX6化疗方案治疗晚期CRC患者外周静脉血5-FU AUC的理想区间值。通过调整给药剂量将5-FU AUC控制在该范围内,有望帮助此类患者获得相对较好的近期疗效,同时将不良反应程度控制到最低。但本临床研究尚处在初级描述阶段,仍有亟待完善之处,如该AUC区间值指导治疗下的患者远期生存情况还需进一步调查。笔者拟在后续研究中继续求证。
[1]闫涛.结直肠癌流行病学特征及其危险因素[J].疾病监测与控制杂志,2015,9(4):241-243.
[2]钱鸣杰,眭振宇,唐文,等.3种药物联合治疗晚期结直肠癌的疗[J].重庆医学,2015,44(22):3112-3114.
[3]Abdel Hamid NM,Morsy MA.Novel biochemical pathways for 5-Fluorouracil in managing experimental hepatocellular carcinoma in rats[J].J Membrane Biol,2010,234(1):29-34.
[4]Saam J,Critchfield GC,Hamilton SA,et al.Body surface area-based dosing of 5-fluorouracil results in extensive interindividual variability in 5- fluorouracil exposure in colorectal cancer patients on FOLFOX regimens[J].Clin Colorectal Cancer,2011,10(3):203-206.
[5]董秋美,黄赛花,郑伟华,等.高效液相色谱法检测结直肠癌患者5-FU血药浓度的临床意义[J].中华肿瘤防治杂志,2010,17(18):1476-1481.
[6]邓杨林,姚勤,吴晖,等.HPLC法测定肿瘤患者外周血5-FU血药浓度[J].昆明医学院学报,2011,32(6):53-55.
[7]Milano G,Etienne MC,Cassuto-Viguier E,et al.Influence of sex and age on fluorouracil clearance[J].J Clin Oncol,1992,10(7):1171-1175.
[8]Capitain O,Boisdron-Celle M,Poirier AL,et al.The influence of fluorouracil outcome parameters on tolerance and efficacy in patients with advanced colorectal cancer[J].Pharmacogenomics J,2008,8(4):256-267.
[9]宋卫峰,王雷,蔡讯,等.晚期结直肠癌患者氟尿嘧啶剂量与血药浓度和生存的关系[J].肿瘤,2013,33(9):820-826.
[10]Saif MW,Choma A,Salamone SJ,et al.Pharmacokinetically guided dose adjustment of 5-fluorouracil:a rational approach to improving therapeutic outcomes[J].J Natl Cancer Inst,2009,101(22):1543-1552.
[11]Ciccolini J,Gross E,Dahan L,et al.Routine dihydropyrimidine dehydrogenasetesting for anticipating 5-fluorouracil related severe toxicities:hype or hope?[J].Clin Colorectal Cancer,2010,9(4):224-228.
[12]时静,陈海生,段存贤,等.5-氟尿嘧啶治疗药物监测的研究现状[J].中国临床药理学杂志,2016,32(11):1053-1056.
[13]曹洁,唐金海,侯梅.FOLFOX4方案治疗结直肠癌患者5-FU稳态血药浓度与不良反应的相关性研究[J].中华肿瘤防治杂志,2011,18(2):134-136.
10.3969/j.issn.1671-8348.2017.14.038
杨东海(1980-), 主治医师,硕士,主要从事胃肠肿瘤外科。
R735.3
B
1671-8348(2017)14-1981-04
2016-12-22
2017-02-09)
