盐酸戊乙奎醚上调β抑制蛋白-1与M3受体的关系研究*
2017-06-05王轶芃
程 斌,王轶芃,詹 佳
(武汉大学中南医院麻醉科 430071)
论著·基础研究
盐酸戊乙奎醚上调β抑制蛋白-1与M3受体的关系研究*
程 斌,王轶芃,詹 佳△
(武汉大学中南医院麻醉科 430071)
目的 探讨在脂多糖(LPS)致肺微血管内皮损伤中盐酸戊乙奎醚(PHC)上调β抑制蛋白-1(β-arrestin-1)的作用与M3受体的关系。方法 M3 shRNA转染肺微血管内皮细胞和正常肺微血管内皮细胞,分为LPS组(A)、盐酸戊乙奎醚+LPS组(B)、LPS+M3 shRNA转染组(C)和盐酸戊乙奎醚+LPS+M3 shRNA转染组(D),激光共聚焦观察细胞骨架变化,检测细胞上清液中乳酸脱氢酶(LDH)水平,免疫荧光化学法检测血管内皮细胞黏附分子-1(VCAM-1)蛋白表达,Western blot法和实时定量PCR法检测β-arrestin-1表达。结果 与A组、C组比较,B组、D组肌动蛋白骨架排列整齐,LDH水平和VCAM-1蛋白表达降低,β-arrestin-1表达升高;与A组、B组相比较,C组、D组肌动蛋白骨架排列整齐,LDH水平和VCAM-1蛋白表达降低,β-arrestin-1表达无明显改变。结论 沉默M3受体有助于降低脂多糖诱导的肺微血管内皮细胞损伤。但盐酸戊乙奎醚上调β-arrestin-1的作用与M3受体是否存在无必然联系。
M3受体;盐酸戊乙奎醚;β抑制蛋白-1;RNA干扰
脓毒症是当前急危重症患者的主要死亡原因之一[1]。肺是此过程中最容易受到损伤的靶器官之一,主要表现为急性肺损伤(acute lung injury,ALI)[2]。内毒素的重要化学成分之一是脂多糖(lipopolysaccharide,LPS),该成分也是脓毒症、ALI的主要致病因子之一。血管内皮细胞的损伤是脓毒症急性肺损伤中的一个重要环节,脂多糖与受体结合后,可通过激活炎性细胞因子直接及间接损伤肺微血管内皮细胞,增高肺微血管通透性,最终引起急性肺损伤[3]。盐酸戊乙奎醚注射液(Penehyclidine Hydrochloride,PHC),商品名长托宁,由军事医学科学院设计合成。β抑制蛋白(β-arrestins)是当今生物学中信号传导研究领域的热点之一,是G蛋白耦联受体通路的负调控蛋白,本课题组前期研究发现,盐酸戊乙奎醚可上调β-arrestin-1表达,减轻脓毒症肺损伤[4]。而盐酸戊乙奎醚是一种M1、M3选择性胆碱能受体阻滞剂。本研究拟通过M3受体shRNA干扰转染人肺微血管内皮细胞,利用LPS与细胞共同孵育,模拟体外脓毒症状态,通过观察盐酸戊乙奎醚对细胞骨架变化,内皮细胞乳酸脱氢酶(lactate dehydrogenase,LDH)水平,血管内皮细胞黏附分子-1(vascular cell adhesion molecule 1,VCAM-1)蛋白表达以及β-arrestin-1表达的影响,观察M3在LPS诱导的肺微血管内皮细胞损伤中的作用,并探讨盐酸戊乙奎醚上调β-arrestin-1的作用是否与M3受体的存在有关。
1 材料与方法
1.1 材料 人肺微血管内皮细胞(美国Scien Cell公司),RPMI 1640培养基(Sigma公司,美国),盐酸戊乙奎醚(批号:050302-1,成都力思特制药厂),无血清培养基中(Invitrogen Life Technologies公司,美国),脂质体2000试剂(Invitrogen Life Technologies公司,美国),LDH试剂盒(南京建成生物工程研究所),兔单克隆抗体IgG(Abcam公司,英国),FITC标记山羊抗兔IgG(KPL公司,美国),DAPI染液(碧云天公司),抗荧光淬灭封片剂(碧云天公司),β-arrestin-1一抗(Abcam公司,英国)和β-actin一抗(Santa Cruz公司,美国),二抗HRP-羊抗兔IgG(KPL公司,美国)。
1.2 人肺微血管内皮细胞(human pulmonary microvascular endothelial cell,HPMVEC)体外培养 HPMVEC用加入双抗的10%胎牛血清RPMI 1640培养基,置于37 ℃ 5%CO2培养箱中培养,隔天换液,相差显微镜下观察,培养瓶中单个细胞呈梭形或多边形,细胞株不断生长、分化后,融合呈典型铺路石样排列。待细胞培养至80%左右融合时,吸弃培养液,用PBS冲洗2次。用37 ℃预温的0.25%胰蛋白酶消化2~3 min,加3 mL培养基终止消化,吹打混匀成悬液,计数后按1∶2比例传代,实验取4~6代细胞。
1.3 分组及处理 将已长成致密单层的内皮细胞用培养基稀释成细胞悬液,以1×105个/mL的密度接种于6孔板(每孔2 mL)或培养瓶(每瓶4 mL)中,采用随机数字表法将其分为4组: LPS组(A)、盐酸戊乙奎醚+LPS组(B)、LPS+M3 shRNA转染组(C)和盐酸戊乙奎醚+ LPS+M3 shRNA转染组(D)。含M3受体shRNA质粒的构建及转染委托武汉谷歌生物公司完成。在50 μL的Opti-MEM无血清培养基中加入含M3受体shRNA的质粒,另取50 μL Opti-MEM无血清培养基,加入 4.5 μL 脂质体2000试剂,混匀后室温静置20 min,进行转染。以含M3受体shRNA转染细胞后,孵育24 h。A组:正常细胞加入终浓度为0.1 μg/mL的LPS孵育1 h;B组:正常细胞先加入终浓度为2.0 μg/mL的盐酸戊乙奎醚,孵育1 h时加入终浓度为0.1 μg/mL的LPS继续孵育1 h;C组:以含M3受体 shRNA的质粒转染细胞24 h时加入终浓度为0.1 μg/mL的LPS孵育1 h;D组:以含M3受体 shRNA的质粒转染细胞24 h时加入终浓度为2.0 μg/mL的盐酸戊乙奎醚孵育1 h后,加入终浓度为0.1 μg/mL的LPS继续孵育1 h。
1.4 免疫双荧光标记-激光共聚焦显微镜观察肌动蛋白骨架变化 将内皮细胞用胰蛋白酶消化并制成细胞悬液,吹打均匀后滴于盖玻片上,取出盖玻片按以下流程处理:PBS漂洗,4%多聚甲醛室温固定5 min,细胞生长至融合后加入罗丹明标记的鬼笔环肽并在室温下孵育40 min。PBS漂洗,滴加DAPI染液,在黑暗中室温孵育10 min。采用Carl Zeiss 7激光扫描共聚焦显微镜(Carl Zeiss AG,德国)观察细胞骨架的变化。
1.5 LDH水平测定 取出加入处理因素后的6孔板,每组取两板,任选10个培养孔,于60 min时间点,按照LDH试剂盒说明书进行操作,用2,4-二硝基苯肼显色法检测LDH水平。
1.6 免疫细胞荧光染色法检测VCAM-1蛋白表达 取出加入各种处理因素后的6孔板,放置灭菌盖玻片,用4%多聚甲醛固定,PBS冲洗后稍甩干,用组化笔在盖玻片中间细胞分布均匀的位置画圈,加100 μL浓度为0.1%的破膜工作液,室温孵育10 min后PBS冲洗,一抗覆盖组织,爬片置于冰箱内4°C孵育过夜。次日取出爬片后PBS冲洗3次,去除PBS后滴加与一抗相应种属的二抗,避光室温孵育50 min后,PBS冲洗。滴加DAPI染液,室温下避光孵育10 min,PBS冲洗后稍甩干,将有细胞的一面朝下用抗荧光淬灭封片剂将玻片封固在载玻片上封片。采用全自动图像分析系统NIS-elements F3.2对阳性染色进行分析,测定VCAM-1阳性表达的平均吸光度值(OD),随机选取5个高倍视野,测定阳性表达的吸光度值,取平均值反映VCAM-1的表达。
1.7 Western blot法 每组取5个培养瓶,收集细胞,检测β-arrestin-1表达。采用蛋白抽提试剂提取蛋白。取40 μg蛋白,上样进行SDS-PAGE蛋白电泳,分离的蛋白随后转印至PVDF膜,膜在封闭液中(5%脱脂奶粉溶于PBS缓冲液-0.05 %Tween 20)室温作用1 h封阻非特异性结合。再分别加入β-arrestin-1一抗和β-actin一抗,4 ℃孵育过夜,用TBST 漂洗滤膜3次,每次5 min后,加入二抗HRP-羊抗兔IgG,于室温平缓摇动孵育30min,用TBST 漂洗滤膜3 次,每次5 min,进行增强化学发光反应。采用Alpha Ease FC分析软件处理系统分析目标带的光密度值。
1.8 实时荧光定量PCR检测β-arrestin-1 mRNA表达 主要步骤包括采用Trizol提取总RNA、逆转录合成cDNA及实时荧光定量PCR。β-arrestin-1上游引物:CCAACAACACCAACAAGACGG,下游引物:CGCTTCTCTCGGTTATTGGC,扩增片段长度193 bp。内参β-actin上游引物:GTCCACCGCAAATGCTTCTA,下游引物:TGCTGTCACCTTCACCGTTC,扩增片段长度190 bp。PCR反应体系:2× qPCR Mix:12.5 μL,2.5 μmol/L内标引物:2.0 μL,反转录产物:2.0 μL,ddH2O:8.5 μL。反应条件:95 ℃预变性1 min,95 ℃预变性15 s,58 ℃退火20 s,72 ℃延伸20 s,共进行40个循环,然后72 ℃延伸5 min。PCR完成后,在ABI Prism SDS 2.0软件上行自动分析,导出相应的循环阈值,采用2-△△CT值作为β-arrestin-1 mRNA的相对表达量。
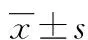
2 结 果
2.1 各组细胞肌动蛋白骨架变化的比较 免疫荧光共聚焦的图片显示,A组可见排列紊乱的肌动蛋白有断裂和不连续显示,且无围绕蓝色细胞核的丝状足。而给予盐酸戊乙奎醚预处理的B组情况有所改善。与C组比较,给予盐酸戊乙奎醚预处理的D组肌动蛋白的连续性和断裂情况相对较轻。与A组比较,C组肌动蛋白的连续性和断裂情况减轻;与B组比较,D组肌动蛋白的连续性和断裂情况减轻(图1)。
2.2 各组细胞LDH水平和VCAM-1蛋白表达的比较 与A组比较,B组LDH水平和VCAM-1蛋白表达降低;与C组比较,D组LDH水平和VCAM-1蛋白表达降低;与A组比较,C组LDH水平和VCAM-1蛋白表达降低;与B组比较,D组LDH水平和VCAM-1蛋白表达降低(表1)。
2.3 各组细胞β-arrestin-1蛋白和mRNA表达的比较 与A组比较,B组β-arrestin-1蛋白和mRNA表达升高;与C组比较,D组β-arrestin-1蛋白和mRNA表达升高;与A组比较,C组β-arrestin-1蛋白和mRNA表达无明显改变;与B组比较,D组β-arrestin-1蛋白和mRNA表达无明显改变(图2、表1)。

表1 各组细胞LDH水平、VCAM-1和β-arrestin-1表达的比较

续表1 各组细胞LDH水平、VCAM-1和β-arrestin-1表达的比较
b:P<0.01,与A组比较;c:P<0.05,d:P<0.01,与B组比较;e:P<0.01,与C组比较。
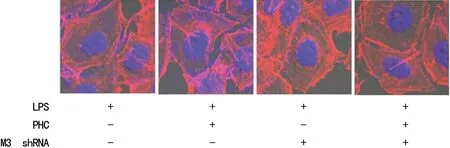
图1 各组细胞肌动蛋白骨架变化的比较

图2 各组细胞β-arrestin-1蛋白表达的比较
3 讨 论
LDH正常情况下存在于细胞内,但在细胞膜受损伤而通透性增加时,可通过受损的细胞膜释放出来,通过检测其水平高低能够较好的反映细胞受损程度[5]。VCAM-1为细胞黏附分子中的免疫球蛋白超家族成员,介导了中性粒细胞与内皮细胞的黏附激活并诱导炎性介质的产生,是肺微血管内皮细胞损伤发生发展的分子标志[6]。盐酸戊乙奎醚是新型的选择性抗M1、M3受体型抗胆碱药,对中枢和外周均有很强的抗胆碱作用,可作用于细胞生物膜胆碱受体,通过G蛋白耦联环节,改变细胞内第二信使的浓度,减轻炎性因子、黏附分子及趋化分子的合成、释放,抑制有害介质对组织及细胞的损伤[7]。本研究利用LPS与肺微血管内皮细胞共同孵育,结果表明,与A组比较,B组LDH水平和VCAM-1蛋白表达降低,提示盐酸戊乙奎醚可以减轻LPS引起的肺微血管内皮细胞损伤。
β-arrestins主要包括β-arrestin-1和β-arrestin-2,是GPCR信号通路重要的接头和支架蛋白[8]。在本研究中,预先给予盐酸戊乙奎醚2 μg/mL后LDH水平和VCAM-1蛋白表达明显降低,而β-arrestin-1表达升高,提示盐酸戊乙奎醚可通过上调β-arrestin-1表达从而降低LPS导致的肺微血管内皮细胞损伤。
毒蕈碱样胆碱能受体(M受体)是膜受体家族的成员,通过与异三聚体鸟苷酸结合蛋白(G蛋白)耦联介导信号转导过程,因此又称G蛋白耦联受体(GPCRs)[9]。而β-arrestins可以识别并结合磷酸化的毒蕈碱受体,阻断毒蕈碱受体与G蛋白之间的相互作用,从而阻断毒蕈碱受体介导的信号转导通路[10]。本实验中,相对于其他3组细胞,D组肌动蛋白骨架排列改善最明显,LDH水平和VCAM-1蛋白表达水平最低,可能是由于毒蕈碱M3受体表达被抑制,从而使LPS引起这些指标变化的程度减轻,而又累加上盐酸戊乙奎醚对这些指标的改善作用,因此D组表现的减轻内皮细胞损伤的作用最为明显。而与B组相比较,D组β-arrestin-1表达无明显改变,证明盐酸戊乙奎醚调节β-arrestin-1的机制与M3受体并无直接联系。
综上所述,M3受体在盐酸戊乙奎醚减轻LPS导致的肺微血管内皮细胞损伤中发挥着重要作用,沉默M3受体有助于降低LPS诱导的肺微血管内皮细胞损伤。但盐酸戊乙奎醚上调β-arrestin-1的作用与毒蕈碱受体M3的存在无必然联系。这种作用是否与毒蕈碱受体其他亚型相关,还有待进一步研究。
[1]Machado FR,Mazza BF.Improving mortality in sepsis:analysis of clinical trials [J].Shock,2010,34(1):54-58.
[2]Cribbs SK,Matthay MA,Martin GS.Stem cells in sepsis and acute lung injury [J].Crit Care Med,2010,38(12):2379-2385.
[3]Chen H,Bai C,Wang X.The value of the lipopolysaccharide-induced acute lung injury model in respiratory medicine [J].Exp Rev Res Med,2010,4(6):773-783.
[4]詹佳,李进杰,肖飞,等.盐酸戊乙奎醚预先给药对脓毒症小鼠急性肺损伤时β-抑制蛋白-1表达的影响 [J].中华麻醉学杂志,2013,33(4):499-501.
[5]Li Y,Xiang M,Yuan Y,et al.Hemorrhagic shock augments lung endothelial cell activation:role of temporal alterations of TLR4 and TLR2 [J].Am J Physiol Regul Integr Comp Physiol,2009,297(6):1670-1680.
[6]Distasi MR,Ley K.Opening the flood-gates:how neutrophil-endothelial interactions regulate permeability [J].Trends Immunol,2009,30(11):547-556.
[7]Li BQ,Sun HC,Nie SN,et al.Effect of penehyclidine hydrochloride on patients with acute lung injury and its mechanisms [J].Chin J Traumatol,2010,13(6):329-335.
[8]刘毅,向旭东.β-抑制蛋白及其研究进展 [J/CD].中华哮喘杂志(电子版),2011,5(3):208-212.
[9] Ishii M,Kurachi Y.Muscarinic acetylcholine receptors [J].Curr Pharm Des,2006,12(28):3573-3581.
[10]Van Koppen CJ,Kaiser B.Regulation of muscarinic acetylcholine receptor signaling [J].Pharmacol Ther,2003,98(2):197-220.
Role of M3 receptor in the effect of penehyclidine hydrochloride up-regulating β-arrestin-1 expression*
Cheng Bin,Wang Yipeng,Zhan Jia△
(Department of Anesthesiology,Zhongnan Hospital of Wuhan University,Wuhan,Hubei,430071,China)
[Abstract] Objective To investigate the role of M3 receptor in the effect of penehyclidine hydrochloride(PHC) upregulating β-arrestin-1 expression in lipopolysaccharide(LPS)-induced human pulmonary microvascular endothelial cell(HPMVEC) injury.Methods .M3 shRNA transfected HPMVEC and normal HPMVEC cells were randomly divided into LPS group(A),LPS+PHC group(B),LPS+ M3 shRNA transfection group(C) and PHC+LPS+M3 shRNA transfection group(D).The cytoskeleton change was observed by laser scanning confocal.The LDH level in cellular supernate was detected.The VCAM-1 protein expression was examined by immunofluorescence chemistry.β-arrestin-1 protein expression was determined by Western blot and β-arrestin-1mRNA expression was measured by real-time PCR.Results Compared with the group A or C,F-actin cytoskeleton arrangement in the group B or D was neat,the LDH level and VCAM-1 protein expression were decreased,and β-arrestin-1 expression was increased;compared with group A or B,F-actin cytoskeleton arrangement in the group C or D was neat,the LDH level and VCAM-1 protein expression were decreased,while the β-arrestin-1 expression had no obvious change.Conclusion Silence M3 receptor is conducive to reduce LPS-induced HPMVEC injury.But the role of PHC up-regulating β-arrestin-1 expression has no necessary connection with M3 receptor.
M3 receptor;penehyclidine hydrochloride;β-arrestin-1;shRNA
10.3969/j.issn.1671-8348.2017.13.007
国家自然科学基金青年基金项目(81101408);湖北省武汉市科技局晨光计划项目(2016070204010150)。 作者简介:程斌(1970-),大专,主管护师,主要从事临床麻醉药物的研究。△
,E-mail:jia19811001@163.com。
R979.3
A
1671-8348(2017)13-1750-03
2016-11-23
2017-01-11)
