3岁以下喘息患儿肠道主要微生物变化研究
2017-06-05曹向可钱庆增刘海燕
曹向可,钱庆增,王 维,刘海燕△
(1.华北理工大学生命科学学院,河北唐山 063000;2.华北理工大学公共卫生学院,河北唐山 063000;3.唐山市妇幼保健院儿科,河北唐山 063000)
·经验交流·
3岁以下喘息患儿肠道主要微生物变化研究
曹向可1,钱庆增2,王 维3,刘海燕2△
(1.华北理工大学生命科学学院,河北唐山 063000;2.华北理工大学公共卫生学院,河北唐山 063000;3.唐山市妇幼保健院儿科,河北唐山 063000)
目的 探讨3岁以下喘息患儿肠道主要微生物变化,分析病理机制。方法 选取唐山妇幼保健院2013年10月至2015年4月诊治的3岁以下喘息患儿143例为观察组,同期健康体检儿童143例为对照组,均行肠道菌群检测、T淋巴细胞检测、炎症因子检测、细胞因子检测。结果 观察组双歧杆菌、B/E值、CD4+、CD8+、CD4+/CD8+、转化生长因子-β1(TGF-β1)低于对照组(P<0.05)。观察组大肠杆菌、白细胞介素(IL)-17、C反应蛋白、白细胞计数高于对照组(P<0.05)。双歧杆菌、B/E值与CD4+、CD8+、CD4+/CD8+、TGF-β1呈明显正相关性。双歧杆菌、B/E值与IL-17、C反应蛋白、白细胞计数呈明显负相关性。大肠杆菌与CD4+、CD8+、CD4+/CD8+、TGF-β1呈明显负相关性。大肠杆菌与IL-17、C反应蛋白、白细胞计数呈明显正相关性。结论 3岁以下喘息患儿肠道菌群有改变,双歧杆菌减少,大肠杆菌增加,可能与免疫功能、炎症反应有关。
喘息;肠道菌群;免疫功能;炎症
喘息是婴幼儿的常见病和多发病,85%患儿为3岁前发病[1-2],如果不能给予患儿及时有效的临床治疗,将有可能发展为支气管哮喘,而影响到患儿预后。近年来,流行病学研究显示[3-4],喘息在婴幼儿期的发病率显著增加,该状况亟待改观。但喘息的病因和机制较为复杂,临床治疗难度较大,因而及早弄清相关的发病机理至关重要,因此开展此次研究。对3岁以下喘息患儿143例与健康体检儿童143例行肠道菌群检测、T淋巴细胞检测、炎症因子检测、细胞因子检测,从多个方面分析并探讨3岁以下喘息患儿肠道主要微生物变化,研究病理机制,现报道如下。
1 资料与方法
1.1 一般资料 唐山妇幼保健院2013年10月至2015年4月诊治的3岁以下喘息患儿143例为观察组,均符合喘息的临床标准[5],入选标准:近6个月内无呼吸道和消化道感染史,无个人及家庭过敏性疾患和其他变态反应性疾病史,患儿可良好配合,研究取得家属同意,签订知情同意书,经医院伦理委员会通过。排除标准:入院前2周使用糖皮质激素、免疫调节剂、抗组胺药、抗生素的患儿,原发性或继发性免疫功能缺陷、活动性肺结核、肺实质发育异常、胃食管反流、先天性气道疾病的患儿,近2个月内发生腹泻或使用益生菌制剂的患儿。男82例,女61例;年龄为1~3(1.9±0.7)岁;体质量为8.3~17.9(13.6±4.0)kg。同期健康体检儿童143例为对照组,男80例,女63例;年龄为1~3(1.8±0.6)岁;体质量为8.1~17.6(13.2±3.1)kg。两组年龄、性别、体质量比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 肠道菌群检测 将新鲜粪便0.5 g加入到无菌氯化钠溶液中,使用法国生物梅里埃公司生产的ATB半自动微生物鉴定系统进行细菌鉴定,菌种包括双歧杆菌、大肠杆菌,以每1 g粪便湿重中菌落形成单位数的对数值表示1 g CFU/g。
1.2.2 T淋巴细胞检测 抽取空腹静脉血2 mL,加入到肝素抗凝管中,采用ELISA法测定外周血T淋巴细胞亚群,指标包括CD4+、CD8+、CD4+/ CD8+。试剂盒购于上海巍樊生物科技有限公司,严格按照说明书操作。
1.2.3 炎症因子检测 抽取空腹静脉血2 mL,加入到肝素抗凝管中,采用ELISA法测定炎症因子,指标包括白细胞介素(IL)-17、C反应蛋白,试剂盒购于上海前尘生物科技有限公司,严格按照说明书操作。同时行生化指标检测,记录白细胞计数。
1.2.4 细胞因子检测 抽取空腹静脉血2 mL,加入到肝素抗凝管中,采用酶联免疫吸附法检测转化生长因子-β1(TGF-β1),试剂盒购于武汉博士德生物工程有限公司,严格按照说明书操作。

2 结 果
2.1 两组肠道菌群检测结果比较 观察组双歧杆菌、双歧杆菌与大肠杆菌比值(B/E值)低于对照组(P<0.05)。观察组大肠杆菌高于对照组(P<0.05),见表1。
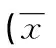
表1 两组肠道菌群检测结果比较±s)
2.2 两组T淋巴细胞检测结果比较 观察组CD4+、CD8+、CD4+/ CD8+低于对照组(P<0.05),见表2。
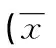
表2 两组T淋巴细胞检测结果比较±s)
2.3 两组炎症因子与细胞因子检测结果比较 观察组IL-17、C反应蛋白、白细胞计数高于对照组(P<0.05)。观察组TGF-β1低于对照组(P<0.05),见表3。
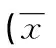
表3 两组炎症因子与细胞因子检测结果比较±s)
2.4 相关性分析 双歧杆菌、B/E值与CD4+、CD8+、CD4+/CD8+、TGF-β1呈明显正相关性。双歧杆菌、B/E值与IL-17、C反应蛋白、白细胞计数呈明显负相关性。大肠杆菌与CD4+、CD8+、CD4+/CD8+、TGF-β1呈明显负相关性。大肠杆菌与IL-17、C反应蛋白、白细胞计数呈明显正相关性,见表4。
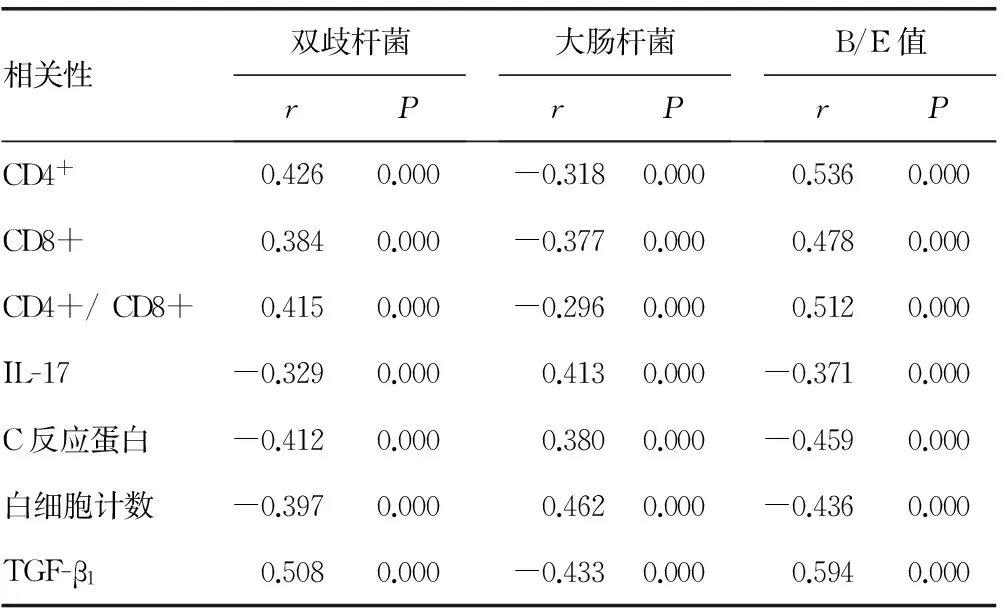
表4 相关性分析
3 讨 论
喘息是婴幼儿常见呼吸道疾病的一种,其病因多样,在感染因素中,病毒、细菌较为多见,也是儿童哮喘的早期表现,而近年来,喘息患儿数量明显增加,也是导致就医和住院的主要原因,该病严重影响着患儿的生存质量,而婴幼儿身体发育尚不健全,发生喘息的危险性较高[6-7],临床治疗也较为棘手,易形成反复喘息,长时间影响婴幼儿的健康发育,因而及早诊断和治疗至关重要。
诸多研究显示,喘息患儿体内多存在不同程度的肠道菌群失衡[8-9]。肠道含有大量微生物,其数量超过人体细胞数量的10倍[10-11],而肠道微生物群落超过500种,在宿主体内促进了营养物质的吸收,也促进了肠道黏膜免疫系统的发育,是肠道和免疫系统发育的重要刺激物。喘息患儿确实存在肠道菌群紊乱,分析如下:喘息发作时,患儿会出现明显的缺氧缺血状况,这将影响肠黏膜上皮细胞的紧密连接,使得肠黏膜通透性增加,而肠黏膜通透性增加会增加聚集在肠道内的病原微生物,其毒素也会直接导致肠黏膜受损,这将引起肠道细菌与内毒素移位,而喘息引起的应激状况,会让机体肠道内环境发生很大变化,这不利于肠道正常菌群的稳固定值,这些因素均会造成肠道微生态失衡。
双歧杆菌是一种厌氧革兰阳性杆菌,分布在胃肠的数量随年龄阶段的增长而减少,分布最多的是母乳营养儿,对婴幼儿有许多好处,如营养、免疫及抗感染作用,还具有调整肠道功能紊乱作用。大肠杆菌是寄生在人体大肠里对人体无害的一种单细胞生物,在机体免疫力降低、肠道长期缺乏刺激等特殊情况下,可引起感染,具有一定危险性。B/E值可以全面、简洁的反映肠道菌群的定植状况与肠道定植抗力情况,高于1,表示肠道定植抗力正常,小于1,表示肠道定植抗力降低。
喘息患儿的机体免疫能力降低,这与诸多研究结果是相似的。郝明明等[12]研究显示,喘息样支气管患儿发病初期即发生肠道菌群紊乱,肠道有益菌数量下降,且诱导免疫耐受失败。肠道菌群紊乱与免疫功能失衡间存在相互影响与制约关系,免疫耐受被打破贯穿疾病的整个病理过程。吴惠强等[13]研究显示,肺炎支原体感染后,通过刺激气道上皮慢性炎症、直接损伤呼吸道上皮细胞,导致气道高反应性,从而诱发喘鸣,且降低了机体免疫功能。本研究结果显示,喘息患儿的体内存在明显的炎症反应,TGF-β1也存在不同程度的改变。TGF-β对细胞的生长、分化和免疫功能都有重要的调节作用[14-15],还可发挥抑制免疫活性细胞的增殖、对细胞表型的调节、抑制淋巴细胞的分化、抑制细胞因子产生等作用。
综上所述,3岁以下喘息患儿肠道菌群有改变,双歧杆菌减少,大肠杆菌增加,可能与免疫功能、炎症反应有关。但此次研究也存在一定的弊端,样本量较少,需要进一步扩大样本量再进行探讨。随着免疫学和微生态学的发展,婴幼儿喘息复杂的免疫网络关系将会得到进一步研究。
[1]陈广道,陈爱欢.儿童肺炎支原体感染相关喘息的研究进展[J].中华儿科杂志,2012,50(10):756-759.
[2]金蕊,邱灵芝,袁文霄,等.反复喘息患儿外周血血清类黏蛋白1样蛋白3基因表达水平的意义[J].中华实用儿科临床杂志,2014,29(21):1618-1620.
[3]姚苗苗,王克明,许群英,等.婴幼儿喘息的病因及相关危险因素分析[J].中国当代儿科杂志,2011,13(3):195-198.
[4]徐艳娜,顾剑华,李永莲,等.反复喘息婴幼儿维生素D3水平及与Th1/Th2细胞平衡变化的相关性研究[J].中华实用儿科临床杂志,2015,30(4):264-266.
[5]胡亚美,江载芳.诸福堂实用儿科学[M].7版.北京:人民卫生出版社,2002:1172-1177.
[6]方骞,梁庆红,郝明明,等.喘息样支气管炎患儿肠道菌群变化与CD3+CD8-IL-17+细胞关系的研究[J].河北医科大学学报,2013,34(8):908-911.
[7]范飞,鲍一笑,华丽,等.婴幼儿喘息急性期联合降阶梯治疗方案中氯雷他定的作用[J].中华实用儿科临床杂志,2013,28(4):274-277.
[8]韩红.喘息急性发作期儿童肠道菌群变化与免疫耐受关系研究[D].石家庄:河北医科大学,2010.
[9]温玲.喘息急性发作期儿童肠道微生态学变化及Th9细胞作用机制的研究[D].石家庄:河北医科大学,2012.
[10]Yuan M,Shi DZ,Wang TY,et al.Transformation of trollioside and isoquercetin by human intestinal flora in vitro[J].Chin J Nat Med,2016,14(3):220-226.
[11]Yang XW,Wang N,Li W,et al.Biotransformation of 4,5-O-dicaffeoylquinic acid methyl ester by human intestinal flora and evaluation on their inhibition of NO production and antioxidant activity of the products[J].Food and Chemical Toxicology,2013,55(1):297-303.
[12]郝明明,张琳,方骞,等.喘息样支气管炎患儿肠道微生态变化与免疫耐受关系的研究[J].中国微生态学杂志,2013,25(3):303-305.
[13]吴惠强,陈惠敏.探析肺炎支原体感染合并喘息患儿的细胞及体液免疫功能的变化[J].中国医学工程,2015,23(4):45-46.
[14]Biancheri P,Giuffrida P,Docena GH,et al.The role of transforming growth factor(TGF)-β in modulating the immune response and fibrogenesis in the gut[J].Cytokine Growth Factor Rev,2014,25(1):45-55.
[15]Loubaki L,Chabot D,Bazin R.Involvement of the TNF-alpha/TGF-beta/IDO axis in IVIg-induced immune tolerance[J].Cytokine,2015,71(2):181-187.
曹向可(1982-),实验师,硕士,主要从事微生物研究。△
,E-mail:971421428@qq.com。
10.3969/j.issn.1671-8348.2017.10.032
R729
B
1671-8348(2017)10-1392-03
2017-01-26
2017-02-14)
