DHODH缺失对线粒体功能和成骨细胞分化成熟影响的研究*
2017-06-05方静娴刘河娣
方静娴,钱 虹,刘河娣,唐 翔
(1.南方医科大学口腔医院/广东省口腔医院儿童牙科,广州 510280;2.广州医科大学附属第二医院妇科,广州 510260)
论著·基础研究
DHODH缺失对线粒体功能和成骨细胞分化成熟影响的研究*
方静娴1,钱 虹1,刘河娣1,唐 翔2△
(1.南方医科大学口腔医院/广东省口腔医院儿童牙科,广州 510280;2.广州医科大学附属第二医院妇科,广州 510260)
目的 探讨二氧乳清酸脱氢酶(DHODH)缺失对线粒体功能和成骨细胞分化成熟的影响。方法 通过特异性小干扰RNA(siRNA)技术抑制小鼠胚胎成骨细胞前体细胞MC3T3-E1细胞中DHODH表达后,观察细胞增殖、三磷酸腺苷(ATP)产量及骨发育相关基因表达水平。结果 特异性siRNAs降低DHODH表达后,细胞增殖受抑制、细胞周期停滞于G1/S期。全细胞ATP产量,特别是线粒体来源的ATP减少。与对照组相比,DHODH 抑制组中Runt相关转录因子2(Runx2)及骨钙素(Ocn)的mRNAs表达量降低。结论 抑制DHODH蛋白影响成骨细胞的分化与成熟。成骨细胞中线粒体功能异常可能是导致米勒综合征骨发育异常的原因之一。
二氢乳清酸脱氢酶;线粒体;成骨细胞;米勒综合征
米勒综合征由二氢乳清酸脱氢酶(dihydroorotate dehydrogenase,DHODH)突变所致[1-3]。DHODH是嘧啶从头合成途径生物合成途径中惟一在线粒体内发生作用的限速酶[4-5]。线粒体产生三磷酸腺苷(ATP)并调节细胞生长、分化、凋亡以及其他多重代谢途径[5-6]。前期研究通过海拉(HeLa)细胞已证明,DHODH突变影响了线粒体功能进而影响了米勒综合征的病理发生[7-8]。然而,目前仍不清楚DHODH缺失如何最终导致米勒综合征的发生。米勒综合征的许多临床症状与骨发育相关,本研究采用成骨细胞前体细胞(MC3T3-E1),通过特殊小干扰RNAs(siRNAs)抑制DHODH,观察抑制后成骨细胞内和线粒体的变化,旨在探索成骨细胞中DHODH功能异常是否与米勒综合征发生相关。
1 材料与方法
1.1 细胞培养 小鼠头颅成骨细胞前体细胞,MC3T3E1细胞受赠于日本九州大学牙学院解剖教研室。MC3T3-E1细胞培养于包含10%热失活胎牛血清以及1%青霉素/链霉素的基本血清(ɑMEM)之中,置于5% CO2浓度的37 ℃细胞培养箱中。细胞长满续代时使用trypsin/EDTA(Gibco,Carlsbad,CA,美国),并将1×104细胞再植于含ɑMEM/10%胎牛血清(FBS)的24孔板中。
1.2 抗体及试剂 DHODH抗体受赠于日本九州大学医学院临床检查部分子生物学检查室。β-actin抗体购于美国Sigma cyclineB1,p53抗体购于美国Santa Cruz。细胞周期依赖蛋白激酶Cdk1/Cdc2(CDC2)以及磷酸化视网膜母细胞瘤(phospho-RB)抗体购于美国Cell Signaling。
1.3 方法
1.3.1 siRNAs法抑制蛋白表达 两组25 bp双链DHODHsiRNA订购于StealthSelectRNAi(Invitrogen,美国)。DHODH及对照组siRNA序列及转染方法参见文献[7]。
1.3.2 细胞增殖测定 为检测抑制DHODH后细胞增殖受影响情况,MC3T3E1细胞转染DHODH siRNA或对照组siRNA后以1×104浓度转入24孔板中培养,培养液含αMEM及透析10%FBS。每组重复3次。细胞培养至72 h,每日脱壁收集,用CoulterCounter(Beckman Coulter,美国)计数。
1.3.3 蛋白印记 MC3T3-E1细胞裂解于TNE裂解液[50 mmol/L三羟甲基氨基甲烷(Tris)/HCl,pH 7.5,1 mmol/L EDTA,150 mmol/L NaCl,0.5% Nonidet P-40]。每组上样20 ug蛋白于SDS电泳胶中,并用相应抗体进行免疫阻断。检测、分析方法及工具参见文献[7]。
1.3.4 ATP定量分析 细胞ATP产量通过ATP检测试剂盒测量,依照生产厂商使用说明(Promega,Madison,WI,美国)。细胞裂解于被动裂解液中(Promega)并以相同反应量加入反应中。裂解液中的发光量依照每份裂解液中所含蛋白量均化后检测计算。所得ATP值按线性标准曲线来确定。
1.3.5 RNA提取及RT-PCR分析 经DHODH siRNA转染72 h后,MC3T3E1细胞的RNA依照生产厂商使用说明通过Triziol试剂盒(Invitrogen)裂解收集。所有RNA均使用无核糖核酸酶的脱氧核糖核酸酶I(Promega)处理,并使用RNeasyKit(Qiagen,Mainz,德国)纯化。用1 μg RNA经ReverTraAce(Toyobo,Osaka,日本)合成cDNA后,用QuickTaq(Invitrogen)PCR扩增出小鼠Runt相关转录因子2(Runx2)、骨钙素(Ocn)以及3-磷酸甘油醛脱氢酶(Gapdh),再将PCR产物置于2%琼脂糖凝胶中电泳。电泳结果用溴化乙锭染色显影,基因表达状态用NIH image(http://rsb.info.nih.gov/nih-image/)定量。相关小鼠序列引物及PCR反应条件见表1。

2 结 果
2.1 干扰DHODH RNA后目标蛋白表达受影响 分别使用两种不同DHODH siRNA处理成骨细胞前体细胞72 h后,DHODH蛋白量在MC3T3E1细胞中生成量减少,而细胞内β-actin表达量并未受影响(图1A)。对照siRNA用以检测DHODH siRNA作用的特异性,在该组中并未检测到DHODH及β-actin表达量受到影响(图1A)。
2.2 抑制DHODH蛋白表达后细胞增殖受影响 每组处理后MC3T3E1细胞数值使用Coulter Counter (Beckman Coulter)计数,结果发现DHODH siRNA处理组中细胞增殖速度较对照组降低(图1B)。
2.3 抑制DHODH后对细胞周期的影响 在抑制DHODH表达后,CDC2,cyclineB1以及phospho-RB在MC3T3E1中的表达量有少量减少,而p53蛋白量少量增加,提示经DHODH siRNA处理后MC3T3E1细胞可能停滞于G1/S期(图1C)。
2.4 抑制DHODH后细胞及线粒体ATP产量减少 细胞转染处理后,不同DHODH siRNA组均显示较低的ATP产量,该现象在DHODH si#1组中尤为明显(图1D)。MC3T3E1细胞中DHODH si#1和si#2转染组中,源于线粒体的ATP产量显著较对照组低(图1D)。此外,经寡霉素(Oligomycin),线粒体氧化呼吸链复合体V抑制剂处理后,所有实验组中ATP产量均大大减低(图1D)。这些数据显示DHODH缺失可导致成骨细胞前体细胞中线粒体功能异常,而这也补充完善了基于HeLa细胞对米勒综合征的研究[7]。
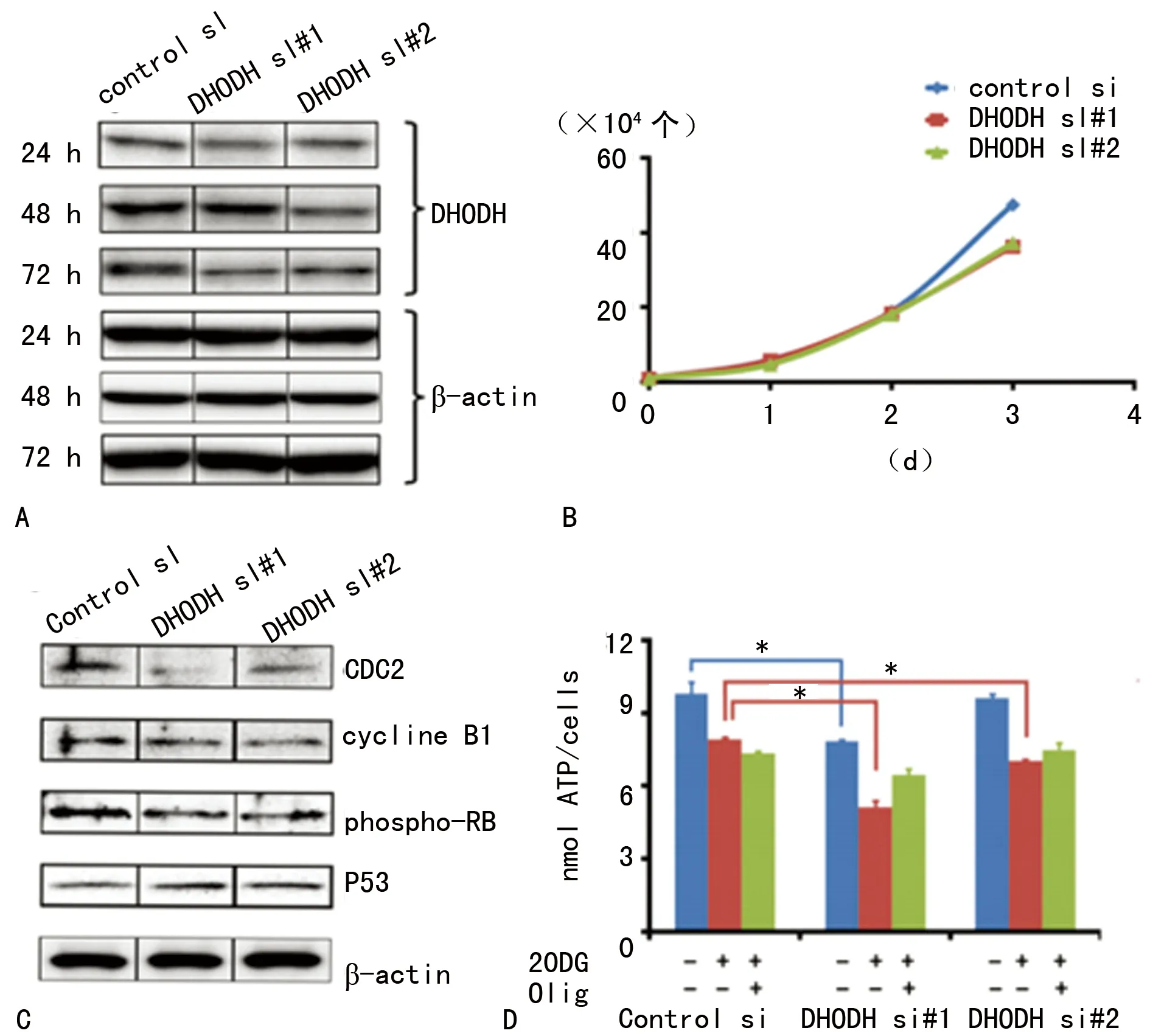
A:两种不同DHODH蛋白siRNA(DHODH si#1和DHODH si#2)转染MC3T3-E1细胞后DHODH蛋白表达量;B:siRNA转染后MC3T3-E1细胞增殖状况;C:转染DHODH siRNA 72 h后 MC3T3-E1细胞周期相关蛋白的表达情况;D:转染DHODH siRNA后MC3T3-E1细胞ATP产量变化情况;*:P<0.05。
图1 转染抑制DHODH表达后所产生的影响
2.5 成骨基因的表达 MC3T3E1细胞中DHODH表达受抑制后,Runx2及Ocn基因表达量均显著降低(图2),从而说明DHODH减少后正常骨形成过程受干扰。
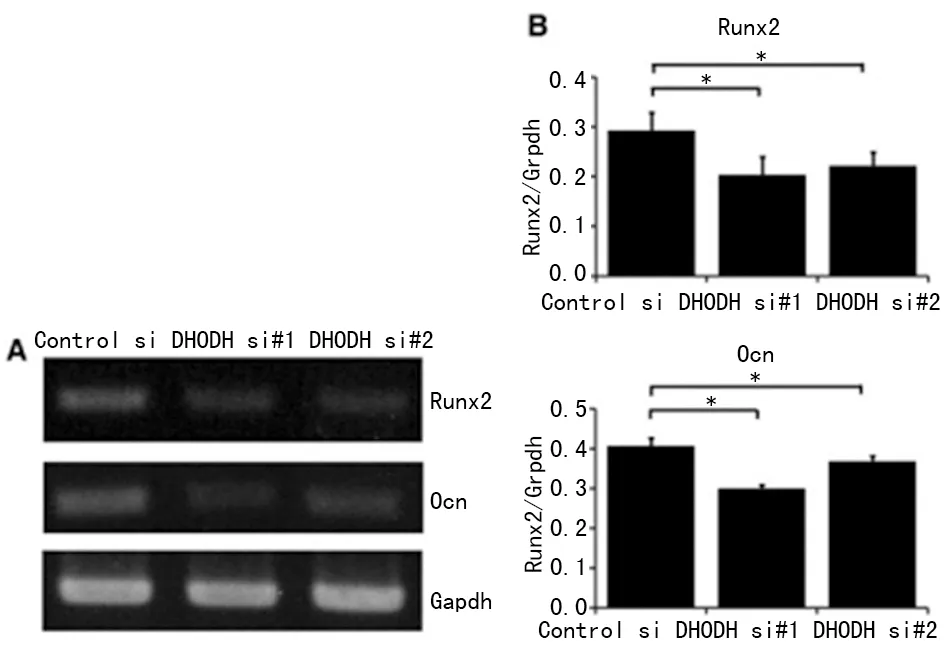
A:MC3T3E1细胞中DHODH表达受抑制后,Runx2及Ocn基因表达电泳结果;B:MC3T3E1细胞中DHODH表达受抑制后,Runx2及Ocn基因表达定量分析;*:P<0.05。
图2 相关成骨基因表达量
3 讨 论
DHODH是一种含铁的黄素依赖的线粒体酶,是核酸中嘧啶合成的关键酶,其作用是催化嘧啶从头生物合成途径中的第四步反应。DHODH是免疫相关疾病的重要靶点[9]。抑制DHODH,可以阻断新生嘧啶合成,致使DNA合成障碍,抑制活化的T淋巴细胞、B淋巴细胞以及肿瘤细胞的增殖,从而在免疫抑制和抗肿瘤中起重要作用。DHODH抑制剂来氟米特已经成功应用于自身免疫性疾病如红斑狼疮、类风湿性关节炎和肾病综合征等的临床治疗。另一种DHODH抑制剂布喹那已经分别完成了抗肿瘤和器官移植免疫抑制的Ⅱ期临床试验[10]。此外,嘧啶补救途径的缺失使疟原虫完全依赖于DHODH参与的嘧啶从头合成途径,因此对 DHODH 抑制剂敏感。 而人类细胞却可通过嘧啶补救途径获取维持细胞生长所需的嘧啶,故DHODH还是理想的抗疟药新靶点。
然而关于DHODH与骨发育的研究鲜有报道。基于米勒综合征的多项症状涉及骨骼发育,而DHODH又是该病的致病基因,所以本研究将抑制DHODH后成骨细胞前体细胞相关变化作为研究内容。米勒综合征是常染色体隐性遗传或伴发复合杂合型突变[3]。目前认为DHODH突变是导致该疾病的致病原因[3],并阻断了米勒综合征患者胚胎发育中第一和第二鳃弓的发育[1-2]。米勒综合征由DHODH功能异常所致并与骨骼结构异常相关。作者前期研究中观察了源自宫颈癌的HeLa细胞中DHODH的功能[7-8],并发现在HeLa细胞中DHODH缺失可导致线粒体功能异常和细胞周期停止,从而推论出DHODH功能缺失导致线粒体功能障碍,对米勒综合征发生产生作用。尽管前期研究中,分析了DHODH在癌细胞中的功能,但其在涉及骨骼结构的细胞中所发挥的分子机制并没有被完全发现。
因此,在本研究中,通过使用成骨细胞前体细胞试图阐明DHODH在这些细胞中的作用并寻找米勒综合征的发病机制。合成ATP为细胞提供能量是线粒体的主要功能之一。DHODH是嘧啶合成途径中惟一定植于线粒体中的限速酶。而当尿苷磷酸合酶(UMPS),DHODH后续限速酶编码基因,突变时其所导致的临床表现型却与米勒综合征的临床表现不同。在MC3T3E1细胞,小鼠头颅成骨细胞前体细胞中,DHODH抑制组较对照组,细胞繁殖减缓,细胞内ATP产量,特别是线粒体来源ATP产量降低。明确了线粒体功能异常很可能导致米勒综合征中骨骼结构发育异常。
Runx2是转录因子,也是间充质干细胞分化成为成骨细胞的必须主基因。骨钙素由成骨细胞分泌并参与促进骨形成[11]。因此这些基因对于成骨细胞的分化与成熟发挥着重要作用。当MC3T3E1细胞中DHODH受抑制时,骨钙素基因的表达水平显著降低(图2)。本课题研究结果提示DHODH减少所引起的线粒体功能障碍可导致成骨细胞成熟过程停滞,而这有可能导致米勒综合征异常骨骼发育。
综上所述,本研究证明了DHODH缺失导致线粒体功能障碍,从而影响成骨细胞的细胞增殖和成骨基因表达。这提示了DHODH很有可能参与了成骨细胞的分化与成熟。因此,DHODH蛋白减少或缺失所引起的成骨细胞功能障碍有可能与米勒综合征的发生和临床症状相关。
颌面部骨发育障碍仅是米勒综合征发病机制的一个方面,若要进一步阐明米勒综合征发生分子机制,仍需从其他组织或细胞包括神经嵴细胞领域深入研究。
[1]Trainor PA,Andrews BT.Facial dysostoses:etiology,pathogenesis and management[J].Am J Med Genet C Semin Med Genet,2013,163 (4):283-294.
[2]Klement KA,Black JS,Denny AD.Versatility of distraction osteogenesis for the craniofacial skeleton[J].J Craniofac Surg,2016,27(3):565-570.
[3]Ng SB,Buckingham KJ,Lee C,et al.Exome sequencing identifies the cause of a mendelian disorder[J].Nat Genet,2010,42:30-35.
[4]Evans DR,Guy HI.Mammalian pyrimidine biosynthesis:fresh insights into an ancient pathway[J].J Biol Chem,2004,279:33035-33038.
[5]McBride HM,Neuspiel M,Wasiak S.Mitochondria:more than just a powerhouse[J].Curr Biol,2006,16:551-560.
[6]De Michele R,Carimi F,Frommer WB.Mitochondrial biosensors[J].Int J Biochem Cell Biol,2014,48:39-44.
[7]Fang J,Uchiumi T,Yagi M,et al.Dihydro-orotate dehydrogenase is physically associated with the respiratory complex and its loss leads to mitochondrial dysfunction[J].Biosci Rep,2013,33(2):e00021.
[8]Fang J,Uchiumi T,Yagi M,et al.Protein instability and functional defects caused by mutations of dihydro-orotate dehydrogenase in Miller syndrome patients[J].Biosci Rep,2012,32(6):631-639.
[9]Sykes DB,Kfoury YS,Mercier FE,et al.Inhibition of dihydroorotate dehydrogenase overcomes differentiation blockade in acute myeloid leukemia[J].Cell.2016,167(1):171-186.
[10]He T,Haapa-Paananen S,Kaminskyy VO,et al.Inhibition of the mitochondrial pyrimidine biosynthesis enzyme dihydroorotate dehydrogenase by doxorubicin and brequinar sensitizes cancer cells to TRAIL-induced apoptosis[J].Oncogene,2014,33(27):3538-3549.
[11]Valenti MT,Dalle Carbonare L,Mottes M.Osteogenic differentiation in healthy and pathological conditions[J].Int J Mol Sci,2016,27,18(1):41.
Study on effects of DHODH deficiency on mitochondrial function and differentiation and maturation in osteoblast cells*
FangJingxian1,QianHong1,LiuHedi1,TangXiang2△
(1.DepartmentofPediatricDentistry,StomatologicalHospital,SouthernMedicalUniversity/GuangdongProvincialStomatologicalHospital,Guangzhou,Guangdong510280,China;2.DepartmentofGynecology,SecondAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou,Guangdong510260,China)
Objective To observe the changes of the skeletal development related cells after dihydroorotate dehydrogenase (DHODH) deficiency.Methods The DHODH expression in MC3T3-E1 cells derived from mouse calvaria osteoblast precursor cells was inhibited by specific small interfering RNAs (siRNAs),and cell proliferation,ATP production and expression levels of bone-related genes were investigated in these cells.Results After reducing the DHODH expression by using specific siRNAs,cell proliferation was inhibited and cell cycle was arrested at G1/S stage.In addition,the ATP production was reduced in whole cells,especially in mitochondria.Furthermore,the expression levels of Runt-related transcription factor 2 (Runx2) and osteocalcin (Ocn) mRNAs in the DHODH inhibition group were decreased compared with the control group.Conclusion Inhibiting DHODH protein affects the differentiation and maturation of osteoblasts.The mitochondrial dysfunction in osteoblasts may be one of causes leading to the abnormal bone formation in Miller syndrome.
dihydroorotate dehydrogenase;mitochondria;osteoblast cells;Miller syndrome
10.3969/j.issn.1671-8348.2017.10.005
广东省自然科学基金资助项目(2015A030310105);广州市卫生局医药卫生科技项目(20161A011070);广州医科大学博士科研启动项目(2014C34)。 作者简介:方静娴(1983-),主治医师,博士,主要从事口腔内科学及口腔遗传病学基础与临床研究。△
,E-mail:21558034@qq.com。
R78
A
1671-8348(2017)10-1312-03
2016-11-11
2017-01-22)
