冠心病合并心力衰竭患者血清HO-1/CO系统水平变化及其意义*
2017-06-05李桂花张晓莉
秦 练,李桂花,王 忠,黄 钟,张晓莉
(1.石河子大学医学院第一附属医院急诊内科,新疆石河子 832008;2.石河子大学医学院第一附属医院心内二科,新疆石河子 832008;3.新疆陆军预备役师医院内科,新疆石河子 832008)
论著·临床研究
冠心病合并心力衰竭患者血清HO-1/CO系统水平变化及其意义*
秦 练1,李桂花1,王 忠2,黄 钟1,张晓莉3
(1.石河子大学医学院第一附属医院急诊内科,新疆石河子 832008;2.石河子大学医学院第一附属医院心内二科,新疆石河子 832008;3.新疆陆军预备役师医院内科,新疆石河子 832008)
目的 通过比较冠心病所致慢性心力衰竭患者及冠心病心功能正常患者血清血红素加氧酶-1(HO-1)及一氧化碳(CO)水平差异,进一步探讨HO-1/CO系统在慢性心力衰竭发病中的保护机制。方法 选择慢性心力衰竭患者91例作为观察组,以72例冠心病心功能正常患者作为对照组,采用双抗体酶联免疫吸附(ELISA)测定HO-1浓度,Chalmer S法检测血清CO浓度;通过心力衰竭调查表记录入两组病例一般临床资料,并进行肝肾功能、血脂、NT-proBNP、BNP及心脏超声心动图等检查。结果 观察组血清HO-1水平(8.13±0.27)ng/mL高于对照组(2.80±0.52)ng/mL;观察组CO水平(0.35±0.06)mg/L低于对照组(0.59±0.07)mg/L,差异均有统计学意义(P<0.01);观察组HO-1水平随心功能分级增高而逐渐增高(P<0.01),而CO水平随心功能分级增高而逐渐降低(P<0.01)。结论 慢性心力衰竭患者随着心力衰竭加重血清HO-1水平高表达,内源性CO因心力衰竭加重后消耗而逐渐降低。
心力衰竭;慢性病;血红素氧化酶(脱环);一氧化碳
心力衰竭 (heart failure,HF)是各种器质性心脏病的共同转归,目前全球心力衰竭患者的数量已高达2 250万,并且仍以每年200万的速度递增,且5年存活率与恶性肿瘤相仿。发展中国家心衰的流行病学特点与发达国家日益相近,如冠心病作为心衰的病因在我国显得越来越突出[1]。目前我国35~74岁成年人中心力衰竭患者在400万以上,北方地区患病率高于南方[2]。血红素加氧酶-1/一氧化碳(CO)系统(HO-1/CO)在心肌缺血再灌注损伤[3]、抑制心肌肥大[4]等方面均具有保护作用,其心脏保护机制可能通过抑制舒张血管、血小板聚集、抗血栓、抗炎及抑制心肌细胞凋亡[5]等方面实现。该系统逐渐成为研究热点并受到关注。回顾既往研究,对于慢性心力衰竭人群研究较少。本文通过检测新疆地区冠心病所致慢性心力衰竭患者血清HO-1及CO水平,比较两组差异,进一步探讨该系统在慢性心力衰竭发病中的保护机制及其意义。
1 资料与方法
1.1 一般资料 收集2014年11月至2015年11月于石河子大学医学院第一附属医院心内科、干部病房及急诊内科住院患者;选择慢性心力衰竭患者91例作为观察组,以72例冠心病心功能正常患者作为对照组,采用心力衰竭调查问卷记录入观察组及对照组一般临床资料及相关检查结果;同期于检验科完成肝肾功、血脂、NT-proBNP、BNP及超声心动图等检查;观察组91例,年龄(62.3±7.1)岁;男50例,女41例;对照组72例,年龄(61.4±9.1)岁;男38例,女34例。本研究通过本院伦理委员会审批(批准号:2014-68-01),患者及家属均已经签署知情同意书。
1.2 方法
1.2.1 纳入及排除标准
1.2.1.1 纳入标准 观察组严格2014年中国心力衰竭诊断和治疗指南标准入组[6]。(1)年龄范围在35~74岁,有明确冠心病病史的证据存在,表现典型的心力衰竭症状,心力衰竭病程大于或等于6个月;(2)超声心动图明确左室射血分数(LVEF)<50%;NT-proBNP:年龄小于50岁NT-proBNp浓度大于450 ng/L;年龄大于或等于50岁NT-proBNp浓度大于900 ng/L作为诊断标准;(3)NYHA心功能分级Ⅱ~Ⅳ级;(4)心电图提供既往心肌梗死(MI)、心室肥厚、广泛心肌损害及心律失常等信息。对照组:既往明确冠心病病史的证据存在,心功能正常患者。
1.2.1.2 排除标准 (1)确诊的心肌病、严重心脏瓣膜病、先天性心脏病、肺源性心脏病合并肺动脉高压患者;(2)诊断恶性肿瘤行放化疗患者;肝肾功能严重异常;重症感染患者;(3)长期大量吸烟戒烟时间小于6个月,CO中毒、心力衰竭合并心源性休克;近一年内新发脑出血、脑梗死行手术或静脉溶栓治疗患者。(4)入院前应用硝酸酯类、ACEI、ARB类药物停药时间小于2周患者;急性心力衰竭患者;长期口服避孕药女性。
1.2.2 研究方法
1.2.2.1 标本采集及生化指标检测 两组病例入院后药物治疗前隔夜禁食12 h,晨起空腹采静脉血10 mL分为两份,分别置于5 mL EDTA抗凝和普通离心管。将普通离心管中静脉血以3 000 r/min转速于4 ℃离心15 min,取上清液分装到EP管中,统一编号,于-80℃冰箱保存待测。全自动生化检测仪检测如下,总胆固醇(TC)<5.72 mmol/L,低密度脂蛋白胆固醇(LDL)<3.37 mmol/L,空腹血糖(GLU) 3.91~6.21 mmol/L,血肌酐(Scr)男:44~133 μmol/L;女:70~108 μmmol/L。指标均统一标准,并由同一检验人员同批完成检测。
1.2.2.2 采用NYHA心功能分级[6]、室壁运动积分指数(Wall motion score index,WMSI)评分系统评价心功能 通过WMSI评价心功能[7],采用用二维超声计算各节段所有分数之和除以被积分的心肌节段总数来获得:运动正常或亢进记1分,运动减弱2分,无运动3分,运动反向(收缩期矛盾运动)记4分,室壁瘤(舒张期变形)记5分。
1.2.2.3 HO-1及CO检测 (1)血清HO-1浓度检测: ELISA检测试剂盒(购自上海润裕生物科技有限公司),采用双抗体一步夹心法酶联免疫吸附法[8],石河子大学医学院第一附属医院中心实验室完成。(2)血清CO检测(石河子大学药学院药物分析实验室)应用ChalmerS法[9]。浓度计算公式如下,x=0.5为待测样本血清量。
HbCO(%)=(R-0.83)/0.003 83

2 结 果
2.1 两组一般临床指标比较 两组比较:Scr、GLU、TC、LDL-C水平差异无统计学意义(P>0.05);两组NT-proBNP、LVEF、WMSI水平比较差异有统计学意义(P<0.01),观察组两性别之间比较差异有统计学意义(P<0.05),见表1。
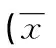
表1 观察组与对照组一般临床指标、HO-1及CO水平比较±s)
LVPW:左室后壁厚度;a:P<0.05,与同组男性比较;b:P<0.01,与观察组比较。
2.2 两组血清HO-1及CO水平比较 与对照组比较,观察组HO-1水平明显高于对照组(P<0.01),而CO水平明显低于对照组,差异有统计学意义(P<0.01)。
2.3 观察组心功能分级与血清HO-1及CO水平之间的关系 观察组HO-1水平与心功能分级呈正相关(r=0.902,P<0.01),而CO水平与心功能分级呈负相关(r=-0.731,P<0.01)。
3 讨 论
内源性CO主要来自于HO-1/CO系统中HO对血红素的分解,作为重要的细胞信号分子,CO通过激活可溶性cGMP,增加环鸟苷酸的合成发挥信使作用,在机体内可抑制血小板聚集、抗炎及抗氧化应激,并可通过K+-Ca2+通道[10]发挥血管舒张作用。国外研究认为,通过基因或药理作用诱导HO-1的表达对血管内皮均具有保护作用[11]。同时国内已有实验研究认为HO-1 /CO系统在心肌缺血再灌注损伤、抑制心肌肥大等方面均具有保护作用[12]。Duckers等[13]认为HO-1也具有抑制心肌增殖及重构的效应,以上研究均证明了HO-1/CO系统对心血管的保护作用,但对于心力衰竭人群其相关保护机制研究较少。课题组以冠心病所致慢性心力衰竭患者为研究对象,应用ELISA及Chalmer S法检测血清HO-1/CO浓度,通过实验观察到心力衰竭患者血清HO-1水平明显高于对照组,而血清CO水平低于对照组。
关于心力衰竭发病机制主要包括RASS系统过度激活;交感神经系统激活后血浆儿茶酚胺类物质浓度增高;心肌代谢及其重构;炎性反应导致心肌损伤等方面[14]。在缺氧、炎性反应、应激等条件下体内HO-1易被诱导产生[15]。同时有研究发现他汀类药物、质子泵抑制剂也可诱导HO-1高表达[16]。本研究也证实在慢性心力衰竭病例中HO-1水平高于对照组,可能由于心力衰竭的炎性反应、氧化应激、缺血缺氧及心肌细胞代谢异常等多种因素诱导HO-1表达增加,同时增加内源性CO浓度而发挥代偿机制,而内源性CO为发挥血管舒张、抑制血小板聚集及抗氧化应激等生理作用逐渐消耗,课题组亦发现CO水平心力衰竭加重而逐渐降低。
综上所述,随着研究不断深入,该系统或可成为心力衰竭诊断的重要临床标志物指导治疗,同时在心力衰竭治疗的特定阶段,对内源性HO-1/CO进行适度的增强表达。将该系统保护性生物学效应转化为临床治疗,对疾病预防和诊治具有重大意义。基于大量HO-1/CO系统的研究,将对新的药物研究领域的开发及应用奠定基础。
[1]中华医学会心血管病学分会.2007年中国慢性心力衰竭诊断和治疗指南[J].中华心血管病杂志,2007,35(12):1076-1096.
[2]杨毅宁,马依彤,刘芬,等.新疆汉、维吾尔、哈萨克族慢性心力衰竭流行病学调查及其患病率研究[J].中华心血管病杂志,2010,38(5):460-464.
[3]陈广琴,刘晨,张成喜,等.HO-1在AMPK抑制心肌肥大中的作用[J].中山大学学报(医学科学版),2010,31(5):614-618.
[4]殷慧群,周志泳,陈冬云,等.心肌缺血再灌注损伤与一氧化碳的关系及缺血预处理对其影响[J].皖南医学院学报,2004,23(1):9-12.
[5]马可,徐鑫荣,胡祖鹏,等.血红素加氧酶系统研究现状[J].中国病理生理杂志,2008,24(9):1865-1868.
[6]中华医学会心血管病学分会中华心血管病杂志编辑委员会.慢性心力衰竭诊断治疗指南[J].中华心血管病杂志,2007,42(12):1076-1095.
[7]Lang RM,Bierig M,Devereux RB,et al.Recommendations for chamber quantification:a report from the American Society of Echocardiography′s Guidelines and Standards Committee and the Chamber Quantification Writing Group,developed in conjunction with the European Association of Echocardiography,a branch of the European Society of Cardiology[J].J Am Soc Echocardiogr,2005,18(12):1440-1463.
[8]宋金郁,李慧,李玉姬,等.血红素加氧酶1在伴有糖尿病的人类冠状动脉粥样硬化病变中的表达[J].中国动脉硬化杂志,2011,19(3):241-245.
[9]邹晨,匡稀斌.原发性高血压患者血浆一氧化碳和硫化氢水平变化的临床意义[J].中华高血压杂志,2009,17(12):1113-1116.
[10]Duckles H,Boycott HE,Al-Owais MM,et al.Heme oxygenase-1 regulates cell prolife-ration via Carbon monoxide-mediated inhibition of T-type Ca2+channels[J].Eur J Physiol,2015,467(2):415-427.
[11]Hinkelmann U,Grosser N,Erdmann K,et al.Simvastatin-dependent up-regulation of heme oxygenase-1 via mRNA stabilization in human endothelial cells[J].Eur J Pharm Sci,2010,41(1):118-124.
[12]殷慧群,周志泳,陈冬云,等.心肌缺血再灌注损伤与一氧化碳的关系及缺血预处理对其影响[J].皖南医学院学报,2004,23(1):9-12.
[13]Duckers M,Boehm M,Tree AL,et al.Heme oxygenase-l protects against vascular constriction and proliferation[J].Nat Med,2010,7(6):693-698.
[14]黄岚,王江.心力衰竭发病机制的研究现状[J/CD].中华临床医师杂志(电子版),2013,7(11):4656-4659.
[15]庞天龙,曾仲.调控血红素加氧酶1的信号转导通路的研究进展[J].国际移植与血液净化杂志,2012,10(3):14-17.
[16]Schulz-Geske T,Erdmann K, Wong RJ.Molecular mechanismand lansoprazole- mediated hemeoxygenase-1 induction[J].World J Gastroenterol,2009,15(35):4392-4401.
Change and significance of serum HO-1/CO system level in patients with coronary heart disease complicating heart failure*
QinLian1,LiGuihua1,WangZhong2,HuangZhong1,ZhangXiaoli3
(1.DepartmentofEmergency;2.SecondDepartmentofCardiology,FirstAffiliatedHospital,MedicalCollegeofShiheziUniversity,Shihezi,Xinjiang832008,China;3.DepartmentofInternalMedicine,HospitalofArmyReserveDivision,Shihezi,Xinjiang832008,China)
Objective To compare the difference of serum heme oxygenase-1 (HO-1) and carbon monoxide(CO) levels between the patients with coronary heart disease(CHD) caused chronic heart failure(CHF) and CHD patients with normal cardiac function,and further to explore the protective mechanism of HO-1/CO system during the pathogenesis process of CHF.Methods Ninety-one patients with CHF were selected as the observation group and 72 CHD cases with normal cardiac function were taken as the control group.The concentration of HO-1 was determined by ELISA and the Chalmer S method was used to detect serum CO concentration.The general clinical data of the two groups were recorded by the using the heart failure questionnaire.And the liver and kidney functions,blood lipids,NT-proBNP,BNP and cardiac echocardiography examination were performed.Results The serum HO-1 level in the observation group was (8.13±0.27)ng/mL,which was higher than (2.80±0.52)ng/mL in the control group;the CO level in the observation group was (0.35±0.06)mg/L,which was lower than(0.59±0.07)mg/L in the control group,the difference was statistically significant(P<0.01);the HO-1 level in the observation group was gradually increased with the increase of cardiac function grade (P<0.01);while the CO level was decreased with the increase of cardiac function grade (P<0.01).Conclusion The serum HO-1level in the patients with CHF is highly expressed with the heart failure aggravation;endogenous CO is gradually decreased due to consumption after cardiac failure aggravation.
heart failure;chronic disease;heme oxygenase (decyclizing);nitric oxide
10.3969/j.issn.1671-8348.2017.10.014
石河子大学医学院第一附属医院院级科研项目(YL2014-R005)。 作者简介:秦练(1982-),主治医师,硕士,主要从事冠心病发病基础与临床的研究工作。
R541.6+1
A
1671-8348(2017)10-1343-03
2016-12-18
2017-02-04)
