血清Cys C在亚临床肝肾综合征中的诊断价值
2017-06-05张利利纪桂贤郝礼森高福来谢长顺崔红梅
张利利, 李 莉, 纪桂贤, 郝礼森, 高福来, 谢长顺, 崔红梅, 杨 梅
1.秦皇岛市第一医院消化内科, 河北 秦皇岛 066000; 2.华北理工大学附属医院消化科
血清Cys C在亚临床肝肾综合征中的诊断价值
张利利1, 李 莉1, 纪桂贤1, 郝礼森2, 高福来1, 谢长顺1, 崔红梅1, 杨 梅1
1.秦皇岛市第一医院消化内科, 河北 秦皇岛 066000; 2.华北理工大学附属医院消化科
目的 探讨肾功能正常肝硬化患者血清胱抑素C(Cys C)在亚临床肝肾综合征(hepatorenal syndrome, HRS)诊断中的价值。方法 选取2011年8月-2013年8月秦皇岛市第一医院住院的肝硬化患者90例,根据病因分组,采用生化仪检测血清Cys C、尿素氮(BUN)、血肌酐(SCr),彩色多普勒测量肾主动脉内径及肾动脉主干收缩期最大流速(PSV)、舒张末期血流速度(EDV),并计算出肾动脉阻力指数(RI),分析不同组患者血清Cys C与肾动脉RI相关性。结果 肝硬化腹水组与肝硬化无腹水组、对照组比较,血清Cys C、肾动脉RI明显升高(P<0.05);肝硬化无腹水组与对照组比较,Cys C、肾动脉RI轻度升高,但差异无统计学意义(P>0.05)。不同病因肝硬化腹水患者血清Cys C及肾动脉血流动力学指标差异均无统计学意义(P>0.05)。肝硬化腹水患者血清Cys C与肾动脉RI呈正相关(P<0.05)。结论 血清Cys C可及早识别亚临床HRS,为HRS 的早期预防和治疗提供依据。
亚临床肝肾综合征;血清Cys C;肝硬化;肾血流动力学
目前国内外对肝肾综合征(hepatorenal syndrome, HRS)诊断标准比较明确,但对肝硬化腹水患者早期肾功能损伤(亚临床HRS)的诊断指标研究较少,且对不同病因肝硬化腹水患者肾功能早期损伤的对比研究较少。因此,本研究通过检测血肌酐(SCr)及尿素氮(BUN)正常的肝硬化患者血清胱抑素C(Cys C)及肾血流动力学指标,分析血清Cys C与肾动脉阻力指数(RI)之间的相关性,探讨血清Cys C联合肾动脉彩超在诊断与识别肝硬化腹水患者早期肾功能损伤的价值,为早期发现亚临床HRS、预防HRS的发生提供理论依据。
1 资料与方法
1.1 一般资料选取2011年8月-2013年8月秦皇岛市第一医院住院的肝硬化患者90例为研究对象,按腹部CT或彩超结果分为无腹水组和腹水组,其中无腹水组30例,男20例,女10例,年龄35~67岁,平均年龄(49.63±12.80)岁;腹水组60例,男42例,女18例,年龄37~70岁,平均年龄(52.31±11.24)岁。腹水组按病因不同进一步分为肝炎后肝硬化组、酒精性肝硬化组、其他病因肝硬化组。每组20例。
1.2 纳入及排除标准病例组纳入标准:(1)符合肝硬化诊断标准[经临床、实验室、影像学检查等确诊的肝硬化,符合全国高等学校教材《内科学》(第七版)中的肝硬化诊断标准]。(2) 常规肾功能检查正常。排除标准:(1)1周内发生消化道出血。(2)1周内使用过利尿剂、β受体阻滞剂或其他影响肾血流动力学的药物。(3)合并HRS[HRS诊断符合全国高等学校教材《内科学》(第七版)中的HRS诊断标准]。(4)合并心衰、糖尿病、高血压病及其他器质性肾脏疾病。选取同期在我院健康体检中心进行健康体检者30名作为对照组,男18名,女12名,年龄35~65岁,平均年龄(54.96±11.95)岁。
1.3 检测仪器惠普IU22及HD11彩色超声诊断仪(探头频率3.5 MHz),日立7170全自动生化分析仪。
1.4 方法受试者禁食水8 h,抽空腹静脉血,采用全自动生化分析仪检测血清Cys C、BUN、SCr,同时行腹部彩超检查,同一超声诊断医师检查,检查前患者静卧休息1 h,取侧卧位,将探头置于腋中线与腋后线之间,纵向扫描,取得肾脏标准冠状切面图像,显示肾门及肾窦,清晰显示肾动脉主干,测量肾主动脉内径,彩色血流显示肾动脉主干,嘱患者屏气,脉冲多普勒取样框置于肾主动脉内,夹角<60°,取样容积2 mm3,测量肾动脉主干收缩期最大流速(PSV)、舒张末期血流速度(EDV),并计算出肾动脉RI,RI=(PSV-EDV)/PSV。每位受试者每侧肾动脉测量3个多普勒谱,取平均值,测量左、右肾动脉血流参数,合并计算,取二者平均值作为每位受试者肾动脉主干血流参数。

示,多组间比较用单因素方差分析(One-way ANOVA),组间比较采用LSD检验,双变量间采用Pearson相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 三组血清Cys C、BUN、SCr比较肝硬化腹水组血清Cys C、BUN及SCr与肝硬化无腹水组及对照组相比,差异有统计学意义(P<0.001);肝硬化无腹水组血清Cys C、BUN、SCr略高于对照组,但差异无统计学意义(P>0.05,见表1)。

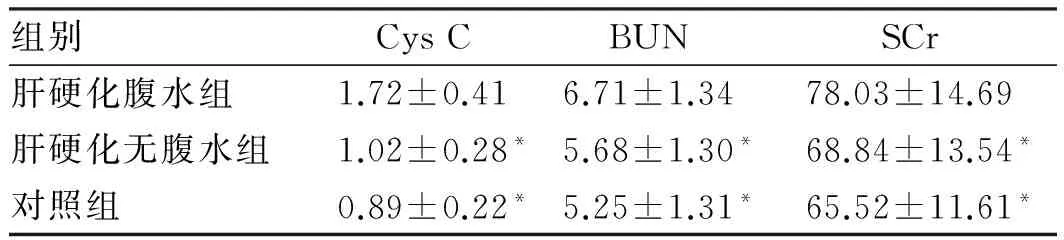
注:与肝硬化腹水组相比,*P<0.01。
2.2 三组肾动脉主干血流动力学比较肝硬化腹水组肾动脉内径、PSV、EDV、RI与肝硬化无腹水组及对照组相比,差异均有统计学意义(P<0.001);肝硬化无腹水组与对照组比较,肾动脉主干内径略减小,PSV无改变,EDV略减慢,肾动脉RI略升高,但差异无统计学意义(P>0.05,见表2)。

注:与肝硬化腹水组相比,*P<0.001。
2.3 不同病因肝硬化腹水组血清Cys C、BUN、SCr的比较肝炎后肝硬化组、酒精性肝硬化组及其他病因肝硬化组组间比较,血清Cys C、BUN、SCr差异无统计学意义(P>0.05,见表3)。
2.4 不同病因肝硬化腹水组肾动脉血流动力学指标比较肝炎后肝硬化组、酒精性肝硬化组及其他病因肝硬化组组间比较,肾动脉主干内径、PSV、EDV、RI差异无统计学意义(P>0.05,见表4)。
2.5 肝硬化腹水组血清Cys C与肾动脉RI之间的关系血清Cys C与肾动脉RI进行Pearson相关性分
析显示,血清Cys C与肾动脉RI呈正相关(r=0.862,P=0.000)。
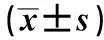
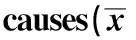

组别CysCBUNSCr肝炎后肝硬化组1.76±0.396.93±1.3579.91±14.49酒精性肝硬化组1.72±0.396.82±1.4377.49±15.94其他病因肝硬化组1.68±0.476.39±1.2576.67±14.14
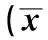

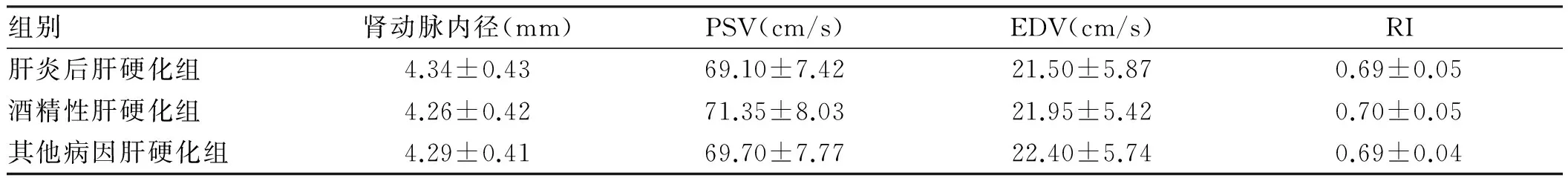
组别肾动脉内径(mm)PSV(cm/s)EDV(cm/s)RI肝炎后肝硬化组4.34±0.4369.10±7.4221.50±5.870.69±0.05酒精性肝硬化组4.26±0.4271.35±8.0321.95±5.420.70±0.05其他病因肝硬化组4.29±0.4169.70±7.7722.40±5.740.69±0.04
3 讨论
肝硬化时机体存在一系列系统和内脏的血流动力学改变。肝硬化患者肾脏血流呈低灌注、高阻型血流动力学特点。肝硬化失代偿期,由于门脉高压及大量腹水漏入腹腔,导致全身血流动力学改变,内脏动脉扩张及动静脉分流,有效循环血量不足,刺激交感神经及RAAS,引起肾动脉收缩,内径变小,肾血流阻力升高,同时由于肝功能损伤产生一些有毒物质,这些有毒物质的清除速度减慢,加重上述激素对肾血管的收缩作用,导致肾血流阻力进一步升高,肾灌注减少,最终导致肾血流减少和GFR下降,出现肾功能衰竭。研究[1]表明在肝硬化的早期阶段,当常规肾功能检查尚正常时就已经有了上述血流动力学改变。因此早期发现肾血流动力学改变,可及早发现肾功能损伤,对预防HRS发生有重要临床意义。
以往有大量研究致力于探讨可作为判断肝硬化患者早期肾功能损伤比较敏感的检查方法及指标,包括氨马脲酸清除率、肾动脉造影术、133氙洗出术等,但均为有创性检查,操作复杂,患者难以接受。近年来彩超在研究肾脏血流动力学方面得到广泛应用[2-4]。
Koda等[3]对健康人、慢性肝炎患者及肝硬化患者的肾动脉血流动力学改变进行了对比研究,发现肝硬化组的肾动脉RI明显高于对照组和慢性肝炎组,且随着肝功能Child-Pugh分级升高逐渐升高,但在慢性肝炎组和对照组之间肾RI则无明显差异。HRS多发生于伴有腹水的肝硬化患者,研究[5]显示,肾动脉RI升高在肝硬化肾功能衰竭伴腹水患者中,其敏感性和特异性分别为71%和80%,肾动脉RI与血浆醛固酮水平及肾素活性密切相关[6]。Rendón Unceta等[7]研究发现肝硬化合并腹水患者的肾动脉RI明显高于肝硬化无腹水患者,而后者又明显高于慢性肝炎组,顽固性腹水患者的肾动脉RI显著高于非顽固性腹水患者肾动脉RI。Hilborn等[8]研究表明肾皮质部血管的血流动力学改变是反映肾实质病变敏感的指标。Platt等[9]报道在临床诊断HRS之前已有肾脏血流动力学的改变,前瞻性研究发现:肝硬化患者平均肾动脉RI在出现HRS的患者中为0.77±0.05,而在未出现HRF的患者中平均肾动脉RI为0.67±0.07,表明RI是预测肝肾综合征的一个独立因素。
本研究显示肝硬化腹水组患者肾血管收缩,内径缩小,肾动脉收缩期峰值PSV、EDV减慢,且以EDV减慢为主,肾动脉RI 升高,而在肝硬化无腹水组虽有肾动脉轻度收缩,内径稍小,PSV、EDV轻度减慢,肾动脉RI轻度升高,但与对照组比较差异无统计学意义,对照组患者肾动脉内径、血流速度及肾动脉RI无明显改变,不同病因肝硬化腹水患者肾动脉内径、血流速度及肾动脉RI之间无显著差异,说明正常肾脏血管血流呈低阻力血流,随心动周期血流频谱波形在收缩期出现高峰,而在舒张期呈斜坡形下降并持续到下一个心动周期的开始,且没有反向血流的存在,阻力指数<0.70。而肝硬化腹水患者的肾动脉血流频谱呈低灌注高阻型特点,肾动脉明显收缩,虽在收缩期可出现高峰,但舒张期的成分减少,肾动脉RI升高,肾血流减少,出现肾功能早期损伤,说明肝硬化腹水患者存在亚临床HRS。同时说明在肝硬化腹水患者中存在肾动脉收缩、低灌注、血流阻力增大、肾血流减少的血流动力学变化。因此可以将肝硬化腹水患者视为亚临床HRS患者。相关研究[10]表明肾动脉RI可以客观评价动脉血管床的阻力并与器官血流灌注呈线性相关。本研究显示肝硬化腹水组患者较肝硬化无腹水组及对照组BUN、SCr虽有升高,但未超过正常范围,这与上述研究并不矛盾,说明肝硬化无腹水时虽然存在着血流动力学轻微改变,但这种改变尚能维持正常的肾血流量和GFR,不足以出现肾功能损伤,随着病情的发展,当出现腹水后,尤其是大量腹水后有效循环血量显著下降,在各种神经体液因素的综合作用下肾动脉显著收缩,肾灌注明显下降,血流阻力增大,肾动脉RI指数明显升高,GFR下降,当GFR>50 ml/min时,仅表现血清Cys C、尿微量白蛋白升高,BUN、SCr水平虽相应升高,但仍在正常值范围,如不给予有效的干预治疗,随着病情加重,动脉进一步收缩,肾灌注明显减少,GFR明显下降,<50 ml/min时,可出现BUN、SCr升高超过正常值,并发HRS。因此肾动脉RI能敏感反映肾血流动力学改变,反映GFR的下降,且不受肝硬化病因等因素的影响,可以成为判断亚临床HRS的指标。
血清Cys C是一种半胱氨酸蛋白酶抑制剂,几乎在所有组织恒定都可以持续转录及表达,生成的速率比较恒定[11],在炎症状态下也不会发生改变,并能够自由地通过肾小球滤过膜,它的水平高低主要由GFR决定[12],与性别、年龄、肌肉质量、胆红素、疾病状态等肾外因素无明显关系[13],是可以反映早期GFR变化的一个理想、可靠的内源性标志物[14]。
Grubb等[15]首先研究了血中低分子量蛋白质(β2-MG、SCr、Cys C)浓度倒数与GFR(51Cr-EDTA清除率)的相关性。Pergande等[16-18]用99mTc-DTPA清除率作为反映肾小球滤过功能的“金标准”(清除率<1.36 ml/s作为GFR受损的标志),分析Cys C、血SCr对诊断肾功能损伤的敏感性,分别为88.2%、52.9%。Kyhse-andersen等[19-20]临床研究也表明血清Cys C浓度与GFR的相关性明显优于血清SCr。
本研究表明血清Cys C在腹水组患者与无腹水组及对照组之间比较显著升高,但血BUN、SCr均在正常值范围,在肝硬化不同病因组无明显差异,表明在肝硬化腹水患者中已存在早期肾功能损伤,血清Cys C能够敏感地反映肾功能早期损伤,不受肝硬化病因因素影响。
本文相关性研究表明:正常人肾动脉RI<0.7,如RI≥0.7即说明肾动脉血流动力学发生了改变,肾血管阻力增加,PSV、EDV减慢,血流减慢,肾灌注减少,将导致GFR下降,出现肾功能早期损伤,也就是亚临床HRS,体现在血清Cys C开始升高,而此时血BUN、SCr水平仍在正常范围,因此可以将肝硬化腹水患者视为亚临床HRS患者。血清Cys C与肾动脉RI呈正相关。血清Cys C与肾动脉RI密切相关,说明肾动脉RI越高,肾血流减少越明显,血清Cys C升高越显著,肾功能损伤程度越大,因此与其他反映肾功能的指标相比,血清Cys 能更敏感地诊断肝硬化腹水患者亚临床HRS。
综上,肝硬化腹水患者在BUN、SCr升高之前即存在血流动力学改变及早期肾功能损伤,血清Cys C、肾动脉RI的变化从不同角度反映了肝硬化患者肾小球及肾小管的早期损伤,作为诊断肝硬化腹水患者亚临床HRS的指标,血清Cys C的检测方法简便,并且不受性别、年龄、肌肉状态、感染等肾外因素影响,不受肝硬化病因的影响,可以较好地反映GFR的改变,肾动脉RI可以敏感地检测到肾血流动力学的细微改变,因此可以作为诊断肝硬化腹水亚临床HRS的指标。
[1]Götzberger M, Kaiser C, Landauer N, et al. Intrarenal resistance index for the assessment of early renal function impairment in patients with liver cirrhosis [J]. Eur J Med Res, 2008, 13(8): 383-387.
[2]Esptein M, Berk DP, Hollenberg NK, et al. Renal failure in patients with cirrhosis: role of active vasoconstric-tion [J]. Am J Med, 1970, 49(2): 175-185.
[3]Koda M, Murawaki Y, Kawasaki H. Renovascular resistance assessed by color Doppler ultrasonography in patients with chronic liver diseases [J]. J Gastroenterol Hepatol, 2000, 15(12): 1424- 1429.
[4]Bardi A, Sapunar J, Oksenberg D, et al.Intrarenal arterial doppler ultrasonography in cirrhotic patients with ascites, with and without hepatorenal syndrome [J]. Rev Med Chil, 2002, 130(2): 173-180.
[5]Maroto A, Ginès A, Saló J, et al. Diagnosis of functional kidney failure of cirrhosis with Doppler sonography: prognostic value of resistive index [J]. Hepatology, 1994, 20(4 Pt 1): 839-844.
[6]Norris CS, Barnes RW. Renal artery flow velocity analysis: a sensitive measure of experimental and clinical renovascular resistance [J]. J Surg Res, 1984, 36(3): 230-236.
[7]Rendón Unceta P, Rojas Mangas A, Macías Rodríguez MA, et al. Doppler ultrasonography in the assessment of renal hemodynamics in patients with chronic liver disease [J]. Rev Esp Enferm Dig, 2000, 92(12): 799-805.
[8]Hilborn MD, Bude RO, Murphy KJ, et al. Renal transplant evaluation with Power Doppler sonography [J]. Br J Radiol, 1997, 70: 39-42.
[9]Platt JF, Ellis JH, Rubin JM, et al.Renal duplex Doppler ultrasonography: a noninvasive predictor of kidney dysfunction and hepatorenal failure inliver disease [J]. Hepatology, 1994, 20(2): 362-369.
[10]Norris CS, Barnes RW. Renal artery flow velocity analysis: a sensitive Measure of experimental and clinical renovascular resistance [J]. J Surg Res, 1984, 36(3): 230-236.
[11]连莲, 谷秀兰. 多种血清联合测定在糖尿病肾病中的应用[J]. 检验医学与临床, 2011, 8(21): 2565-2568. Lian L, Gu XL. The application of multi-surum combined detection of diabetic nephropathy [J]. Lab Med Clin, 2011, 8(21): 2565-2568.
[12]Adiyanti SS, Loho T. Acute kidey injury (AKI) biomarker [J]. Act amed Indones, 2012, 44(3): 246-255.
[13]魏建威, 郑登滋, 陈友. 血清胱抑素C测定的临床应用[J]. 实用医技杂志, 2007, 14(30): 4244-4245. Wei JW, Zheng DZ, Chen Y. The clinical application of serum cystatin C [J]. JPMT, 2007, 14(30): 4244-4245.
[14]钟培丽, 谢文波. 血清胱抑素C检测在临床中在肾功能损害中的临床意义[J]. 实用心脑肺血管病杂志, 2011, 19(2): 261-262. Zhong PL, Xie WB. The clinical application of Serum cystatin C in renal impairment [J]. PJCCPVD, 2011, 19(2): 261-262.
[15]Grubb A, Simonsen O, Sturfelt G, et al. Serum concentration of cystatin C, factor D and beta 2-microglobulin as a measure of glomerular filtration rate [J]. Acta Med Scand, 1985, 218(5): 499-503.
[16]Pergande M, Jung K. Sandwich enzyme immunoassay of cystatin C in serum with commercially available antibodies [J]. Clin Chem, 1993, 39(9): 1885-1890.
[17]Jung K, Jung M. Cystatin C: a promising marker of glomerular filtration rate to replace creatinine [J]. Nephron, 1995, 70(3): 370-371.
[18]Newman DJ, Thakkar H, Edwards RG, et al. Serum cystatin C measured by automated immunoassay: a more sensitive marker of changes in GFR than serum creatinine [J]. Kidney Int, 1995, 47(1): 312-318.
[19]Kyhse-Andersen J, Schmidt C, Nordin G, et al. Serum cystatin C, determined by a rapid, automated particle-enhanced turbidimetric method is a better marker than serum creatinine for glomerular filtration rate [J]. Clin Chem, 1994, 40(10): 1921-1926.
[20]Filler G, Witt I, Priem F, et al. Are cystatin C and beta 2-microglobulin better markers than serum creatinine for prediction of a normal glomerular filtration rate in pediatric subjects? [J]. Clin Chem, 2002, 1997, 43(6 Pt 1): 1077-1078.
(责任编辑:王全楚)
The value of serum Cys C in diagnosis of subclinical hepatorenal syndrome
ZHANG Lili1, LI Li1, JI Guixian1, HAO Lisen2, GAO Fulai1, XIE Changshun1, CUI Hongmei1, YANG Mei1
1.Department of Gastroenterology, the First Hospital of Qinhuangdao, Qinhuangdao 066000; 2.Department of Gastroenterology, Affiliated Hospital of North China University of Science and Technology, China
Objective To investigate clinical value of serum Cys C in diagnosis of subclinical hepatorenal syndrome.Methods From Aug. 2011 to Aug. 2013, 90 cirrhosis patients in the First Hospital of Qinhuangdao were chosen for the study. According to the clinical manifestations and causes grouping, serum Cys C, BUN and SCr were detected by biochemical analyzer, renal aorta inner diameter, renal artery trunk PSV, EDV were detected by Color Doppler, the renal artery RI, serum Cys C and renal artery RI correlation of different groups were analyzed.Results Compared with cirrhosis without ascites group and the control group, serum Cys C and renal artery RI were significantly increased in cirrhosis ascites group (P<0.05). Compared with control group, serum Cys C and renal artery RI were slightly increased in cirrhosis without ascites group, but had no significant difference (P>0.05). Among different causes of cirrhosis ascites patients, serum Cys C and renal artery RI had no significant difference (P>0.05). Serum Cys C and renal artery RI were positively correlated in cirrhosis. Conclusion Serum Cys C can identify subclinical HRS, provide the basis for the early prevention and treatment of HRS.
Subclinical hepatorenal syndrome; Serum Cys C; Cirrhosis; Hemodynam of renal
张利利,主治医师,研究方向:肝脏病学。E-mail:1024663598@qq.com
李莉,硕士,主任医师,研究方向:消化道疾病。 E-mail:zhangLL0059@163.com
10.3969/j.issn.1006-5709.2017.01.008
R575.2
A
1006-5709(2017)01-0025-04
2016-06-27
