miR-21通过PDCD4调控肝癌细胞的生长和侵袭
2017-06-05缪亚军王以浪
印 滇,杨 莉,张 亮,缪亚军,冯 秀,王以浪
miR-21通过PDCD4调控肝癌细胞的生长和侵袭
印 滇,杨 莉,张 亮,缪亚军,冯 秀,王以浪
目的 探讨miR-21在原发性肝细胞癌(hepatocellular carcinoma, HCC)组织和细胞中的表达及其可能调控的靶基因。方法 检测miR-21在HCC组织和细胞系中的表达,使用miR-21抑制剂后,观察HCC细胞活力和侵袭能力的变化;运用生物信息学分析预测miR-21可能的靶基因。应用miR-21抑制剂后,双荧光素酶报告基因系统检测其对靶基因活性的影响。结果 HCC组织中miR-21表达水平显著高于癌旁组织(P<0.05);HCC细胞中miR-21的表达水平显著高于肝细胞(P<0.01)。抑制miR-21后,HCC细胞的活力和侵袭能力降低(P<0.01)。抑癌基因程序性死亡因子4(programmed cell death 4, PDCD4)在HCC组织中的表达显著低于癌旁组织(P<0.01),在肝癌细胞中的表达水平显著低于肝细胞(P<0.01)。干扰PDCD4后,肝癌细胞的活力和侵袭能力提高(P<0.05)。双荧光素酶报告基因检测显示,使用miR-21抑制剂后,PDCD4表达上调(P<0.01),肝癌细胞的侵袭和增殖能力降低(P<0.01)。干扰PDCD4后,肝癌细胞的侵袭和增殖能力升高(P<0.001)。结论 miR-21可通过PDCD4调控肝癌细胞的生长和侵袭。
肝肿瘤;miR-21;PDCD4
原发性肝细胞癌(hepatocellular carcinoma, HCC)的病死率在全球恶性肿瘤中位居第3位,国内位居第2位。由于其侵袭性高,易肝内转移和复发,HCC患者预后一般较差,术后5年生存率通常不超过40%[1]。微小RNA(miRNA)是近年来发现的一类内源性单链非编码RNA,长17~25个核苷酸,以互补配对方式与靶基因的碱基结合。其与肿瘤的发生密切相关,在肿瘤发生过程中既可以扮演癌基因也可扮演抑癌基因的角色[2-3]。miR-21是miRNA中具有代表性的基因,通过多种途径抑制基因转录,发挥类似癌基因的作用,影响细胞的增殖、分化和凋亡等过程[4]。miR-21在外周血中可以稳定地存在,血清中高水平的miR-21往往提示预后不良[5]。目前已明确抑癌基因程序性死亡因子4(programmed cell death 4, PDCD4)是miR-21的靶基因之一。本文探讨miR-21在HCC组织和细胞中的表达,及其对PDCD4的调控作用。
1 材料与方法
1.1 材料 选取2015年6月~2016年6月南通市第一人民医院病理科存档的16例HCC组织,另取相应癌旁组织(距肿瘤病变5 cm以上,经HE染色证实无癌细胞浸润)作为对照组,术前患者均未接受肝动脉化疗栓塞治疗等治疗。16例患者年龄38~71岁,平均(45±3.3)岁;其中男性12例,女性4例。本实验标本采集经我院伦理委员会同意,患者均签署知情同意书。
1.2 方法
1.2.1 细胞培养 人肝细胞系THLE2和人肝癌细胞系HepG2、Huh7均购自中国科学院典型培养物保藏委员会细胞库。细胞培养于含10%胎牛血清(fetal bovine serum, FBS)的DEDM(Gibco公司)培养基,于37 ℃ 5%CO2培养箱中培养。
1.2.2 细胞转染 细胞转染前一天6孔培养板中接种适当数量的细胞,每孔加入2 mL不含抗生素的培养基,转染时的细胞密度达50%~60%。次日弃去6孔板中的旧培养基,用不含血清的Opti-MEMI培养基洗涤2次,每孔加入Opti-MEMI 1.5 mL。共同转染分为miR-21 inhibitor阴性对照+siRNA阴性对照组、miR-21 inhibitor+siRNA阴性对照组、miR-21 inhibitor+PDCD4 siRNA组。用250 μL不含血清培养基Opti-MEMI稀释10 μL siRNA、miR-21 inhibitor及其相应的阴性对照物,轻轻混匀,室温孵育5 min;用250 μL不含血清培养基Opti-MEMI稀释Lipofectamine 2000,轻轻混匀并室温孵育5 min,将稀释过的Lipofectamine 2000与上述稀释好的siRNA和miR-21 inhibitor轻轻混匀,室温孵育20 min使其充分混合。将制备好的转染试剂混合液加入含有HepG2细胞以及培养基的6孔培养板各孔中,轻轻混匀;将培养板置于37 ℃ 5%CO2培养箱中孵育,6~8 h后换液,72 h后检测PDCD4蛋白水平、细胞增殖和侵袭能力改变。
1.2.3 qRT-PCR 组织标本经液氮研磨,提取肝癌组织和癌旁组织中的总RNA,逆转录后得到cDNA,qRT-PCR使用7500实时定量PCR系统,PDCD4以β-actin作为内参。使用miR-21检测试剂盒(美国Applied Biosystems,ABI公司),按试剂盒说明书测定miR-21。引物序列为miR-21 F:5′-CTGCAGGGTCCGAGGT-3′;miR-21 R:5′-GCCGCTAGCTTACAGACTGATGT-3′。U6snRNA作为内参,引物序列为U6 F:5′-CTCGCTTCGGCAGCACA-3′;U6 R:5′-AACGCTTCACGAATTTGCGT-3′。PDCD4引物由上海生工公司合成,引物序列为PDCD4 F:5′-CCTGAATTAGCACTGGATACTCCT-3′,PDCD4 R:5′-CTAGCCTGCACACAATCTACAGTT-3′。
1.2.4 Western blot检测 转染后72 h,裂解HepG2、Huh7细胞,收集蛋白,样品使用10%SDS-PAGE分离,而后转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,加PDCD4一抗,4 ℃过夜,次日加二抗,histone 3作为内参,ECL法显色。
1.2.5 细胞活力检测 采用CCK-8法检测细胞活力,操作步骤按试剂盒说明书进行。细胞接种于96孔板,加入HepG2细胞。分别加入inhibitor阴性对照+siRNA阴性对照、miR-21 inhibitor+siRNA阴性对照、miR-21 inhibitor+siRNA PDCD4,48 h后,检测细胞活力。PDCD4干扰片段由上海拓然公司合成 。
1.2.6 细胞侵袭能力 细胞侵袭能力用Transwell试验检测。HepG2细胞以5×104/mL密度种植在24孔板上。下室加入400 μL 10%FBS。未穿过的细胞用棉球从膜的上方小心拭去。下方细胞用多聚甲醛固定,0.1%结晶紫染色,倒置显微镜计数。
1.2.7 双荧光素酶报告基因试验 根据生物信息学软件多种靶基因在线分析,预测miR-21可能的靶基因,并获取含有作用位点的片段序列。预测设计引物,扩增出包含有保守性结合位点的3′-UTR-WT和3′-UTR-MT,扩增产物行凝胶电泳,将目的基因切胶回收,再连接目的基因和载体,构建pGL3-PDCD4-3′-UTR和PDCD4-3′-UTR-MT载体,依次进行转化感受态菌、目的基因测序、质粒抽提,重组质粒转染HepG2、Huh7细胞,行双荧光素酶报告基因分析。

2 结果
2.1 miR-21在HCC组织和细胞系中的表达 qRT-PCR实验结果表明,miR-21在HCC组织中的表达水平显著高于癌旁组织(P<0.05)。miR-21在人肝癌细胞系HepG2、Huh7中的表达水平显著高于肝细胞系THLE2(P<0.01,图1)。

图1 qRT-PCR检测miR-21在肝组织和细胞系中的表达
A.HCC与癌旁组织中miR-21的表达,*P<0.05;B. miR-21在不同细胞系中的表达,**P<0.01
2.2 miR-21对HCC细胞活力和侵袭能力的影响 与对照组相比,使用miR-21抑制剂后,HepG2细胞的侵袭能力下降,Transwell穿过的细胞数目分别为120±5和46±8(P<0.01)。与对照组相比,miR-21抑制剂组HepG2细胞活力下降,CCK-8检测细胞的相对活力分别为1±0.02和 0.48±0.15(P<0.01,图2)。

图2 miR-21抑制剂处理对HepG2细胞活力和侵袭能力的影响
A.Transwell检测miR-21抑制剂处理对HepG2细胞侵袭功能的影响,**P<0.01;B.CCK-8检测miR-21抑制剂处理48 h对HepG2细胞活力的影响,**P<0.01
2.3 PDCD4在HCC组织和细胞系中的表达 Western blot检测结果显示,HCC组织中PDCD4表达水平显著低于癌旁组织(P<0.01)。HepG2、Huh7细胞中的PDCD4表达水平显著低于THLE2(P<0.01,图3)。
2.4 miR-21抑制剂对PDCD4表达的影响 使用miR-21抑制剂后,HepG2、Huh7中的PDCD4蛋白表达量明显升高(图4)。
2.5 荧光素酶报告基因检测 PDCD4-3′-UTR-WT共转染组,转染miR-21抑制剂后荧光素酶相对活性明显增加,与对照组及PDCD4-3′-UTR-MT组相比差异有统计学意义(P<0.01)。PDCD4-3′-UTR-MT组转染miR-21抑制剂后,荧光素酶活性与对照组相比,差异无统计学意义(P>0.05),表明PDCD4是miR-21的靶基因之一(图5)。
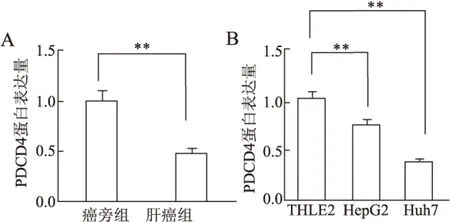
图3 miR-21对PDCD4的调控作用
A.Western blot检测PDCD4在组织中的表达,**P<0.01;B.Western blot检测PDCD4在细胞系中的表达,**P<0.01

图4 miR-21抑制剂对HepG2和Huh7细胞中PDCD4表达的影响1.anti-miR-N;2.anti-miR-21
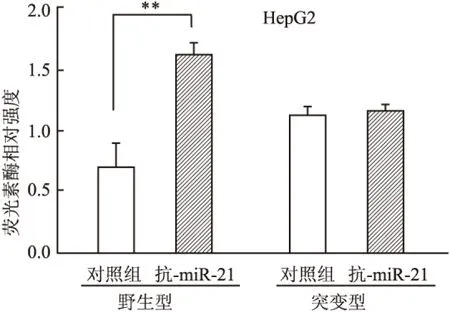
图5 双荧光素酶报告基因检测 **P<0.01
2.6 PDCD4介导miR-21对细胞活力和侵袭性的影响 使用miR-21抑制剂和siRNA-PDCD4处理HepG2细胞后,Transwell检测的miR-21抑制剂对照+siRNA对照组、miR-21抑制剂+siRNA对照组、miR-21抑制剂+siRNA-PDCD4 组穿过的细胞数目分别为183±2、76±5、231±3(P<0.01,P<0.001);CCK-8检测的三组细胞相对活力分别为1.0±0.1、0.48±0.08、1.47±0.23(P<0.01,P<0.001,图6)。这提示PDCD4介导了miR-21对细胞活力和侵袭能力的调控。

图6 Transwell和CCK-8检测miR-21抑制剂和siRNA PDCD4处理后对HepG2细胞侵袭能力和活力的影响
**P<0.01,***P<0.001
3 讨论
miRNAs通过与目标基因的mRNAs 3′UTR互补配对来抑制其蛋白表达,因此miRNAs介导调控肿瘤的发生、发展的途径可能有以下几种:与抑癌基因结合的miRNAs过表达或信号放大,与癌基因结合的miRNAs内源性丢失。尽管原发性肝癌的诊治技术近年来有所改善,但由于其易发生肝内外转移,肝癌的预后仍较差。因此,了解肝癌的发生和转移机制在恶性肿瘤的治疗中显得尤为重要。Medina等[6]的研究证实:miR-21是一种癌基因性质的RNA,一些肿瘤的生长对其有明显的依赖性。研究表明,miR-21在非小细胞肺癌、乳腺癌、胃癌等多种恶性肿瘤中过表达,可抑制靶基因的表达,与肿瘤细胞生长、增殖、侵袭转移等生物学行为密切相关。有研究表明miR-21高表达亦预示着乳腺癌、结肠癌患者预后不良。其在HCC组织中的水平是癌旁组织的近3倍,与HCC患者术后预后密切相关(HR=1.684 7)[7]。本实验亦证明miR-21在HCC组织中的表达水平比癌旁组织高,在肝癌细胞系中的表达水平比肝细胞系高,这与文献报道相一致。在肝癌细胞系HepG2中,通过转染化学合成的miR-21抑制剂,使miR-21低表达可抑制HepG2细胞的活力和侵袭能力,促进细胞凋亡。
PDCD4是AKT/PI3K/mTOR通路下游重要的靶点之一,研究发现其是一种新的抑癌基因。人的PDCD4基因定位于10q24,编码的蛋白约含469个氨基酸。大量研究发现PDCD4通过影响癌细胞的增殖、转移和抗凋亡能力发挥其抗肿瘤效应。Matsuhashi等[8]报道PDCD4是转化生长因子TGF-βl诱导HCC凋亡所必需的分子。Wei等[9]研究卵巢癌发现,PDCD4表达与肿瘤恶性程度和预后相关。Zhu等[10]研究124例肺癌组织中PDCD4的表达,发现有84例PDCD4表达下降或缺失。Zhang等[11]研究证实PDCD4抑制侵袭相关蛋白AKT和MAP4K1的表达和基因活性,增加转移抑制蛋白如E-cadherin和TIMP2的释放。
Sun等[12]研究证实PDCD4在转录后水平被miR-21负性调节,上调的miR-21和下调的PDCD4能促进头颈部鳞癌细胞的增殖;而转染miR-21抑制剂后能上调PDCD4的表达,减慢细胞的分化速率。miR-21通过其靶基因PTEN、PDCD4和RECK调控肝癌细胞转移。有研究证实,miR-21与PDCD4表达呈负相关。PDCD4低表达者肿瘤较大,易发生远处和淋巴结远转移[13]。提示miR-21可能通过抑制PDCD4的表达促进肿瘤生长和转移。miR-21可通过miR21-PDCD4-AP-1反馈环路促进HCC的侵袭和转移。
PDCD4基因3′端非翻译区有高保守的miR-21结合位点,研究发现在结直肠癌细胞中miR-21可下调PDCD4基因的表达,促进肿瘤细胞的侵袭及转移。本实验Western blot检测结果显示,肝癌组织中PDCD4表达水平显著低于癌旁组织。肝癌细胞HepG2、Huh7中的PDCD4表达水平显著低于肝细胞THLE2;抑制miR-21后,PDCD4 mRNA变化无差异,但PDCD4蛋白表达水平则明显增高,证明miR-21在转录后在蛋白水平调控PDCD4表达。本研究通过Target Scan软件分析得知miR-21强结合PDCD4的3′UTR,荧光素酶报告基因实验亦证实了肝癌中miR-21通过结合PDCD4 mRNA的3′UTR抑制其翻译表达。使用miR-21抑制剂处理HepG2细胞后,细胞活力和侵袭能力明显降低;干扰PDCD4基因后,能恢复miR-21对HepG2细胞活力和侵袭的促进作用,这一结果与其他肿瘤中的研究结果相一致。
综上所述,在肝癌中,miR-21和PDCD4表达呈负相关,miR-21通过抑制PDCD4表达,促进肝癌细胞的生长和侵袭。
[1] Aino H, Sumie S, Niizeki T,etal. Clinical characteristics and prognostic factors for advanced hepatocellular carcinoma with extrahepatic metastasis[J]. Mol Clin Oncol, 2014,2(3):393-398.
[2] Braconi C, Henry J C, Kogure T,etal. The role of microRNAs in human liver cancers[J]. Semin Oncol, 2011,38(6):752-763.
[3] Law P T, Wong N. Emerging roles of microRNA in the intracellular signaling networks of hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2011,26(3):437-449.
[4] Tüfekci K U, Meuwissen R L, Genc S. The role of microRNAs in biological processes[J]. Methods Mol Biol, 2014,1107:15-31.
[5] Wang W Y, Zhang H F, Wang L,etal. miR-21 expression predicts prognosis in hepatocellular carcinoma[J]. Clin Res Hepatol Gastroenterol, 2014,38(6):715-719.
[6] Medina P P, Nolde M, Slack F J. OncomiR addiction in an in vivo model of microRNA-21-induced pre-B-cell lymphoma[J]. Nature, 2010,467(7311):86-90.
[7] Schetter A J, Leung S Y, Sohn J J,etal. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J]. Jama, 2008,299(4):425-436.
[8] Matsuhashi S, Hamajima H, Xia J,etal. Control of a tumor suppressor PDCD4: degradation mechanisms of the protein in hepatocellular carcinoma cells[J]. Cell Signal, 2014,26(3):603-610.
[9] Wei N, Liu S S, Chan K K,etal. Tumour suppressive function and modulation of programmed cell death 4 (PDCD4) in ovarian cancer[J]. PLoS One, 2012,7(1):e30311.
[10] Zhu Q, Wang Z, Hu Y,etal. miR-21 promotes migration and invasion by the miR-21-PDCD4-AP-1 feedback loop in human hepatocellular carcinoma[J]. Oncol Rep, 2012,27(5):1660-1668.
[11] Zhang N, Duan W D, Leng J J,etal. STAT3 regulates the migration and invasion of a stem-like subpopulation through microRNA-21 and multiple targets in hepatocellular carcinoma[J]. Oncol Rep, 2015,33(3):1493-1498.
[12] Sun Z, Li S, Kaufmann A M,etal. miR-21 increases the programmed cell death 4 gene-regulated cell proliferation in head and neck squamous carcinoma cell lines[J]. Oncol Rep, 2014,32(5):2283-2289.
[13] Zhu S, Wu H, Wu F,etal. MicroRNA-21 targets tumor suppressor genes in invasion and metastasis[J]. Cell Res, 2008,18(3):350-359.
·简 讯·
敬告作者
作者收到编辑部的退修意见后,请按修改意见认真修改。稿件修改处宜采用不同颜色字体标识,以便编辑和审稿专家查看。修改完成后,请对专家审稿意见逐条说明修改情况,有异议者,可说明理由。
MiR-21 regulates the growth and invasion of liver cancer cells through PDCD4
YIN Dian, YANG Li, ZHANG Liang, MIU Ya-jun, FENG Xiu, WANG Yi-lang
(DepartmentofOncology,theFirstPeople’sHospitalofNantong,Nantong226001,China)
Purpose To evaluate the expression of miR-21 in the tissues and cell lines of hepatocellular carcinoma, and to try to find its possible target genes. Methods The expression profile of miR-21 was detected in hepatocellular carcinoma tissues and cell lines. After miR-21 inhibitor was used, the alterations in the vitality and invasion of hepatocellular carcinoma cells were observed. The possible target gene of miR-21 was predicted by bioinformatics analysis. The influence of miR-21 inhibitors on the target gene activity was evaluated by dual luciferase reporting gene system. Results The expression level of miR-21 was significantly higher in hepatocellular carcinoma tissues than that in the adjacent ones (P<0.05). The expression level of miR-21 in hepatocellular carcinoma cells was significantly higher than that in the hepatic cells (P<0.01). After inhibiting miR-21, the viability and invasion ability of hepatocellular carcinoma cells were decreased (P<0.01). The expression level of programmed cell death 4 (PDCD4) in hepatocellular carcinoma tissues was significantly lower than that in the adjacent tissues (P<0.01). Its expression level in hepatocellular carcinoma cells was significantly lower than that in the hepatic cells (P<0.01). After interfering with PDCD4, the vitality and invasion ability of liver cancer cells were increased (P<0.05). Dual luciferase reporter gene assay indicated that by inhibiting miR-21, the expression level of PDCD4 was up-regulated (P<0.01). The vitality and invasion ability of liver cancer cells were reduced (P<0.001). Conclusion MiR-21 can regulate the growth and invasion of liver cancer cells through targeting PDCD4.
hepatocellular neoplasms; miR-21; PDCD4
南通市卫计委青年基金(WQ2015018)
江苏省南通市第一人民医院肿瘤科,南通 226001
印 滇,男,硕士,主治医师。E-mail: 6820648@qq.com 王以浪,男,硕士,主治医师,通讯作者。E-mail: 895325173@qq.com
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.013.html
R 735.7
A
1001-7399(2017)04-0412-05
10.13315/j.cnki.cjcep.2017.04.013
接受日期:2016-12-23
