长链非编码RNA TUSC7对人恶性黑色素瘤A375细胞增殖的影响
2017-06-05袁志明林泽旭陈一峰吴晓红
袁志明,林泽旭,陈一峰,吴晓红,林 鑫
长链非编码RNA TUSC7对人恶性黑色素瘤A375细胞增殖的影响
袁志明1,林泽旭1,陈一峰2,吴晓红1,林 鑫1
目的 探讨长链非编码RNA TUSC7在人皮肤恶性黑色素瘤(malignant melanoma, CMM)细胞株中的表达及其对人黑色素瘤细胞增殖的影响。方法 采用qRT-PCR技术检测人皮肤CMM组织和良性痣组织,CMM细胞株G-361、SK-MEL-1、A375、A875和正常人表皮黑色素细胞系HEMn-LP中TUSC7的表达。将CMM A375细胞分别转染TUSC7过表达质粒(pcDNA-TUSC7组)和阴性对照序列(pcDNA3.1组),分别采用CCK-8法和克隆形成实验检测两组细胞的增殖情况,采用流式细胞术检测细胞凋亡。结果 60例CMM组织和CMM细胞株中TUSC7的表达水平显著低于20例良性痣组织和正常人表皮黑色素细胞(P<0.05)。A375细胞过表达质粒pcDNA-TUSC7转染组中TUSC7表达水平显著高于pcDNA3.1组,差异有统计学意义(P<0.05)。CCK-8和克隆集落形成实验结果表明pcDNA-TUSC7组A375细胞增殖指数和细胞克隆数均显著低于pcDNA3.1组,流式细胞术检测凋亡率结果表明pcDNA-TUSC7组A375细胞凋亡率均显著高于pcDNA3.1组,差异有统计学意义(P<0.05)。结论 CMM细胞株中TUSC7呈低表达,上调TUSC7表达能显著抑制CMM细胞的增殖和克隆形成能力,促进细胞凋亡,TUSC7可能参与CMM的恶性进展。
皮肤肿瘤;恶性黑色素瘤;长链非编码RNA;TUSC7;细胞增殖;凋亡
皮肤恶性黑色素瘤(cutaneous malignant melanoma, CMM)是一种黑色素细胞失控性增殖引起的高侵略性肿瘤,占皮肤恶性肿瘤的10%左右[1]。尽管有伊匹单抗、维罗非尼、达拉菲尼和曲美替尼等多种靶向药物已被临床用于治疗转移性CMM,为CMM的治疗带来彻底的革新,但截至目前,CMM仍无法治愈[2]。这就促使研究者们更好的理解CMM的发生、发展机制,而研究不同基因在CMM中的表达情况和功能已成为发展新的治疗方法的基础。
继蛋白编码RNA后,miRNA和长链非编码RNA(long non-coding RNA, lncRNA)等非编码RNA极大的补充了机体中高度复杂的RNA调控网络[3-4]。lncRNA由于其在人类基因组中巨大的数量和全方面多机制的肿瘤调控功能也引起越来越多学者关注[5-6]。通过直接调控致癌或抑癌基因,lncRNA可在CMM中行使促癌或抑癌作用[7-8]。TUSC7(tumor suppressor candidate 7),又名LOC285194,是一个位于人类染色体3q13.31的可在多种肿瘤中扮演抑癌基因角色的lncRNA[9-13]。目前为止尚无关于其在人CMM组织和细胞中表达情况及其是否功能性参与CMM发生、发展和恶性转化的公开报道。本实验通过qRT-PCR技术检测人CMM组织和细胞株及良性痣中TUSC7的表达;并采用质粒构建技术结合CCK-8实验、克隆集落形成实验观察TUSC7对细胞增殖能力的影响。
1 材料与方法
1.1 材料 选取福建医科大学附属泉州第一医院2012年4月~2015年10月手术切除的60例CMM和20例良性痣手术切除标本,术前患者均未接受放疗、化疗及免疫治疗,术后均经病理证实为CMM。患者均已签署知情同意书。标本采集后置于DEPC水处理后的冻存管,浸没于RNA Latter中,存放于-80 ℃冰箱备用。所有细胞均为本科室保有并常规培养传代。正常人表皮黑色素细胞系HEMn-LP培养于M-254(Invitrogen公司,Carlsbad,CA, USA)基础培养基,所有4株人黑色素瘤细胞株(G-361,SK-MEL-1,A375,A875)均培养于DMEM(Invitrogen公司,Carlsbad,CA,USA)培养基,所有培养基均含1%双抗(青霉素100 U/mL和链霉素100 mg/L)和10%胎牛血清(Gibco公司,Carlsbad,CA,USA),细胞置于37 ℃培养箱中,5%CO2浓度下培养。2~3天细胞融合度达80%~90%可进行传代。PCR引物(上海生工公司)。
1.2 试剂和仪器 逆转录试剂盒及PCR试剂盒(大连Takara公司),焦碳酸二乙酯(DEPC,上海生工公司)。TRIzol试剂、双抗、转染试剂脂质体2000均购自美国Invitrogen公司。pcDNA/TUSC7表达载体(引物序列:上游5′-CGATCTTAATTAAGGGGTACCAAAGTCCACTCTG-3′,下游5′-TCAGTGGCGCGCCTTTTTCGTGAGTACACAATAGTCATC-3′)和阴性对照pcDNA3.1质粒,克隆酶切位点:BamHI/EcoRI,购自上海权阳生物公司。CCK-8试剂购自上海科雅生物公司。结晶紫购自美国Sigma公司。G418、高糖DMEM培养基、胎牛血清购自Gibco公司。
1.3 总RNA抽提及qRT-PCR 采用TRIzol试剂一步法分别提取各细胞株总RNA。根据两步法逆转录试剂盒说明合成cDNA,扩增TUSC7和内参GAPDH基因。引物序列:GAPDH上游5′-CATGGCCTTCCGTGTTCCTA-3′,下游5′-TGTCATCATACTTGGCAGGTTT-3′,扩增产物片段长度为309 bp;TUSC7上游5′-CTTCTGGGCTCAAGTGATCCT-3′,下游5′- TTGTGCCATGAGACTCCATCAG-3′,扩增产物片段长度为325 bp。反应体系20 μL,反应条件:预变性95 ℃ 30 s后,进行40个循环反应:95 ℃ 5 s,60 ℃ 30 s。运用熔解曲线检测扩增产物的纯度。获得CT值,基因表达量采用qRT-PCR相对定量法对2-ΔΔCT进行统计学计算。
1.4 质粒瞬时转染和TUSC7稳定过表达细胞株构建 转染前1天在6孔板中接种每升2.5×105个的A375细胞,转染时细胞密度达60%~70%。第2天按照转染试剂说明书分别将pcDNA-TUSC7阴性对照质粒pcDNA3.1转染细胞(2 μg质粒,5 μL Lipofectamine 2000),转染6 h后换液。转染24 h后消化细胞供后续功能实验使用,转染48 h后细胞用于提取RNA检测转染效率。用150 μg/mL G418筛选3周,获得稳定表达TUSC7 RNA的A375细胞及转染空载体细胞,将2株细胞扩大培养,稳定传代,并用RT-PCR法鉴定阳性克隆。
1.5 CCK-8法检测细胞增殖能力 用DMEM培养液制备A375/pcDNA3.1细胞和A375/pcDNA-TUSC7细胞的单细胞悬液,计数并调整细胞浓度,制备浓度为3×103/100 μL的单细胞悬液,96孔板中每孔加入100 μL细胞悬液,每组6个复孔,共5板。设置贴壁时间为0 h,之后每24 h取出1块96孔板,每孔加入10 μL CCK-8试剂,在细胞培养箱内避光继续孵育2 h后用酶标仪检测其在波长450 nm处的吸光值(A)。连续记录96 h的实验结果,分析各组细胞的增殖能力。
1.6 克隆形成实验 用DMEM培养液制备稳定表达A375/pcDNA3.1细胞和A375/pcDNA-TUSC7细胞的单细胞悬液,计数并调整细胞浓度,制备浓度为800/2 mL的单细胞悬液。6孔板中每孔加入2 mL细胞悬液,每组细胞各铺3个复孔。培养第7天换一次新鲜培养基。10天后,取出弃去培液,PBS清洗,乙醇固定30 min,结晶紫染色30 min,PBS清洗,晾干。拍照并计数计算克隆形成率。
1.7 流式细胞学实验 收获转染细胞,离心去上清后,用PE Annexin V凋亡检测试剂盒进行双标染色(美国BD公司)。细胞凋亡用流式细胞分析仪进行分析(FACSca;美国BD公司)。细胞被分类为活细胞、坏死细胞、早期凋亡细胞和晚期凋亡细胞,对各组间早期凋亡比例进行比较。

2 结果
2.1 TUSC7在CMM组织中的表达 采用qRT-PCR技术检测60例CMM组织和20例良性痣组织中TUSC7的表达结果显示,CMM组织中TUSC7 mRNA的相对表达量(0.507±0.079)显著低于良性痣组织(1.568±0.246)(P<0.05,图1)。

图1 TUSC7在恶性黑色素瘤组织中的表达
2.2 TUSC7在CMM细胞株中的表达 人CMM细胞株G-361、SK-MEL-1、A375和A875中TUSC7的表达量均显著低于正常人表皮黑色素HEMn-LP细胞株(P<0.05,图2)。以上结果证实TUSC7在CMM组织及细胞系中表达降低,故选用相对低表达的A375细胞株进行后续的功能实验。

图2 TUSC7在恶性黑色素瘤细胞中的表达与正常黑色素细胞相比,*P<0.05
2.3 A375细胞中TUSC7的过表达效果 用qRT-PCR技术检测转染前后细胞内TUSC7的mRNA表达量,与pcDNA3.1组相比,转染过表达质粒的pcDNA-TUSC7组中TUSC7表达水平显著升高(P<0.01,图3),上调约32倍。
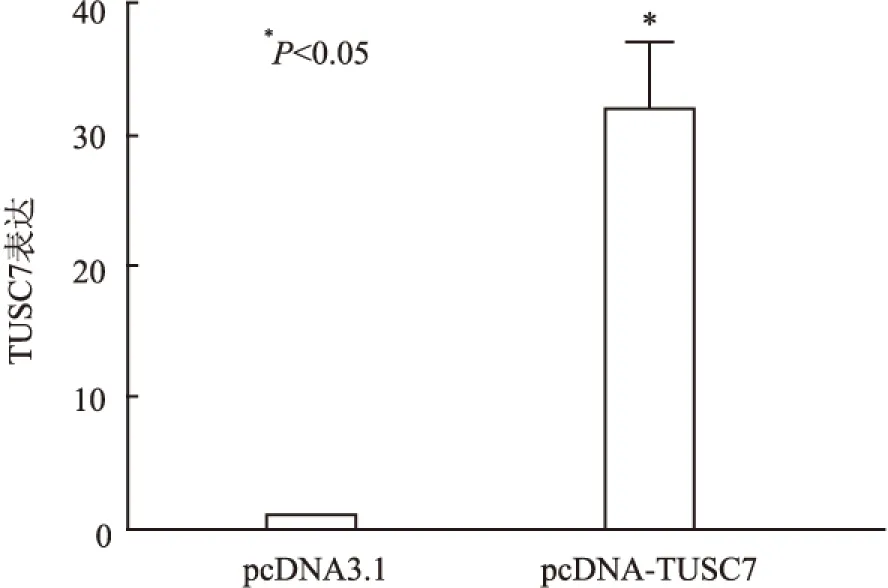
图3 qRT-PCR检测pcDNA-TUSC7及pcDNA3.1瞬时转染后A375细胞中TUSC7的表达
2.4 过表达TUSC7对A375细胞增殖能力的影响 通过酶标仪检测细胞在加入CCK-8试剂并避光孵育后在波长450 nm处的吸光值,结果显示:与A375/pcDNA3.1组比较,A375/pcDNA-TUSC7组的细胞增殖能力减弱,转染72 h后的细胞增殖能力低于A375/pcDNA-3.1组(P<0.05,图4)。细胞克隆形成实验结果表明A375/pcDNA-TUSC7组细胞克隆数少于A375/pcDNA3.1组(P<0.05,图5),这表明A375细胞过表达TUSC7后克隆形成能力减弱。
2.5 过表达TUSC7对A375细胞凋亡率的影响 流式细胞术检测结果显示:与A375/pcDNA3.1组比较,A375/pcDNA-TUSC7组的细胞凋亡率增加,转染72 h后的细胞凋亡率高于A375/pcDNA-3.1组(P<0.05,图6)。这表明TUSC7可促进A375细胞凋亡。

图4 CCK-8法检测pcDNA-TUSC7及pcDNA3.1瞬时转染后A375细胞增殖情况

图5 pcDNA-TUSC7和pcDNA3.1瞬时转染10天后A375细胞的克隆形成情况

图6 流式细胞技术检测pcDNA-TUSC7及pcDNA3.1瞬时转染后A375细胞的凋亡率
3 讨论
大量研究表明lncRNA不仅参与调控生命体的各种生理病理进程,这一类既往被人们误判为基因组转录“噪音”的RNA聚合酶Ⅱ(RNApolymerase Ⅱ, RNA PⅡ)转录的副产物亦可在人类肿瘤的发生、发展及恶性转化中扮演重要角色。TUSC7既往也被报道在骨肉瘤[9]、胰导管腺癌[10]、食管鳞状细胞癌[11]、结直肠癌[12]、胃癌[13]等多种肿瘤中异常表达。相关报道亦证实,TUSC7是肿瘤抑制因子,其表达缺失参与多种肿瘤恶性转化甚至化疗耐受的调控。
本实验采用qRT-PCR技术对人CMM组织和细胞进行检测,结果表明TUSC7在CMM组织中表达显著低于良性痣组织;且在CMM细胞系中的表达显著低于正常表皮黑色素细胞系。其中A375细胞株中TUSC7的表达下调最明显,故选择该细胞株进行后续试验。期望通过研究TUSC7在A375细胞中的功能,发现CMM新的治疗靶点。
利用质粒构建和瞬时转染技术可在短期内大量增加细胞内TUSC7的表达量,从而影响肿瘤细胞的生物学行为。本实验首先过表达细胞内TUSC7含量,在qRT-PCR检测结果证实细胞内TUSC7显著上调后,通过细胞增殖实验和克隆集落形成实验,发现过表达可显著抑制A375细胞的增殖和克隆形成,且流式细胞学检测结果表明过表达TUSC7的凋亡率显著高于对照组,表明TUSC7在人CMM中也可发挥肿瘤抑制因子作用,抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,参与调控CMM的发生、发展及恶性转化。
既往研究表明:作为p53信号通路的重要调控因子[14],TUSC7可通过与miR-211和miR-23b等miRNAs互补结合,发挥“海绵”作用抑制后者功能,进而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡[13-14]。然而,TUSC7影响人CMM发生、发展的下游分子机制如何,尚未可知。作者推测TUSC7或可通过与潜在的人CMM特异miRNAs之间形成负反馈调节,进而影响肿瘤细胞增殖。然而,特定的lncRNA在不同的组织和细胞类型中其作用靶点可能也不尽相同[15]。因此,TUSC7在人CMM中的作用靶点如何需要进一步的机制研究来阐明。在未来的研究工作中,可以利用诸如基因组芯片技术、二代测序和蛋白质谱等高通量检测方法检测经过TUSC7干预的人CMM细胞,获得一个基因组学和蛋白质组学变化的全局视图,有望深入阐明其作用机制。
[1] Rigel D S. Trends in dermatology: melanoma incidence[J]. Arch Dermatol, 2010,146(3):318.
[2] Saranga-Perry V, Ambe C, Zager J S,etal. Recent developments in the medical and surgical treatment of melanoma[J]. CA Cancer J Clin, 2014,64(3):171-185.
[3] Mueller D W, Bosserhoff A K. Role of mirnas in the progression of malignant melanoma[J]. Br J Cancer, 2009,101(4):551-556.
[4] Segura M F, Greenwald H S, Hanniford D,etal. Microrna and cutaneous melanoma: from discovery to prognosis and therapy[J]. Carcinogenesis, 2012,33(10):1823-1832.
[5] Liang J C, Bloom R J, Smolke C D. Engineering biological systems with synthetic rnamolecules[J]. Mol Cell, 2011,43(6):915-926.
[6] Mercer T R, Mattick J S. Structure and function of long noncoding rnas in epigenetic regulation[J]. Nat Struct Mol Biol, 2013,20(3):300-307.
[7] Lessard L, Liu M, Marzese D M,etal. The casc15 long intergenic noncoding rnalocus is involved in melanoma progression and phenotype switching[J]. J Invest Dermatol, 2015,135(10):2464-2474.
[8] Soares M R, Huber J, Rios A F,etal. Investigation of igf2/apai and h19/rsai polymorphisms in patients with cutaneous melanoma[J]. Growth Horm IGF Res, 2010,20(4):295-297.
[9] Pasic I, Shlien A, Durbin A D,etal. Recurrent focal copy-number changes and loss of heterozygosity implicate two noncoding rnas and one tumor suppressor gene at chromosome 3q13.31 in osteosarcoma[J]. Cancer Res, 2010,70(1):160-171.
[10] Ding Y C, Yu W, Ma C,etal. Expression of long non-coding rna loc285194 and its prognostic significance in human pancreatic ductal adenocarcinoma[J]. Int J Clin Exp Pathol, 2014,7(11):8065-8070.
[11] Tong Y S, Zhou X L, Wang X W,etal. Association of decreased expression of long non-coding rna loc285194 with chemoradiotherapy resistance and poor prognosis in esophageal squamous cell carcinoma [J]. J Transl Med, 2014,12(1):3419-3420.
[12] Qi P, Xu M D, Ni S J,etal. Low expression of loc285194 is associated with poor prognosis in colorectal cancer [J]. J Transl Med, 2013,11(1):1-7.
[13] Qi P, Xu M D, Shen X H,etal. Reciprocal repression between tusc7 and mir-23b in gastric cancer [J]. Int J Cancer, 2015,137(6):1269-1278.
[14] Liu Q, Huang J, Zhou N,etal. Lncrna loc285194 is a p53-regulated tumor suppressor[J]. Nucleic Acids Res, 2013,41(9):4976-4987.
[15] 戴 超, 刘芳腾, 张发鹏, 等. 长链非编码RNA SPRY4-IT1在恶性肿瘤中的研究进展[J]. 临床与实验病理学杂志, 2016,32(7):792-795.
Expression of lncRNA TUSC7 in melanoma A375 cell line and its effect on proliferation and apoptosis of melanoma cells
YUAN Zhi-ming1, LIN Ze-xu1, Chen Yi-feng2, WU Xiao-hong1, LIN Xin1
(1DepartmentofPlasticSurgery,2DepartmentofPathology,FujianMedicalUniversityAffiliatedQuanzhouFirstHospital,Quanzhou362000,China)
Purpose To investigate the expression level and the role of TUSC7 in human cutaneous malignant melanoma (CMM). Methods Quantitative real time-PCR (qRT-PCR) assay was performed to detect the expression of TUSC7 in 60 cases of CMM tissues, 20 cases of benign nevus, 4 CMM cell lines, and one normal human epidermal melanocytes. Then overexpression of TUSC7 was performed and its role in tumor progression was explored. Results TUSC7 expression was significantly downregulated in primary CMM tissues (n=60) compared to benign nevi (n=20), which were significantly down-regulated in all the four melanoma cell lines, especially in A375 cells.compared with the normal melanocytes cells (allP<0.05). In comparison with the A375 cells transfected with the empty plasmid, those transfected with pcDNA-TUSC7 showed an obvious decrease in the proliferation and colony formation activity, while increase in the apoptosis rate (allP<0.05). Conclusion Our results suggested that the dysregulation of TUSC7 may play an important role in the CMM progression.
skin neoplasms; cutaneous malignant melanoma; long noncoding RNA; TUSC7; proliferation; apoptosis
福建医科大学附属泉州第一医院1整形外科、2病理科,泉州 362000
袁志明,男,主治医师。E-mail: doctoryuan216@163.com
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.012.html
R 739.5
A
1001-7399(2017)04-0408-05
10.13315/j.cnki.cjcep.2017.04.012
接受日期:2016-12-20
