膀胱尿路上皮癌中DAB2IP和β-catenin的表达及临床意义
2017-06-05郑林峰倪型灏程国平杨世峰
郑林峰,倪型灏,程国平,杨世峰
膀胱尿路上皮癌中DAB2IP和β-catenin的表达及临床意义
郑林峰,倪型灏,程国平,杨世峰
目的 探讨DAB2相互作用蛋白(DOC-2/DAB2 interactive protein, DAB2IP)及β-连环蛋白(β-catenin)在膀胱尿路上皮癌(bladder urothelial carcinoma, BUC)中的表达及临床意义。方法 采用免疫组化EnVision两步法检测104例BUC组织和40例癌旁正常膀胱黏膜组织中DAB2IP及β-catenin蛋白表达,并分析两者表达与BUC临床病理特征及预后的关系。结果 BUC组织中DAB2IP蛋白表达明显低于癌旁正常膀胱黏膜组织,β-catenin蛋白表达明显高于癌旁正常膀胱黏膜组织(P<0.05)。DAB2IP蛋白表达与BUC组织学分级、病理分期及5年生存率差异有显著性(P<0.05),与患者性别、年龄、肿瘤直径以及初发/复发患者无相关性(P>0.05)。β-catenin蛋白表达与BUC患者年龄、组织学分级、病理分期、肿瘤直径及5年生存率有相关性(P<0.05),与患者性别以及初发/复发患者无相关性(P>0.05)。BUC组织中DAB2IP及β-catenin蛋白表达呈负相关(P<0.05)。结论 BUC组织中DAB2IP表达下调,β-catenin表达升高,且两者表达呈负相关,DAB2IP和β-catenin异常表达与BUC组织学分级、病理分期及预后有关。
膀胱肿瘤;尿路上皮癌;DAB2IP;β-catenin;免疫组织化学
膀胱癌是泌尿系统最常见的恶性肿瘤之一。2012年美国新诊断的膀胱癌患者男性55 600例,女性17 910例,其中10 510例男性和4 370例女性死于膀胱癌[1]。膀胱癌的发生、发展受多种基因的调控,但至今尚无单一的肿瘤标志物被广泛认可。DAB2相互作用蛋白(DOC-2/DAB2 interactive protein, DAB2IP)是新近发现的Ras-鸟苷三磷酸酶激活蛋白(Ras GTPase activating protein, Ras-GAP)家族的新成员,具有调控细胞凋亡、抑制血管生成、抑制肿瘤生长、转移和放疗耐受等生物学功能[2]。β-catenin是上皮钙黏素-连环素复合体的重要组成部分,参与同型细胞间的识别和黏附,同时还作为Wnt信号通路中的转导分子在细胞转录中起重要作用[3]。Xie等[4]发现,DAB2IP能调节GSK-3β-βcatenin信号通路,并且与上皮-间质细胞转变(epithelial mesenchymal transition, EMT)有关。本文现采用免疫组化EnVision两步法检测DAB2IP及β-catenin蛋白在膀胱尿路上皮癌(bladder urothelial carcinoma, BUC)和正常膀胱黏膜中的表达,初步探讨两者在膀胱癌发生、发展的作用及其相关性。
1 材料与方法
1.1 临床资料 收集浙江省肿瘤医院2009年1月~2014年12月膀胱癌根治标本104例及其癌旁组织标本(距癌旁>2 cm)40例,所有患者术前均未行基因治疗、放化疗及免疫治疗等。BUC组中男性92例,女性12例;年龄27~84岁,平均(62.66±1.16)岁,中位年龄65岁,其中<63岁者47例,≥63岁者57例;肿瘤直径<2 cm者16例,≥2 cm者88例;初发膀胱癌76例,复发者28例。根据WHO(2016)泌尿和男性生殖系统肿瘤分类标准,其中非浸润性尿路上皮癌11例,浸润性尿路上皮癌93例;低级别40例,高级别64例;临床分期Tis-T1期52例,T2-T4期52例。正常膀胱黏膜组中男性28例,女性12例;年龄40~84岁,平均(57.53±1.02)岁,中位年龄60岁。所有标本均经10%中性福尔马林固定,石蜡包埋,连续切片,行HE及免疫组化染色,且由两名有经验的病理医师镜下观察切片。
1.2 免疫组化 兔抗人DAB2IP多克隆抗体(美国Abcam公司)及鼠抗人β-catenin单克隆抗体(美国Santa Cruz公司)均按1 ∶200稀释。所有组织标本4 μm厚连续切片。免疫组化染色采用EnVision两步法,EDTA(pH 9.0)水浴抗原修复,一抗1 h、二抗20 min室温孵育,DAB显色10 min,苏木精复染、封固。采用已知阳性切片作为阳性对照,以PBS代替一抗作为阴性对照。
1.3 结果判定 DAB2IP蛋白表达阳性判断标准:以膀胱癌及正常黏膜上皮细胞质内出现棕色至深棕色颗粒为阳性细胞。由两位病理专业医师进行阅片,取平均值为最后结果。(1)按染色比例计分:阳性细胞数1%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;(2)按染色强度计分:阴性为0分,弱阳性为1分,中等阳性为2分,强阳性为3分,将两项得分结果相加:总分<3分为DAB2IP阴性,≥3分为DAB2IP阳性。β-catenin在正常膀胱组织中主要表达于细胞膜,在膀胱癌则主要以胞质或胞核着色为异常表达,阳性细胞数≥10%为阳性,<10%为阴性。
1.4 统计学分析 应用SPSS 21.0软件进行统计学处理,组间比较及临床病理指标的相互关系采用χ2检验和Fisher确切概率法,采用Spearman等级相关检验对DAB2IP和β-catenin在膀胱癌中的相互间关系进行分析,Kaplan-Meier法分析生存情况,生存曲线比较采用Log-rank检验,采用Cox比例风险回归模型分析多因素对预后的影响。
2 结果
2.1 BUC及癌旁正常膀胱组织中DAB2IP和β-catenin蛋白的表达 BUC及癌旁正常膀胱组织中DAB2IP阳性率分别为42.30%(44/104)、90%(36/40),两者差异有显著性(P<0.05);β-catenin在BUC及癌旁正常膀胱组织的阳性率分别为57.69%(60/104)、7.5%(3/40),两者差异有显著性(P<0.05,图1~3,表1)。

①A①B①C②A②B②C③A③B③C
图1 DAB2IP和β-catenin蛋白在正常膀胱黏膜中的表达:A.正常膀胱黏膜HE染色;B.DAB2IP呈强阳性;C.β-catenin胞膜阳性,EnVision两步法 图2 DAB2IP和β-catenin蛋白在低级别非浸润性膀胱尿路上皮癌中的表达:A.低级别非浸润性尿路上皮癌HE染色;B.DAB2IP呈阳性;C.β-catenin呈胞质及胞核阳性,EnVision两步法 图3 DAB2IP和β-catenin蛋白在高级别浸润性尿路上皮癌中的表达:A.高级别浸润性尿路上皮癌HE染色;B.DAB2IP呈阴性;C.β-catenin呈胞质及胞核强阳性,EnVision两步法

表1 膀胱尿路上皮癌及癌旁正常膀胱组织中DAB2IP和β-catenin蛋白的表达[n(%)]
2.2 DAB2IP和β-catenin蛋白表达与BUC临床病理特征的关系 DAB2IP蛋白表达与BUC病理组织学分级、临床病理分期间有关(P<0.05),与患者性别、年龄、肿瘤直径以及初发/复发情况无关(P>0.05)。β-catenin蛋白表达与BUC年龄、病理组织学分级、临床病理分期及肿瘤直径有关(P<0.05),与患者性别以及初发/复发情况无关(P>0.05,表2)。BUC组织中DAB2IP和β-catenin蛋白表达呈负相关(r=-0.330,P<0.05,表3)。

表2 膀胱尿路上皮癌中DAB2IP和β-catenin蛋白表达与临床病理特征的关系[n(%)]

表3 膀胱尿路上皮癌中DAB2IP和β-catenin蛋白表达的相关性
2.3 DAB2IP和β-catenin蛋白表达与BUC预后的关系 本组104例BUC患者最短生存时间为7个月,最长为82个月,平均生存期(36.54±2.00)个月,中位生存时间31.5个月。Kaplan-Meier法和Log-rank检验分析结果显示,患者5年总体生存率为60.57%(63/104),DAB2IP蛋白阴性和阳性者的5年生存率分别为43.33%和84.09%,两者差异有统计学意义(χ2=20.38,P<0.001)。β-catenin蛋白阴性和阳性者的5年生存率分别为72.72%和51.66%,两者差异有统计学意义(χ2=8.894,P=0.003,图4、5)。

图4 膀胱尿路上皮癌中DAB2IP表达与患者生存率的关系
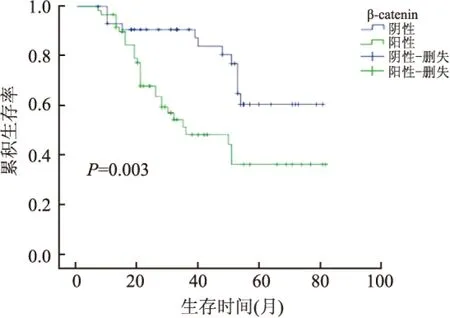
图5 膀胱尿路上皮癌中β-catenin表达与患者生存率的关系
2.4 Cox比例风险回归模型分析多因素对预后的影响 单因素Cox模型分析:将DAB2IP蛋白、β-catenin蛋白以及BUC临床病理特征逐个引入Cox模型,结果显示与BUC预后相关有显著意义的因素有5个,分别为保护因素:DAB2IP蛋白(95%CI:0.083~0.428);危险因素:年龄(95%CI:1.349~5.091)、病理分级(95%CI:1.185~4.605)、临床分期(95%CI:1.677~6.128)、β-catenin蛋白(95%CI:1.361~5.362);而患者性别、肿瘤直径以及初发/复发未提示与预后有关。采用Cox模型多因素综合评价上述影响因素,将与BUC预后相关有显著意义的5个因素引入Cox模型,结果显示:年龄及DAB2IP蛋白是影响BUC患者预后的独立因素(P<0.05);而病理分级、临床分期、β-catenin蛋白并非为影响BUC患者预后的独立因素(P>0.05,表4、5)。

表4 膀胱尿路上皮癌患者预后单因素Cox模型分析
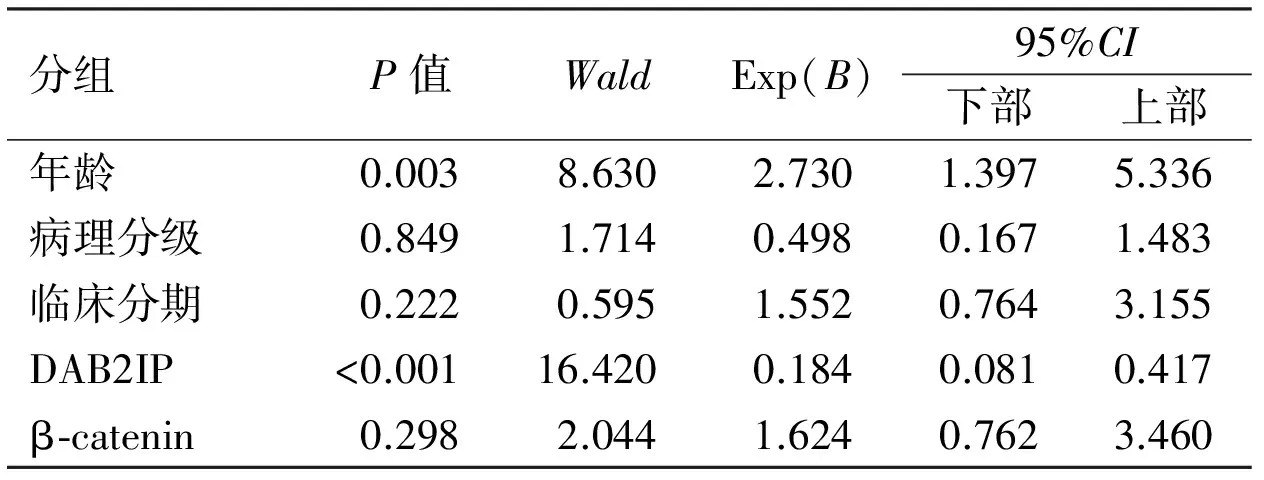
表5 膀胱尿路上皮癌患者预后多因素Cox回归模型分析
2.5 随访 采用电话进行随访,以患者死亡、2015年12月31日或失访作为随访结束,随访时间为12~84个月。失访12例,失访率为11.5%。
3 讨论
人类DAB2IP定位于9q33.1~9q33.3,包含15个外显子和14个内含子,编码967个氨基酸,相对分子质量为11.0×104[5]。2002年,Chen等[5]利用酵母双杂交系统鉴定发现:DAB2IP是一种新的Ras-GTP酶激活蛋白,可作为效应蛋白与卵巢癌差异表达基因2(differentially expressed in ovarian carcinoma-2, DOC2, 又称DAB2)[6]的氨基末端相互作用,从而激活DAB2的表达,抑制多种肿瘤的发生及发展[7-8]。且DAB2IP基因是与肿瘤相关的信号转导通路中的重要环节,介导PI3K-AKT、MAEK /ERK、NF-kB、ASK1-JNK、GSK-3β-β-catenin、STAT3/Twist1/P-glycoprotein等多个信号通路[9-10]。目前研究表明DAB2IP在肿瘤发生、发展过程中其表达受到抑制,引起该表达下调的主要机制是DAB2IP基因启动子区域的DNA发生高度甲基化使DAB2IP基因表达受到抑制[11]。DAB2IP基因作为一种最新发现的抑癌基因,在膀胱癌中的表达与临床预后的关系,目前鲜有报道。
本组实验结果显示,104例BUC组织和40例癌旁正常膀胱黏膜组织中DAB2IP阳性率分别42.30%(44/104)、90%(36/40),两者差异有显著性(P<0.05)。DAB2IP蛋白表达与BUC的病理组织学分级、临床病理分期有关(P<0.05),并且随病理分级及临床分期提升而阳性率降低。生存分析结果示:DAB2IP是影响BUC患者预后的独立因素,阳性组预后好于阴性组。上述实验结果与Shen等[12]报道一致,均提示DAB2IP表达下调在BUC的发生、发展及预后中起着重要作用。
β-catenin蛋白由CTNNB1基因编码,该基因定位于人类染色体3p21,由16个外显子组成,全长23.2 kb[13]。β-catenin是Wnt信号传导通路及介导细胞黏附的关键分子,在生理情况下,β-catenin通过破坏包含APC肿瘤抑制基因等复合物保持低的胞质浓度[14]。然而,当Wnt信号通路被激活,β-catenin积累在细胞质和胞核,导致细胞增殖、侵袭和转移。多项研究表明,β-catenin与肿瘤的发生、发展、侵袭及转移有关[15-16]。本组结果表明,β-catenin在BUC中阳性率明显高于正常膀胱黏膜组织,与BUC患者年龄、病理组织学分级、临床病理分期及肿瘤直径有关(P<0.05),并且随病理分级及临床分期提升而阳性率升高,与性别以及初发/复发情况无关(P>0.05)。生存分析结果示:β-catenin阴性组预后好于阳性组。因此,作者认为β-catenin蛋白异常表达参与BUC的发生、发展及预后过程。
Xie等[4]在前列腺癌中发现,DAB2IP能调节GSK-3β-β-catenin信号通路,并且与EMT有关。在DAB2IP存在的情况下,其C2结构域可与蛋白磷酸酶2A(protein phosphatase 2A, PP2A)和GSK-3β相互作用,使GSK-3β活化,进而使β-catenin转录活性下降,抑制了GSK-3β-β-catenin信号通路。而β-catenin在EMT中起到双重作用,在DAB2IP沉默后,β-catenin的细胞核内积累增加,并促进其在细胞质中的降解,调节β-catenin在质核的动态平衡,诱导EMT,提高肿瘤细胞的迁移及侵袭能力。本组实验发现BUC组织中DAB2IP表达下调,β-catenin表达升高,且两者表达呈负相关(r=-0.330,P<0.05),提示两者通过GSK-3β-β-catenin信号通路在BUC的发生、发展中发挥重要作用。
综上所述,DAB2IP和β-catenin异常表达与BUC病理组织学分级、临床病理分期及预后密切有关,联合检测两者有助于对BUC的诊治提供新的思路和线索。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012,62(1):10-29.
[2] Kong Z, Raghavan P, Xie D,etal. Epothilone B confers radiation dose enhancement in DAB2IP gene knock-down radioresistant prostate cancer cells[J]. Int J Radiat Oncol Biol Phys, 2010,78(4):1210-1218.
[3] Valenta T, Hausmann G, Basler K. The many faces and functions of beta-catenin[J]. EMBO J, 2012,31(12):2714-2736.
[4] Xie D, Gore C, Liu J,etal. Role of DAB2IP in modulating epithelial-to-mesenchymal transition and prostate cancer metastasis[J]. Proc Natl Acad Sci USA, 2010,107(6):2485-2490.
[5] Chen H, Pong R, Wang Z,etal. Differential regulation of the human gene DAB21P in normal and malignant prostatic epithelia: cloning and characterization[J]. Genomics, 2002,79(4):573-581.
[6] Mok S C, Wong K K, Chan R K,etal. Molecular-cloning of differentielly expressed genes in numan epithehal ovarian cancer[J]. Gynecol Oncol, 1994,52(2):247-252.
[7] Min J, Liu L, Li X,etal. Absence of DAB2IP promotes cancer stem cell like signatures and indicates poor survival outcome in colorectal cancer[J]. Sci Rep, 2015,5:16578.
[8] Zhang T, Shen Y, Chen Y,etal. The ATM inhibitor KU55933 sensitizes radioresistant bladder cancer cells with DAB2IP gene defect[J]. Int J Radiat Biol, 2015,91(4):368-378.
[9] Liu L, Xu C, Hsieh J T,etal. DAB2IP in cancer[J]. Oncotarget, 2016,7(4):3766-3776.
[10] Wu K, Wang B, Chen Y,etal. DAB2IP regulates the chemoresistance to pirarubicin and tumor recurrence of non-muscle invasive bladder cancer through STAT3/Twist1/P-glycoprotein signaling[J]. Cell Signal, 2015,27(12):2515-2523.
[11] Zhang X, Li N, Li X,etal. Low expression of DAB2IP contributes to malignant development and poor prognosis in hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2012,27(6):1117-1125.
[12] Shen Y J, Kong Z L, Wang H K,etal. Downregulation of DAB2IP results in cell proliferation and invasion and contributes to unfavorable outcomes in bladder cancer[J]. Cancer Sci, 2014,105(6):704-712.
[13] Nollet F, Berx G, Molemans F,etal. Genomic organization of the human beta-catenin gene(CTNNB1)[J]. Genomics, 1996,32(3):413-424.
[14] Corrigan P M, Dobbin E, Freeburn R W,etal. Patterns of Wnt/Fzd/LRP gene expression during embryonic hematopoiesis[J]. Stem Cells Dev, 2009,18(5):759-772.
[15] Tien L T, Ito M, Nakao M,etal. Expression of beta-catenin in hepatocellular carcinoma[J]. World J Gastroenterol, 2005,11(16):2398-2401.
[16] Groulx J F, Giroux V, Beausejour M,etal. Integrin alpha 6A splice variant regulates proliferation and the Wnt/beta-catenin pathway in human colorectal cancer cells[J]. Carcinogenesis, 2014,35(6):1217-1227.
Expression of DAB2IP and β-catenin in bladder urothelial carcinoma and their clinical significance
ZHENG Lin-feng, NI Xing-hao, CHENG Guo-ping, YANG Shi-feng
(DepartmentofPathology,ZhejiangCancerHospital,Hangzhou310022,China)
Purpose To investigate the clinical utility of DAB2IP (DOC-2/DAB2 interactive protein)and β-catenin expression in bladder urothelial carcinoma (BUC). Methods The expression of DAB2IP and β-catenin was detected in 104 BUC cases and 40 peritumorial tissues using EnVision two-step immunohistochemical method, and the association with BUC clinicopathological parameters was analyzed. Results The expression of DAB2IP in BUC was significantly less than that of peritumorial normal tissues, and the expression of β-catenin in BUS was significantly higher than that of peritumorial normal tissues (P<0.05). DAB2IP expression and histologic grading, clinical pathologic staging and 5 years survival rate had statistical significance (P<0.05). No statistical significance with gender, age, tumor diameter and in patients with incipient/recurrence. β-catenin expression and age, histologic grading, clinical pathologic staging, tumor diameter and 5 years survival rate have statistical significance (P<0.05). No statistical significance correlated with gender and in patients with incipient/recurrence, DAB2IP and β-catenin expression in BUC are negatively correlated (P<0.05). Conclusion In bladder urothelial carcinoma, down-regulation of DAB2IP and up-regulation of β-catenin, are in a negative correlation. Abnormal expression of DAB2IP and β-catenin is correlated with histologic grading, clinical pathologic staging and prognosis.
bladder neoplasms; urothelial carcinoma; DAB2IP; β-catenin; immunohistochemistry
浙江省肿瘤医院病理科,杭州 310022
郑林峰,男,主治医师。E-mail: zhenglf@zjcc.org.cn 倪型灏,男,主任医师,通讯作者。Tel:(0571)88122269
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.010.html
R 737.14
A
1001-7399(2017)04-0398-05
10.13315/j.cnki.cjcep.2017.04.010
接受日期:2017-02-20
