结直肠癌原发灶与肝转移灶中KRAS、PIK3CA基因突变的一致性分析
2017-06-05韩丹丹郗彦凤白文启王丽丽
韩丹丹,郗彦凤,白文启,高 宁,王丽丽
结直肠癌原发灶与肝转移灶中KRAS、PIK3CA基因突变的一致性分析
韩丹丹1,郗彦凤2,白文启2,高 宁2,王丽丽3
目的 探讨结直肠癌原发灶及相应肝转移灶中KRAS、PIK3CA基因突变及临床意义。方法 采用实时荧光定量PCR法检测58例结直肠癌原发灶癌组织及相应肝转移灶组织中KRAS、PIK3CA基因突变情况。结果 结直肠癌原发灶与肝转移灶中KRAS基因的突变率分别为31.03%(18/58)、25.86%(15/58),最常见的突变位点为G12D;PIK3CA基因的突变率分别为8.62%(5/58)、10.34%(6/58),最常见的突变位点为E545K。有1例同时发生KRAS(G12D)、PIK3CA(E545K)基因突变。结直肠癌原发灶与肝转移灶中KRAS、PIK3CA基因突变的一致性较好。单因素分析显示:KRAS突变与结直肠癌原发灶肿瘤部位、转移灶多少、大体类型相关(P<0.05),PIK3CA突变与同时性/异时性肝转移、转移灶多少相关(P<0.05)。多因素Cox回归模型显示:同时性/异时性肝转移、KRAS突变状态是影响结直肠癌预后的危险因素。结直肠癌同时性肝转移比异时性肝转移患者的总生存期延长,KRAS野生型比突变型患者总生存期延长(P<0.05)。结论 结直肠癌中KRAS基因G12D位点突变率最高,原发灶与肝转移灶中KRAS、PIK3CA基因突变一致性较好。原发灶可以作为分子检测的标本来源,基于精准医疗对于靶向治疗的选择,则需再次评估肝转移灶中的基因状态,以达到个体化治疗。
结直肠肿瘤;KRAS;PIK3CA;预后
结直肠癌是一种常见的危害人类健康的消化道恶性肿瘤之一,其发病率位居所有恶性肿瘤的第三位[1]。结直肠癌肝转移是导致患者死亡的主要原因,改善其生存期最有效的治疗手段为肝切除术联合全身治疗[2]。KRAS、PIK3CA基因分别是EGFR依赖的RAS/RAF/MAPK和PI3K/PTEN/AKT信号通路中的关键基因,任一基因突变引起信号通路的激活有助于促进细胞增殖,转移和血管生成,抑制细胞凋亡等[3]。随着靶向治疗的进展,检测KRAS、PIK3CA基因状态将作为指导临床用药的重要依据。目前文献对KRAS、PIK3CA的报道多聚焦于原发灶,而转移性结直肠癌是一种异质性很强的疾病,因此有必要评估肝转移灶的基因状态。本实验采用实时荧光定量PCR法对58例结直肠癌原发灶及肝转移灶进行KRAS、PIK3CA基因检测,分析两者基因状态及临床意义,探讨两者与结直肠癌临床病理特征、患者预后的关系,为肝转移靶向治疗提供客观依据。
1 材料与方法
1.1 材料 选取2009年~2014年山西省肿瘤医院病理科诊断为腺癌的58例结直肠癌:(1)有相应的肝转移灶石蜡组织;(2)所有患者术前未接受过放疗、化疗及生物学治疗;(3)患者年龄36~78岁,中位年龄56岁,男性35例,女性23例,位于结肠39例,直肠19例。
1.2 试剂及仪器 试剂盒均购自厦门艾德生物公司:DNA提取试剂-FFPE样品DNA分离试剂盒;人类KRAS基因7种突变检测试剂盒(P216010701X);人类PIK3CA基因突变检测试剂盒(P215070803Y);荧光PCR仪器型号为StepOnePlus。
1.3 DNA提取 常规取4~8张8 μm厚切片,65 ℃烘片,二甲苯脱蜡,无水乙醇洗涤,蒸馏水冲洗。镜下观察HE染色片并对照石蜡标本标记出肿瘤细胞富集区域,将标记出的癌组织刮入Eppendorf管内。按FFPE样品DNA分离试剂盒说明书提取DNA,提取完的DNA立即进行检测。
1.4 实时荧光定量PCR 设置扩增程序:第一阶段95 ℃ 5 min,1个循环;第二阶段95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15个循环;第三阶段93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s,31个循环;信号收集:第三阶段60 ℃时收集FAM和HEX(或VIC)信号,ABI仪器探针模式设置,Reprter Dye:FAM、VIC;Quencher Dye:TAMRA;Passive Reference:NONE。执行实时PCR,保存,分析。
1.5 结果判断 确定样品各个反应管各自的突变Ct值,若样品中任何一个KRAS、PIK3CA反应孔有明显FAM信号扩增曲线且Ct值>28或29,则此孔基因位点为突变位点,弱阳性和强阳性视为突变,阴性视为野生。阳性对照管均应有明显的FAM信号,而阴性对照任一管FAM信号升起则视为实验失败。
1.6 生存分析 对58例结直肠癌患者通过电话及查阅病历的形式进行随访,随访自确诊之日起,主要观察总体生存率。
1.7 统计学方法 采用SPSS 17.0软件进行统计学分析。采用χ2检验和Fisher确切概率法分析KRAS、PIK3CA基因突变状态与临床病理特征的关系;同一个体原发灶与转移灶突变情况的一致性检验采用配对χ2检验;单因素生存分析采用Kaplan-Meier法;多因素分析采用Cox比例风险回归模型。检验水准α=0.05。
2 结果
2.1 KRAS、PIK3CA突变状态与结直肠癌临床病理特征的关系 58例结直肠癌患者原发灶与肝转移灶中KRAS突变率分别为31.03 %(18/58)、25.86%(15/58),PIK3CA突变率分别为8.62%(5/58)、10.34%(6/58)。18例KRAS突变病例中,14例原发灶与肝转移灶均为G12D突变,1例原发灶与肝转移灶突变位点不同G12DvsG12V(GGT>GATvsGGT>GTT),其余3例原发灶G12D突变,肝转移灶为野生型。6例PIK3CA突变病例中,3例原发灶与肝转移灶均为E545K(GAG>AAG)突变,1例均为E542(GAA>AAA)突变,1例原发灶H1047R突变(CAT>CGT)、肝转移灶E545K突变,1例原发灶野生型、肝转移灶E545K突变。另有1例发生KRAS、PIK3CA共突变。KRAS基因突变与结直肠癌原发灶的肿瘤部位、转移灶多少及大体类型相关(P<0.05),PIK3CA基因突变与同时性/异时性肝转移及转移灶多少相关(P<0.05),两者与患者性别、年龄、肿瘤直径、转移发生时间等均无相关性(P>0.05,表1~3)。
2.2 结直肠癌原发灶与肝转移灶中KRAS、PIK3CA突变的相关性 58例结直肠癌原发灶中,5例PIK3CA突变型中1例发生KRAS突变,53例PIK3CA野生型中17例发生KRAS突变,两基因表达无相关性(rs=-0.073,P>0.05)。肝转移灶中,6例PIK3CA突变型中无KRAS突变,58例PIK3CA野生型中15例发生KRAS突变,两基因表达无相关性(rs=0.201,P>0.05)。
2.3 结直肠癌原发灶与肝转移灶中KRAS、PIK3CA突变的一致性分析 对结直肠癌原发灶与肝转移灶中KRAS、PIK3CA基因突变情况进行一致性分析,结果显示,Kappa值均≥0.75,表明结直肠癌原发灶与肝转移灶基因突变一致性较好,差异有统计学意义(P<0.001,表4)。
2.4 预后 58例中54例获得随访结果,总生存期(overall survival, OS)为1~72个月,中位生存时间为24个月。Kaplan-Meier生存分析显示,同时性/异时性转移及KRAS突变状态对OS有显著影响(Log-rank检验P均<0.05)。异时性比同时性肝转移患者,KRAS基因野生型比突变型OS显著延长。多因素Cox回归分析显示,同时性/异时性肝转移、KRAS突变状态是影响预后的危险因素(P<0.05,图1、2)。
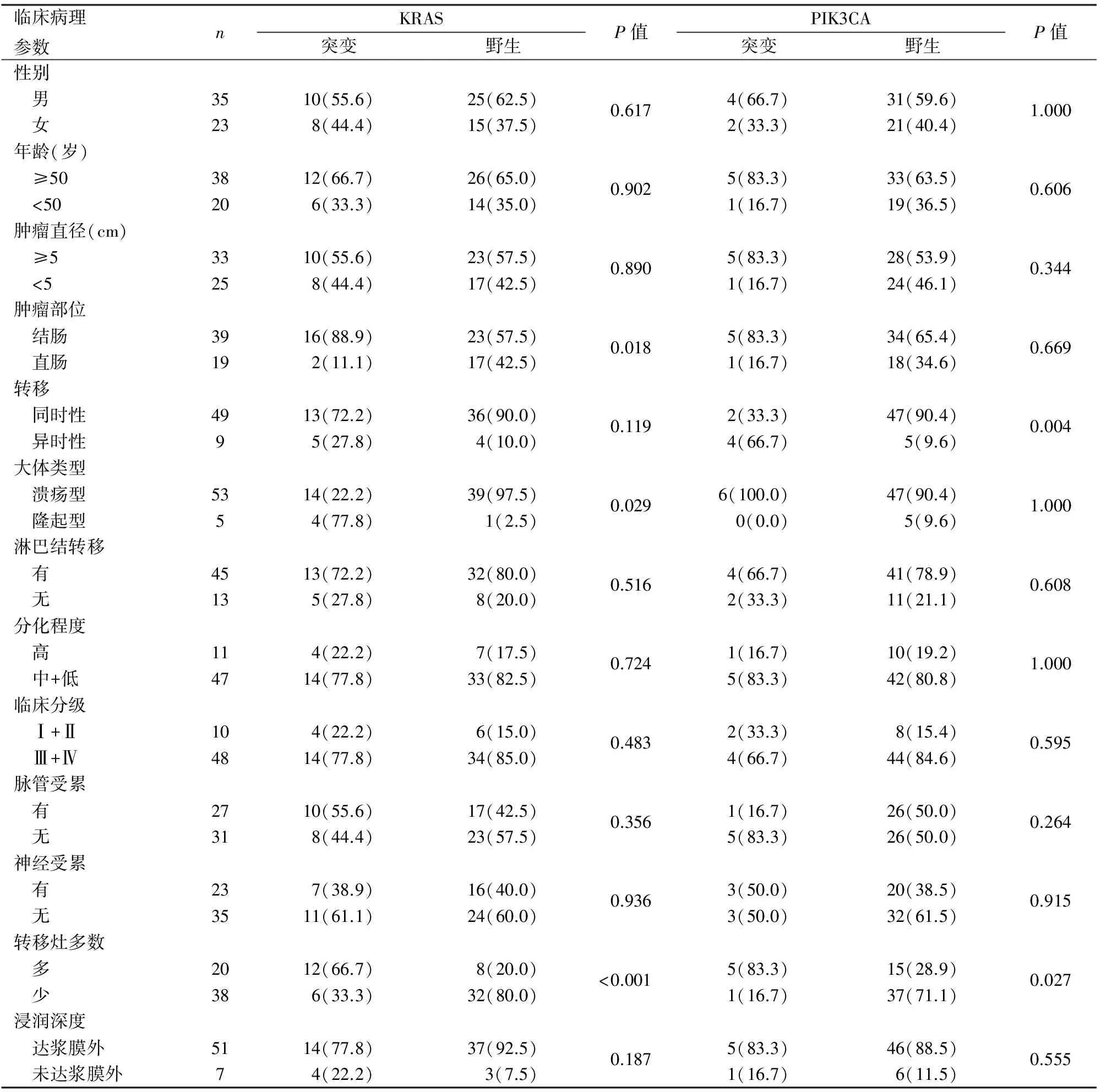
表1 KRAS、PIK3CA基因突变与结直肠癌临床病理特征的关系[n(%)]

图1 结直肠癌中KRAS突变型与野生型患者总生存曲线图
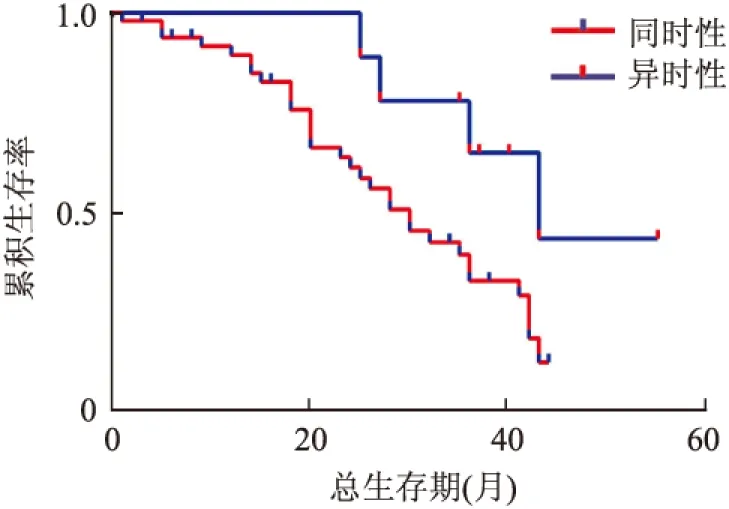
图2 结直肠癌中同时性/异时性肝转移患者总生存曲线图
3 讨论
结直肠癌的发生是机体一系列内外因素共同作用的结果,多数患者确诊时已是晚期,治疗效果和生存率不甚乐观。近年来,针对EGFR的靶向药物西妥昔单抗和帕尼单抗为KRAS野生型转移性结直肠癌患者带来了一线曙光。35%~40%转移性结直肠癌KRAS突变引起EGFR依赖的核内信号通路活化,导致患者对靶向治疗无效。治疗无效的原因除与PI3K途径中PIK3CA突变有关外,还可能与原发灶与肝转移灶间高水平瘤内、瘤间基因的异质性有关。肿瘤原发灶本身具有多项分化潜能,相应的肝转移灶也必然有基因型的改变,所以有待对其进行分析。

表2 18例结直肠癌患者KRAS基因突变情况
wt为野生型

表3 6例结直肠癌患者PIK3CA基因突变情况
wt为野生型

表4 结直肠癌原发灶和肝转移灶中KRAS、PIK3CA基因状态的一致性分析
本组实验结直肠癌原发灶与肝转移灶中KRAS基因的突变率分别为31.03%、25.86%,与文献报道19%~44%的突变率一致[4-6]。18例KRAS突变病例中,其中1例原发灶发生G12D突变,肝转移灶发生G12V突变,14例原发灶与肝转移灶均发生G12D突变,突变一致率为83.33%(15/18),这与既往报道结直肠癌原发灶与肝转移灶较高的一致性且主要突变位点为G12D相符[6-7]。原发灶与肝转移灶KRAS基因突变不一致的3例患者中原发灶发生G12D突变,肝转移灶未检测到任何突变,突变不一致率为16.67%(3/18)。由此可见,原发灶比肝转移灶KRAS突变率高,总体保持较高水平的一致性。KRAS基因可能发生在癌症进展的早期阶段,并参与肿瘤的侵袭、转移。生存分析结果显示,结直肠癌患者KRAS野生型比突变型OS延长,差异有统计学意义,提示KRAS基因状态可能是影响结直肠癌患者预后的重要指标。本实验结果显示KRAS突变好发于溃疡型结肠癌,与原发灶的肿瘤部位差异有统计学意义,与Nam等[8]报道的结果一致。KRAS突变还与转移灶多少相关,与患者年龄、分化程度、TNM分期等临床病理特征无关。
PIK3CA是PI3K/PTEN/AKT通路的关键基因,约4/5突变发生在exon9和exon20。PIK3CA突变存在于人体多种肿瘤中,突变率为9.9%~32%[5]。PIK3CA突变对生存率的影响将依赖KRAS的突变状态,但KRAS并不是预测EGFR疗效的独立因素[9]。本组实验结果显示,结直肠癌原发灶与肝转移灶中PIK3CA基因的突变率分别为8.62%、10.34%,6例发生PIK3CA突变的结直肠癌,3例原发灶与肝转移灶均发生E545K突变,1例原发灶与肝转移灶均发生E542K突变,突变一致率为66.67%(4/6)。Lee等[10]对比研究了结直肠癌原发灶和转移灶之间的PIK3CA基因型,发现约半数有相同的克隆来源,其余则显示出基因型的差异,强调需单独评估转移病灶来指导治疗。本组实验有1例发生KRAS、PIK3CA共突变,主要突变位点分别是G12D、E545K。1例原发灶发生PIK3CA基因E545K突变,肝转移灶发生H1047R突变。KRAS与PIK3CA基因共突变,exon9和exon20协同突变可能更易形成肝转移,但由于病例较少,缺乏有效的证据。文献报道PIK3CA基因exon9和exon20协同突变可赋予肿瘤更强的侵袭性,同时发生KRAS、PIK3CA突变者,易发生西妥昔单抗耐药,且可能与肝转移的形成有关[7,11]。本组实验PIK3CA突变与转移灶的数目、转移灶多少均相关,提示其突变可能与肝转移的发生有关。肝转移灶PIK3CA突变率比原发灶高,可能与PIK3CA基因在肿瘤发生发展的后期起作用有关。生存分析显示同时性/异时性肝转移及KRAS突变对结直肠癌患者OS有显著影响,是影响预后的危险因素。
文献报道对结直肠癌原发灶和肝转移灶KRAS、PIK3CA基因突变一致性存在争议。He等[12]的结果指出结直肠癌原发灶和肝转移灶中KRAS突变一致性较高,结直肠癌异时切除比同时切除PIK3CA突变率高,强调需要二次评估转移灶。Mao等[13]则认为原发灶和肝转移灶中KRAS、PIK3CA保持高度一致。Voutsina等[14]认为转移灶对于靶向治疗的选择更具有指导意义。本组实验数据显示结直肠癌原发灶与肝转移灶间KRAS、PIK3CA虽然存在一定程度基因型差异,但总体一致性较好,两者均可用于临床指导靶向治疗的组织来源。本实验由于样本量小,KRAS、PIK3CA之间的关系尚未有确切的结论,有待进一步扩大样本研究来证实。MSI和BRAF在Lynch综合征分类中扮演着重要的角色已经应用于临床,PIK3CA突变可作为阿司匹林辅助治疗结直肠癌的预测分子标志物[15]。
综上,本组实验提示结直肠癌原发灶与肝转移灶中KRAS、PIK3CA基因突变一致性较好,原发灶即可作为分子检测的标本来源。但靶向治疗针对的是转移灶,因此在可获取转移灶的情况下,需同时对转移灶进行评估,为临床精准靶向治疗提供可靠依据。我们相信分子靶向治疗将成为未来指导异质性肿瘤有潜力的治疗方案。
[1] Siegel R, Ma J, Zou Z,etal. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014,64(1):9-29.
[2] Kopetz S, Chang G J, Overman M J,etal. Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy[J]. J Clin Oncol, 2009,27(22):3677-3683.
[3] Normanno N, Tejpar S, Morgillo F,etal. Implications for KRAS status and EGFR-targeted therapies in metastatic CRC[J]. Nat Rev Clin Oncol, 2009,6(9):519-527.
[4] Baldus S E, Schaefer K L, Engers R,etal. Prevalence and heterogeneity of KRAS, BRAF, and PIK3CA mutations in primary colorectal adenocarcinomas and their corresponding metastases[J]. Clin Cancer Res, 2010,16(3):790-799.
[5] Janku F, Lee J J, Tsimberidou A M,etal. PIK3CA mutations frequently coexist with RAS and BRAF mutations in patients with advanced cancers[J]. PLoS One, 2011,6(7):e22769.
[6] 谢 玲, 陈 劼, 孙 怡, 等. 中国结直肠癌、肺癌和胃癌患者KRAS基因突变情况分析[J]. 临床与实验病理学杂志, 2016,32(2):210-213.
[7] Hsu H C, Thiam T K, Lu Y J,etal. Mutations of KRAS/NRAS/BRAF predict cetuximab resistance in metastatic colorectal cancer patients[J]. Oncotarget, 2016,7(16):22257-22270.
[8] Nam S K, Yun S, Koh J,etal. BRAF, PIK3CA, and HER2 oncogenic alterations according to KRAS mutation status in advanced colorectal cancers with distant metastasis[J]. PLoS One, 2016,11(3):e0151865.
[9] Ogino S, Nosho K, Kirkner G J,etal. PIK3CA mutation is associated with poor prognosis among patients with curatively resected colon cancer[J]. J Clin Oncol, 2009,27(9):1477-1484.
[10] Lee S Y, Haq F, Kim D,etal. Comparative genomic analysis of primary and synchronous metastatic colorectal cancers[J]. PLoS One, 2014,9(3):e90459.
[11] Liao X, Morikawa T, Lochhead P,etal. Prognostic role of PIK3CA mutation in colorectal cancer: cohort study and literature review[J]. Clin Cancer Res, 2012,18(8):2257-2268.
[12] He Q, Xu Q, Wu W,etal. Comparison of KRAS and PIK3CA gene status between primary tumors and paired metastases in colorectal cancer[J]. Onco Targets Ther, 2016,9:2329-2235.
[13] Mao C, Wu X Y, Yang Z Y,etal. Concordant analysis of KRAS, BRAF, PIK3CA mutations, and PTEN expression between primary colorectal cancer and matched metastases[J]. Sci Rep, 2015,5:8065.
[14] Voutsina A, Tzardi M, Kalikaki A,etal. Combined analysis of KRAS and PIK3CA mutations, MET and PTEN expression in primary tumors and corresponding metastases in colorectal cancer[J]. Mod Pathol, 2013,26(2):302-313.
[15] Liao X, Lochhead P, Nishihara R,etal. Aspirin use, tumor PIK3CA mutation, and colorectal-cancer survival[J]. N Engl J Med, 2012,367(17):1596-1606.
·简 讯·
敬告作者
本刊编辑部收到作者的投稿后,经初审符合本刊征稿内容者编辑部将及时发回执,注明稿件编号并通知作者交稿件处理费;对通过专家审核的稿件,在进行文字和撰写规范编辑加工后,发送“退修意见单”给第一作者;如作者的修回稿符合退修要求,则进入待用状态。编辑部将根据各期中心内容遴选稿件,并在排版后用E-mail发送校对样稿和缴纳版面费通知。编辑部咨询电话:0551-65161102,投稿邮箱:lcsybl@163.com。
Correlation of KRAS and PIK3CA gene status between primary tumors and paired metastases in colorectal cancer
HAN Dan-dan1, XI Yan-feng2, BAI Wen-qi2, GAO Ning2, WANG Li-li3
(1GraduateSchoolofShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofPathology,ShanxiCancerHospital,Taiyuan030013,China;3DepartmentofEndocrinology,ShanxiProvinceFenyangHospital,Fenyang032200,China)
Purpose To investigate the mutation status of KRAS and PIK3CA gene in colorectal cancer (CRC) primary lesions and corresponding liver metastasis and its clinical significance. Methods The gene mutations of KRAS and PIK3CA were detected in 58 cases of primary lesions of CRC and corresponding liver metastasis tissue by real-time PCR. Results The mutation rates of KRAS were 31.03% (18/58) and 25.86% (15/58) in primary lesions of CRC and corresponding liver metastasis tissue, respectively, in which G12D was most commonly detected. The mutation rates of PIK3CA were 8.62% (5/58) and 10.34%(6/58)respectively, in which the most common mutation site was E545K. Only one case carried simultaneously both mutations of KRAS (G12D) and PIK3CA (E545K). The mutation of KRAS and PIK3CA had a good consistency between primary lesions and liver metastasis. Univariate analysis showed that the mutation of KRAS was related to the primary lesion of tumor location, the quantity of metastasis and the types of tumor (P<0.05), PIK3CA mutation was associated with the synchronous/metachronous liver metastasis and the quantity of metastasis (P<0.05). Multivariate Cox regression analysis showed that synchronous/metachronous liver metastasis and the mutation of KRAS were influencing factors for prognosis of CRC. The overall survival of patients with CRC who had simultaneous liver metastases was longer than those with heterotopic liver metastases; the overall survival of KRAS wild-type mutant patients was longer than those of mutant patients(P<0.05). Conclusion The G12D site of KRAS gene has the highest mutation frequency in CRC, KRAS/PIK3CA mutation has a good consistency of the primary lesions of CRC and corresponding liver metastasis. Primary lesions can be as the source of molecular detection. To achieve individualized treatment, we need to reassess the genetic status of metastasis based on the choice of targeted therapy for precision medicine.
colorectal neoplasms; KRAS; PIK3CA; prognosis
山西省科技厅重点研发项目(201603D321049)、山西省卫生和计划生育委员会科研课题(2014052)
1山西医科大学研究生院,太原 0300012山西省肿瘤医院病理科,太原 0300133山西省汾阳医院内分泌科,汾阳 032200
韩丹丹,女,硕士研究生。E-mail: hdd0713mails@163.com 郗彦凤,女,硕士生导师,主任医师,通讯作者。E-mail: xyf609@sohu.com
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.004.html
R 735.3
A
1001-7399(2017)04-0369-06
10.13315/j.cnki.cjcep.2017.04.004
接受日期:2017-03-07
