MLH1、MSH2、MSH6和PMS2蛋白在结直肠癌中的表达及在Lynch综合征筛查中的意义
2017-06-05刘春样赵苏苏钱晓萍
李 惠,孙 怡,刘春样,赵苏苏,韩 梅,陈 劼,钱晓萍
MLH1、MSH2、MSH6和PMS2蛋白在结直肠癌中的表达及在Lynch综合征筛查中的意义
李 惠1,孙 怡1,刘春样1,赵苏苏1,韩 梅1,陈 劼1,钱晓萍2
目的 探讨错配修复(mismatch repair, MMR)蛋白MLH1、MSH2、MSH6和PMS2在结直肠癌中的表达及其临床意义。方法 采用免疫组化EnVision两步法检测102例结直肠癌组织中MLH1、MSH2、MSH6和PMS2蛋白表达缺失情况,分析蛋白表达缺失与结直肠癌临床病理特征的关系,并对其中20例进行微卫星不稳定(microsatellite instability, MSI)检测。结果 102例结直肠癌有15例(14.7%)发生MMR蛋白表达缺失,MLH1、MSH2、MSH6、PMS2蛋白表达缺失率分别为12.7%(13/102)、3.9%(4/102)、4.9%(5/102)、10.8%(11/102)。结直肠癌标本中MLH1、MSH2、MSH6、PMS2的蛋白表达缺失与患者性别、年龄、肿瘤大小、浸润深度、淋巴结转移无关(P>0.05);MLH1与PMS2蛋白表达缺失与组织学分化高低相关(P<0.05)。进行MSI检测的10例MMR蛋白缺失病例中有2例(2.0%)为高频微卫星不稳定(microsatellite instability-high, MSI-H),其余8例为微卫星稳定(microsatellite stability, MSS);另10例无MMR蛋白缺失的病例微卫星状态均为低频微卫星不稳定(microsatellite instability-low, MSI-L)/MSS。结论 免疫组化检测MLH1、MSH2、MSH6和PMS2的缺失可以用于Lynch综合征的初筛,对结直肠癌患者行MMR免疫组化检测和MSI联合检测可提高Lynch综合征的诊断率。
结直肠肿瘤;错配修复基因;Lynch综合征;免疫组织化学
结直肠癌发病率及病死率逐年升高,已成为位居全球男性第3位、女性第2位的高发恶性肿瘤。大部分结直肠癌是散发的,在临床工作中,年轻的结直肠癌患者需要排除遗传性结直肠癌。Lynch综合征是错配修复(mismatch repair, MMR)基因(MLH1、MSH2、MSH6、PMS2)胚系突变导致的遗传性结直肠癌,MMR蛋白突变者发生结直肠癌的几率为50%~80%[1]。研究显示美国的结直肠癌患者中2.8%确诊为Lynch综合征[2],不同研究显示结直肠癌人群中Lynch综合征比例变化很大(0.5%~13%)[3]。其发病机制和病死率区别于散发性结直肠癌,早期发现对治疗和预防有重大意义。然而Lynch综合征目前在国内尚未受到重视,日常的筛查工作尚未普及,导致许多Lynch综合征被归入散发性结直肠癌中。本文按照Lynch综合征的诊断流程,探讨国内Lynch综合征在结直肠癌中的发病率和MLH1、MSH2、MSH6和PMS2在结直肠癌中的表达及其在Lynch综合征筛查中的意义,为Lynch综合征的早期诊断提供科学依据。
1 材料与方法
1.1 材料 收集2014年2月~2015年8月南京中医药大学附属医院病理科存档的102例结直肠癌石蜡包埋标本,所有病例均经两位病理医师确诊为腺癌。其中男性65例,女性37例,年龄23~90岁,中位年龄60岁。左半结肠癌32例,右半结肠癌29例,直肠癌41例。36例高分化,40例中分化,26例低分化。34例有淋巴结转移,68例无淋巴结转移。
1.2 方法
1.2.1 免疫组化 标本均经10%中性缓冲福尔马林固定,常规脱水、石蜡包埋,3~4 μm厚切片,烤片后脱蜡,梯度乙醇脱水,采用免疫组化EnVision两步法检测MLH1、MSH2、MSH6和PMS2蛋白表达,所有抗体均购自福州迈新公司,用PBS液代替一抗作阴性对照。阳性染色定位于细胞核。
1.2.2 微卫星不稳定分析(microsatellite instability, MSI)检测 肿瘤组织蜡块切片,HE染色,选取肿瘤细胞,Qiagen公司试剂盒提取基因组DNA备用。同时提取患者相应的血液基因组DNA备用。以Lynch综合征国际合作组织统一推荐的5个微卫星检测位点:BAT26、BAT25、D2S123、D5S346和D17S250进行引物设计,由LifeTech公司合成标记,运用多重荧光PCR技术进行微卫星位点的扩增。反应体系为:15 μL TrueAllele PCR反应混合液,4 μL上、下游引物,1 μL基因组DNA。PCR循环条件:95 ℃预变性15 min,94 ℃变性60 s,56 ℃退火1 min,72 ℃延伸1 min,72 ℃充分延伸25 min,共30个循环。ABI 3500型基因分析仪对PCR产物进行比对,GeneMapper软件分析数据。
1.2.3 BRAF基因突变检测 常规提取、纯化DNA,PCR扩增后用3100-Avant遗传分析仪进行测序,Data Collection软件自动进行数据处理和分析。测序中若发现突变病例,需用反向引物进行反向测序验证。DNA Sequencing Analysis 5.1软件分析获取测序电泳图和序列。将样品序列用ABI SeqScape软件与Genebank标准序列进行比对,观察样本序列有无突变。
1.3 Lynch综合征的筛查 Lynch综合征的筛查流程详见图1。
1.4 统计学分析 所有数据采用SPSS 17.0软件进行统计学分析。定性资料的比较采用χ2检验或Fisher确切概率法进行显著性检验。P<0.05为差异有统计学意义。
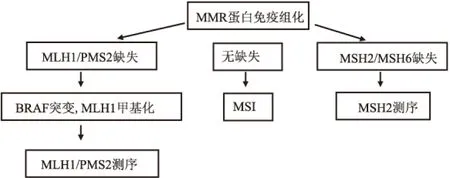
图1 Lynch综合征的筛查流程
2 结果
2.1 结直肠癌组织中MLH1、MSH2、MSH6、PMS2蛋白免疫组化表达缺失率 对102例结直肠癌组织进行MLH1、MSH2、MSH6、PMS2蛋白免疫组化检测。15例(14.7%)发生MMR蛋白表达缺失(图2)),其中8例为MLH1和PMS2蛋白表达缺失(男性7例,女性1例),中位年龄52岁;1例为MLH1、MSH2和MSH6蛋白表达缺失(女性);1例为MLH1、MSH2和PMS2蛋白表达缺失(女性);1例为MLH1蛋白表达缺失(男性);2例为MSH6蛋白表达缺失(男性);2例发生上述4种蛋白共同表达缺失(男女性各1例),中位年龄45岁。MLH1蛋白表达缺失率为12.7%(13/102);MSH2蛋白表达缺失率为3.9%(4/102);MSH6蛋白表达缺失率为4.9%(5/102);PMS2蛋白表达缺失率为10.8%(11/102)。MLH1和PMS2蛋白表达共同缺失率为10.8%(11/102),PMS2表达缺失的标本同时均伴有MLH1蛋白表达缺失。2例(2.0%)MSH6表达缺失。

MLH1MSH2MSH6PMS2阳性阴性
图2 结直肠癌组织中MLH1、MSH2、MSH6、PMS2蛋白的表达,EnVision两步法
2.2 MLH1、MSH2、MSH6、PMS2蛋白表达与结直肠癌临床病理特征的关系 结直肠癌组织中MLH1、MSH2、MSH6、PMS2蛋白表达缺失与患者性别、年龄、肿瘤大小、浸润深度、淋巴结转移无关(P>0.05),与肿瘤部位相关,右半结肠蛋白表达缺失明显高于左半结肠和直肠(P<0.05)。MLH1和PMS2的表达缺失与组织学分化相关(P<0.05)。MSH1和PMS2蛋白表达缺失率在低分化腺癌组织中明显高于中分化腺癌和高分化腺癌(P<0.05,表1)。

表1 MLH1、MSH2、MSH6、PMS2表达缺失与结直肠癌临床病理特征的关系
2.3 BRAF基因突变状态 按照筛查流程,有13例发生MLH1/PMS2蛋白表达缺失的结直肠癌患者进行了BRAF基因第15号外显子测序分析,发现1例BRAF基因第15号外显子V600E突变,其余12例BRAF基因第15号外显子未发现病理性突变。
2.4 MSI检测结果 随机抽取20例结直肠癌患者进行了MSI检测,其中10例发生MMR蛋白表达缺失,另10例无MMR蛋白表达缺失。结果显示发生MMR蛋白表达缺失的病例中2例肿瘤组织处于高频微卫星不稳定(microsatellite instability-high, MSI-H)(图3),其余8例为微卫星稳定(microsatellite stability, MSS);无MMR蛋白表达缺失的10例病例显示均为低频微卫星不稳定(microsatellite instability-low, MSI-L)/MSS。

图3 MSI检测结直肠癌中MMR蛋白表达的缺失A. 血液;B. 肿瘤组织
3 讨论
Lynch综合征是一种常染色体显性遗传性疾病,患者发病年龄早,右半结肠多见,常伴有肠外肿瘤如子宫内膜癌、卵巢癌、胃癌、泌尿系统肿瘤、胰腺癌等,组织学特点表现为差分化、黏液样或印戒细胞样、髓样癌生长方式、淋巴细胞浸润等。早期筛查和干预能有效降低Lynch综合征的病死率。Lynch综合征发生于1%~3%的结直肠癌及1%~4%的子宫内膜癌中,日常工作中需对结直肠癌患者进行筛查以鉴别散发性结直肠癌和Lynch综合征。2004年提出Bethesda修订标准[4],指出具有以下情况的患者需进行Lynch综合征MSI筛查:(1)家族中1名患者50岁前诊断为结直肠癌;(2)发现同时性和异时性多原发结直肠癌和与Lynch综合征相关的肿瘤患者,不论发病年龄;(3)<60岁诊断的结直肠癌患者曾伴MSI-H;(4)至少1个一级亲属诊断出Lynch综合征相关肿瘤(其中1例确诊年龄<50岁)的家族中发现结直肠癌患者;(5)至少2个一级和二级亲属确诊有Lynch综合征相关肿瘤(不论发病年龄)。而ESMO和NCCN建议对70岁以下结直肠癌患者行Lynch综合征筛查[5-6]。
Lynch综合征初筛主要依靠MMR蛋白免疫组化检测和MSI检测。MMR蛋白免疫组化检测包括MLH1、MSH2、MSH6和PMS2,Wan等研究[7]显示17例可疑Lynch综合征的结直肠癌患者中4例MLH1表达缺失,5例PMS2表达缺失,MSH2和MSH6各2例表达缺失,表明免疫组化是方便易行且较敏感的初筛方法。彭勇等[8]研究了MLH1、MSH2、PMS2和MSH6蛋白在云南地区Lynch综合征家系结直肠癌的表达情况,发现4种MMR蛋白总的表达缺失率为84.62%。若出现上述蛋白缺失则提示需进一步行基因检测排除Lynch综合征。若上述4种蛋白阳性,则行MSI检测。MSI检测包括BAT-25、BAT-26、D2S123、D5S346、D17S250共5个微卫星位点,肿瘤组织与正常对照比较,出现荧光信号移动或数目改变为MSI,如果出现≥2个位点不稳定者为MSI-H,只有1个位点不稳定为MSI-L,无任何位点的变化为MSS。MSI是Lynch综合征的重要分子标志,研究显示>95%的Lynch综合征相关的结直肠癌为MSI-H[9]。当受检者肿瘤组织中出现MSI-L和MSS时,提示诊断为Lynch综合征可能性较低。
目前国内对于Lynch综合征的筛查检测还未普及,许多临床医师尚未充分认识该疾病,MMR蛋白免疫组化检测尚未纳入结直肠癌术后常规检测项目,事实上只对满足Bethesda诊断标准的患者进行筛查将会漏诊一部分Lynch综合征患者。2015年美国临床肿瘤学会遗传性结直肠癌综合征临床实践指南提出[10],采用免疫组化筛查结直肠癌标本,当MLH1/PMS2蛋白表达缺失或MSI-H时,需行MLH1甲基化检测以及BRAF基因V600E突变检测,两者均阴性时行MLH1基因测序;当MSH2/MSH6表达缺失时,需行MSH2基因测序;当4种蛋白均表达正常时,建议MSI检查,并结合家族史行进一步评估。研究显示BRAF基因突变发生在91%的MSI-H散发性结直肠癌中,而在Lynch综合征相关结直肠癌中几乎不发生突变,故BRAF基因突变可排除Lynch综合征相关结直肠癌[11]。同样,MLH1启动子甲基化多与散发性结直肠癌MSI相关,故亦可排除Lynch综合征[12]。Lynch综合征最终确诊依赖MMR基因突变检测,国外研究[1]显示Lynch综合征中MLH1 (32%)和MSH2(38%)突变占多数,MSH6(14%)和PMS2(15%)突变占少数。
本组实验中所有确诊的结直肠癌患者均行免疫组化初筛检测,结果显示102例结直肠癌组织中MMR蛋白缺失率为14.7%(15/102),与国外研究结果一致(19%)。发生MLH1/PMS2蛋白表达缺失的结直肠癌患者随后进行了BRAF基因突变检测,显示1例突变,提示可排除Lynch综合征相关性结直肠癌。15例发生MMR蛋白表达缺失的病例中10例进行MSI检测,其中2例微卫星状态为MSI-H,高度怀疑Lynch综合征,建议患者行MLH1和MSH2全基因测序检测,随访发现其中1例并发子宫内膜癌。而本文检测的未发生MMR蛋白缺失的病例微卫星状态均为MSI-L/MSS,提示MMR蛋白缺失是Lynch综合征的重要特征且和微卫星状态密切相关。MMR蛋白缺失不仅提示Lynch综合征,还可能成为预测结直肠癌化疗疗效及预后的指标,对结直肠癌患者进行MMR蛋白表达检测具有重要意义。2016年美国ASCO年会报告的美国SEER数据库资料显示肿瘤部位是Ⅲ/IV期结直肠癌独立的预后因素,右半结肠相对于左半结肠和直肠死亡风险显著增高。本组实验结果显示MLH1、MSH2、MSH6、PMS2蛋白表达缺失与结直肠癌患者性别、年龄、肿瘤大小、浸润深度、淋巴结转移无关(P>0.05),与肿瘤部位相关,右半结肠蛋白表达缺失明显高于左半结肠和直肠(P<0.05),也提示MMR蛋白表达状态与结直肠癌预后相关。在筛查过程中,由于经济原因,患者通常更愿意接受免疫组化检测。免疫组化检测虽然特异性不如MSI检测,但费用低廉,更适用于临床初筛Lynch综合征患者。而MSI检测在Lynch综合征筛查中亦有至关重要的作用,符合Bethesda诊断标准的病例应行MSI检测。除此以外,MSI检测还能够预测结直肠癌化疗效果。研究显示MSS/MSI-L提示对5-FU类化疗获益,但肿瘤较易复发。MSI-H提示患者对5-FU化疗获益受限,生存期预后相对较长[13-14]。
综上所述,MLH1、MSH2、MSH6、PMS2蛋白缺失在结直肠癌患者中并不少见,提高临床医师对Lynch综合征的认识,积极进行免疫组化初步筛查,提倡对所有结直肠癌患者特别是<60岁患者同时或异时发生结直肠癌和其他恶性肿瘤进行筛查[15],MMR蛋白免疫组化检查配合MSI检测,可以帮助早期发现Lynch综合征患者及其家系,提高诊断率,早期预防,减少结直肠癌的发病率和病死率。
[1] Palomaki G E, McClain M R, Melillo S,etal. EGAPP supplementary evidence review: DNA testing strategies aimed at reducing morbidity and mortality from Lynch syndrome[J]. Genet Med, 2009,11(1):42-65.
[2] Sapari N S, Elahi E, Wu M,etal. Feasibility of low-throughput next generation sequencing for germline DNA screening[J]. Clin Chem, 2014,60(12):1549-1557.
[3] Kumamoto K, Ishida H, Suzuki O,etal. Lower prevalence of Lynch syndrome in colorectal cancer patients in a Japanese hospital-based population[J]. Surg Today, 2016,46(6):713-720.
[4] Serrano M, Lage P, Belga S,etal. Bethesda criteria for microsatellite instability testing: impact on the detection of new cases of Lynch syndrome[J]. Fam Cancer, 2012,11(4):571-578.
[5] Balmana J, Balaguer F, Cervantes A,etal. Familial risk-colorectal cancer: ESMO clinical practice guidelines[J]. Ann Oncol, 2013,24 Suppl 6:vi73-vi80.
[6] Burt R W, Barthel J S, Dunn K B,etal. NCCN clinical practice guidelines in oncology. Colorectal cancer screening[J]. J Natl Compr Canc Netw, 2010,8(1):8-61.
[7] Wan Juhari W K, Wan Abdul Rahman W F, Mohd Sidek A S,etal. Analysis of hereditary nonpolyposis colorectal cancer in malay cohorts using immunohistochemical screening[J]. Asian Pac J Cancer Prev, 2015,16(9):3767-3771.
[8] 彭 勇, 武治国, 毛剑峰, 等. MMR蛋白在云南地区遗传性非息肉病性大肠癌中的表达及意义[J]. 肿瘤防治研究, 2011,38(3):270-273.
[9] Pino M S, Chung D C. Application of molecular diagnostics for the detection of Lynch syndrome[J]. Expert Rev Mol Diagn, 2010,10(5):651-665.
[10] Stoffel E M, Mangu P B, Gruber S B,etal. Hereditary colorectal cancer syndromes: American Society of Clinical Oncology Clinical Practice Guideline endorsement of the familial risk-colorectal cancer: European Society for Medical Oncology Clinical Practice Guidelines[J]. J Clin Oncol, 2015,33(2):209-217.
[11] Steinke V, Engel C, Buttner R,etal. Hereditary nonpolyposis colorectal cancer (HNPCC)/Lynch syndrome[J]. Dtsch Arztebl Int, 2013,110(3):32-38.
[12] Lochhead P, Kuchiba A, Imamura Y,etal. Microsatellite instability and BRAF mutation testing in colorectal cancer prognostication[J]. J Natl Cancer Inst, 2013,105(15):1151-1156.
[13] Benson A B , Venook A P, Bekaii-Saab T,etal. Colon cancer, version 3.2014[J]. J Natl Compr Canc Netw, 2014,12(7):1028-1059.
[14] Saridaki Z, Souglakos J, Georgoulias V. Prognostic and predictive significance of MSI in stages II/III colon cancer[J]. World J Gastroenterol, 2014,20(22):6809-6814.
[15] 彭 勇, 谭小勇, 罗岳西, 等. 子宫内膜癌MMR蛋白检测在筛选HNPCC家系中的作用[J]. 临床与实验病理学杂志, 2013,29(12):1317-1319.
Expression of MLH1, MSH2, MSH6 and PMS2 in colorectal cancer and their role in the screening of Lynch syndrome
LI Hui1, SUN Yi1, LIU Chun-yang1, ZHAO Su-su1, HAN Mei1, CHEN Jie1, QIAN Xiao-ping2
(1DepartmentofPathology,theAffiliatedHospitalofNanjingUniversityofChineseMedicine,Nanjing210029,China;2DepartmentofOncology,theAffiliatedHospitalofNanjingUniversity,Nanjing210008,China)
Purpose To investigate the expression of mismatch repair proteins MLH1, MSH2, MSH6 and PMS2 and their clinical significance in colorectal cancer. Methods Immunohistochemical analysis was used to detect MLH1, MSH2, MSH6 and PMS2 protein expression in formalin-fixed paraffin-embedded tissues from 102 colorectal cancer patients, and microsatellite instability (MSI) was tested in 20 cases. The relationship between MMR protein expression and clinical pathological features was also analyzed. Results 15 cases (14.7%) had MMR protein loss. The loss rate of MLH1, MSH2, MSH6 and PMS2 protein was 12.7% (13/102), 3.9% (4/102), 4.9% (5/102) and 10.8% (11/102), respectively. MLH1, MSH2, MSH6 and PMS2 protein losses were not related with gender, age, tumor size, depth of invasion and lymph node metastasis (P>0.05). MLH1 and PMS2 protein losses were related to histological differentiation (P<0.05). MSI was detected in 10 Lynch syndrome candidates. 2 cases (2.0%)of high-frequency microsatellite instability (MSI-H) were identified, and the remaining 8 cases were MSS. However, 10 cases without MMR expression abnormality all showed MSI-L/MSS. Conclusion Immunohistochemical detection of MLH1, MSH2, MSH6 and PMS2 can be used as primary screening for Lynch syndrome and its combination with MSI test can effectively increase the diagnostic rate in Lynch syndrome.
colorectal neoplasms; mismatch repair gene; Lynch syndrome; immunohistochemistry
江苏省高校优势学科建设工程资助(012062003010)
1南京中医药大学附属医院病理科,南京 2100292南京大学附属鼓楼医院肿瘤中心,南京 210008
李 惠,女,博士,主治医师。E-mail: lihui19830401@163.com 钱晓萍,女,博士,主任医师,通讯作者。E-mail: Qianxiaoping211@hotmail.com
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.002.html
R 735.3
A
1001-7399(2017)04-0360-05
10.13315/j.cnki.cjcep.2017.04.002
接受日期:2017-02-09
