肿瘤BRCA1亚细胞定位对细胞放射线及PARP抑制剂敏感性的影响
2017-06-05姜桔红顾莹莹
姜桔红,刘 静,李 智,顾莹莹
肿瘤BRCA1亚细胞定位对细胞放射线及PARP抑制剂敏感性的影响
姜桔红1,刘 静1,李 智2,顾莹莹1
目的 探讨肿瘤BRCA1细胞内定位对放射线和PARP抑制剂敏感性的影响。方法 采用siRNA干扰抑制乳腺癌细胞株MCF7内源性BRCA1表达,转染BRCA1细胞内定位不同的载体:pCMV-3xFlag-WT-BRCA1、pCMV-3xFlag-NES-BRCA1、pCMV-3xFlag-NLS-BRCA1。采用免疫荧光法检测BRCA1的细胞定位及细胞核γ-H2AX和Rad51核焦点形成,应用流式细胞技术检测细胞凋亡,克隆形成实验检测体外细胞存活。结果 转染WT-BRCA1有47%细胞核表达,23%细胞质表达,30%细胞质和细胞核均表达,NES-BRCA1 mutant表达主要定位于细胞核(87%);NLS-BRCA1 mutant定位于细胞质(82%)。WT-BRCA1、NES-BRCA1 mutant和NLS-BRCA1 mutant三种载体转染的细胞4 Gy放射处理后2 h,Rad51核焦点阳性细胞数分别为87%、84%及13%;放射后24 h,γ-H2AX核焦点阳性细胞分别为22%、25%及59%。NLS-BRCA1 mutant转染细胞较WT-BRCA1和NES-BRCA1 mutant转染细胞ABT-888和放射处理后诱导的凋亡细胞增加,克隆存活减少。结论 BRCA1的细胞内定位影响DNA双链断裂同源重组修复,并可预测肿瘤对放射和PARP抑制剂的敏感性。
BRCA1亚细胞定位;同源重组修复;放射;PARP抑制剂
聚腺苷二磷酸核糖基聚合酶(poly ADP-ribose polymerase, PARP)是DNA单链断裂修复途径的重要酶[1-2]。PARP抑制剂如Olaparib抑制单链断裂的碱基切除修复途径,未修复的单链断裂在复制叉形成位点将形成DNA双链断裂,PARP抑制剂是双链断裂修复功能缺陷细胞的靶向药物,该药对携带BRCA1或BRCA2基因突变的肿瘤细胞表现出1 000倍以上的杀伤活性,可治疗与BRCA1或BRCA2基因突变相关的家族性乳腺癌、卵巢癌等[3-6]疾病。然而,90%以上的乳腺癌患者属于散发性,不存在BRCA1或BRCA2基因突变,无双链断裂修复功能缺陷,因此不能从该药物中获益。文献报道[7-9]BRCA1为穿梭蛋白,通过在细胞各部分间的穿梭来调节其功能,胞核BRCA1主要参与DNA修复和细胞周期检测点调节,而胞质BRCA1有调节中心粒功能和不依赖p53的凋亡途径。本文着重探讨pCMV-3xFlag-WT-BRCA1、pCMV-3xFlag-NES-BRCA1、pCMV-3xFlag-NLS-BRCA1三种穿梭功能不同的BRCA1表达载体,分别转染MCF7细胞后的BRCA1定位情况、同源重组修复能力以及放射和PARP抑制剂敏感性。
1 材料与方法
1.1 主要试剂 DMEM培养基、胎牛血清、胰蛋白酶、青链霉素购自广州Life公司。抗体及其它试剂盒:anti-BRCA1 mouse mAb、phospho-Histone H2AX、Rad51、 anti-rabbit IgG、ab2 Fragment Alexa Flour 488 conjugated、FuGENE HD、Annexin V-FITC Apoptosis Detection kit、ABT-888。
1.2 质粒和转染 表达载体pCMV-3xFlag-WT-BRCA1、pCMV-3xFlag-NES-BRCA1、pCMV-3xFlag-NLS-BRCA1,由Fen Xia教授惠赠。BRCA1 siRNA干扰序列为Brca1-6176 CCCTAAGTTTACTTCTCTA、Brca1-5787 GCTCCTCTCACTCTTCAGT,siRNA由上海生工公司合成。
1.3 细胞培养 MCF7细胞购自中国科学院上海生命科学研究院细胞资源中心,培养基采用含10%胎牛血清、100 U/mL的青链霉素的DMEM培养基,37 ℃、5%CO2饱和湿度的条件下培养。
1.4 照射条件 照射采用西门子直线加速器ONCOR(6MV)X-ray,剂量率为2 Gy/min。假照处理为放置细胞培养板在仪器的载物台上同等时间,但不启动机器照射。
1.5 siRNA干扰和质粒转染 siRNA转染采用上海生工公司的RNAi-Mate,并根据试剂盒说明书转染。质粒转染采用FuGene HD,并根据试剂盒说明书进行转染。
1.6 免疫荧光 细胞接种至已放有圆形盖玻片的24孔培养板中进行处理,PBS洗涤5 min,10%中性福尔马林固定15 min,PBS洗涤5 min×2次;含0.2% Triton-X100的PBS(PBS W/0.2%TX)破膜15 min;羊血清工作液封闭45 min;抗Rad51、γ-H2AX或BRCA1一抗4 ℃孵育过夜,PBS(W/0.1%TX)洗涤5 min×3次;二抗室温作用1 h,PBS(W/0.1%TX)洗涤5 min×3次;1 μg/mL DAPI染细胞核2 min,PBS(W/0.1%TX)洗涤5 min×3次;甘油封固,荧光显微镜下观察。
1.7 凋亡分析 采用Annexin V-FITC Apoptosis Detection kit试剂盒及流式细胞仪分析细胞凋亡。细胞进行处理后,先收集上清中的悬浮细胞,然后0.25%胰蛋白酶液消化贴壁细胞,置于10%FBS培养基中和胰酶后离心沉淀细胞,PBS洗涤细胞2次,用1×结合缓冲液重悬细胞并调整细胞浓度为每毫升106个细胞。将100 μL细胞悬液移至流式细胞分析试管,加5 μL FITC Annexin V,5 μL PI(50 μg/mL),轻摇混匀细胞,室温避光放置15 min,然后加1×结合缓冲液400 μL,在1 h内进行流式细胞分析。除实验组、阴性对照组、阳性对照组,还需准备3管细胞作为设定流式的参数,包括无染色细胞、FITC Annexin V染色细胞、PI染色细胞。
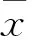
2 结果
2.1 BRCA1的细胞内定位影响DNA双链断裂同源重组修复 无BRCA1突变的MCF7细胞4 Gy放射后2 h,95%的BRCA1表达于胞核的细胞可见Rad51核焦点形成,而仅有15%的BRCA1表达于胞质细胞可见Rad51核焦点形成。放射后24 h,37%的BRCA1定位在胞质细胞γ-H2AX核焦点阳性,14%的BRCA1定位在胞核的细胞γ-H2AX核焦点阳性(表1,图1)。Rad51核焦点的形成是细胞DNA损伤后同源重组修复途径活化的标志物。γ-H2AX核焦点主要形成于未修复的双链断裂断端,是双链断裂的原位标记,γ-H2AX核焦点的持续存在表明双链断裂未能被修复,提示BRCA1的细胞内定位影响放射后的双链断裂同源重组修复。
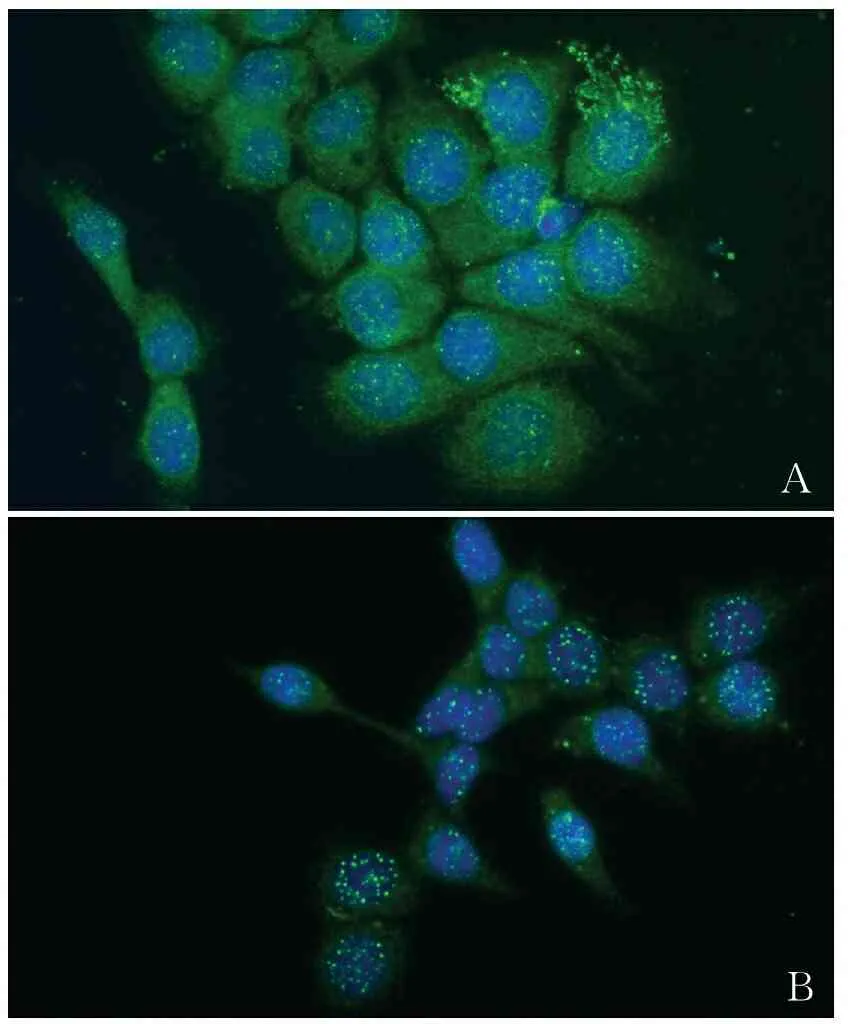
AB

图1 A.Rad51核焦点形成;B.γ-H2AX核焦点形成
与BRCA1定位胞核细胞比较,**P<0.01
2.2 BRCA1出核序列变异影响BRCA1在细胞内的定位及DNA双链断裂重组修复 为进一步证明BRCA1的细胞内定位影响DNA双链断裂重组修复,我们用针对内源性BRCA1 mRNA的5′非翻译区序列的siRNA抑制MCF7细胞内源性野生型BRCA1的表达,再转染不受siRNA干扰作用的穿梭功能不同的外源性BRCA1表达载体,包括WT-BRCA1、NES-BRCA1 mutant、NLS-BRCA1 mutant。免疫荧光检测三种BRCA1表达载体在细胞内的定位情况,WT-BRCA1有47%细胞呈胞核表达,23%细胞呈胞质表达,30%细胞呈胞质和胞核均表达(表2)。与WT-BRCA1相比,NLS-BRCA1 mutant表达主要定位在细胞质(82%);NES-BRCA1 mutant表达主要在胞核(87%)。

表2 3种表达载体转染MCF7细胞的细胞内定位
与WT-BRCA1转染细胞比较,**P<0.01
3种载体转染细胞4 Gy放射处理后2 h,转染WT-BRCA1、NES-BRCA1 mutant和NLS-BRCA1 mutant细胞Rad51核焦点阳性细胞分别为87%、84%及13%;放射处理后24 h,转染WT-BRCA1、NES-BRCA1 mutant和NLS-BRCA1 mutant细胞γ-H2AX核焦点阳性细胞分别为22%、 25%及59%。 以上结果表明:BRCA1定位在胞核细胞比BRCA1定位在胞质细胞的同源重组修复双链断裂能力强,未修复双链断裂量少(表3)。

表3 3种表达载体转染MCF7细胞放射后
与WT-BRCA1及NES-BRCA1 mutant转染细胞比较,**P<0.01
2.3 BRCA1的细胞内定位影响细胞的放射敏感性和PARP抑制剂敏感性 3种载体转染细胞给予4 Gy放射处理或ABT-888(10 μmol/L)处理,48 h后收集细胞,Annexin V-FITC和PI染色后进行流式细胞仪检测细胞凋亡量。转染WT-BRCA1、NES-BRCA1 mutant和NLS-BRCA1 mutant细胞ABT-888(10 μmol/L)诱导的细胞凋亡分别为4%、5%及14.5%;转染WT-BRCA1、NES-BRCA1 mutant和NLS-BRCA1 mutant细胞,4 Gy放射处理诱导的细胞凋亡分别为6.7%、7.5%及19%(表4)。

表4 3种表达载体转染MCF7细胞放射和
与WT-BRCA1及NES-BRCA1 mutant转染细胞比较,**P<0.01
克隆形成实验进一步验证3种载体转染细胞的PARP抑制剂和放射敏感性。转染WT-BRCA1和NES-BRCA1 mutant细胞对ABT-888各浓度均不敏感,但转染NLS-BRCA1 mutant细胞随着ABT-888浓度增加克隆存活明显减少(图2)。转染WT-BRCA1和NES-BRCA1 mutant随放射剂量增加克隆存活逐渐减少,但转染NLS-BRCA1 mutant细胞随着放射剂量增加克隆存活减少更为显著。
3 讨论
PARP抑制剂是正在广泛研究的潜在治疗乳腺癌和卵巢癌的口服化疗药物,主要用于治疗BRCA1或BRCA2突变相关的肿瘤。在Ⅱ期临床实验中41%(11/27)的携带有BRCA1或BRCA2基因遗传性突变的乳腺癌患者对PARP抑制剂治疗有反应[6]。但只有10%乳腺癌患者与BRCA1或BRCA2基因遗传性突变有关,90%以上乳腺癌患者属于散发性,不存在BRCA1或BRCA2基因突变。此结果表明BRCA1在细胞内的定位影响其同源重组修复功能及PARP抑制剂敏感性;BRCA1定位于胞质的细胞较BRCA1定位于胞核的细胞PARP抑制剂敏感性增高。BRCA1定位将成为预测PARP抑制剂敏感性的生物学标志物。
BRCA1是第一个克隆的与乳腺癌及卵巢癌易感性相关的肿瘤抑制基因[10]。50%的遗传性乳腺癌患者及90%的有乳腺癌和卵巢癌易感性的家族携带者有生殖细胞BRCA1基因突变。BRCA1位于染色体17q21,是具有24个外显子的长基因,编码1 863个氨基酸残基的蛋白[11]。BRCA1蛋白的氨基末端有个环状(RING)结构域,羧基末端有卷曲螺旋结构和串联的BRCT重复结构,这些结构均为BRCA1参与DNA损伤反应和修复信号转导提供条件。BRCA1通常与也具有RING/BRCT结构域的乳腺癌相关蛋白BARD1结合成二聚体[12]。BRCA1参与细胞的多种功能和信号转导,包括:DNA复制、DNA修复、转录调控、细胞周期调控点控制、细胞凋亡、蛋白泛素化等;这些功能的缺失将有可能导致肿瘤的发生[13]。DNA损伤修复对细胞的增殖和存活非常重要,BRCA1参与多种DNA修复途径,其中最重要的是双链断裂的同源重组修复。细胞DNA发生双链断裂后,最先在DNA双链断裂处启动的是组蛋白H2AX的磷酸化,形成γ-H2AX,然后γ-H2AX结合BRCA1、Rad50、Rad51、Rad54、BRCA2、MSN复合物等启动DNA损伤修复的级联反应[14]。
A


图2 3种表达载体转染MCF7细胞,放射和ABT-888处理后的克隆存活:A.克隆形成;B.3种表达载体转染MCF7细胞放射后细胞克隆形成率;C.ABT-888处理后的细胞克隆形成率
BRCA1是穿梭蛋白,可通过控制其在各个细胞器的穿梭调节其功能。BRCA1通过2个位于蛋白中段的细胞核定位信号(NLS)与输入蛋白(importin)的a/β转运系统结合进入胞核[15];BRCA1通过氨基末端RING结构区的2个核输出信号序列(NES)与CRM1/输出蛋白(Exportin)结合到胞质[8,16]。通过在BRCA1 mutant的NLS和NES结构域引入突变构建穿梭功能不同的外源性BRCA1表达载体。WT-BRCA1在胞核和胞质均有表达;NES-BRCA1 mutant无出核功能,主要聚集在胞核;NLS-BRCA1 mutant无入核功能,主要聚集在胞质。放射处理后2 h,转染WT-BRCA1和NES-BRCA1 mutant细胞Rad51核焦点形成较多;转染NLS-BRCA1 mutant细胞Rad51核焦点形成较少。放射处理后24 h,WT-BRCA1和NES-BRCA1 mutant细胞较转染NLS-BRCA1 mutant细胞γ-H2AX核焦点明显减少。Rad51核焦点的形成是细胞DNA损伤后同源重组修复途径活化的标志物。γ-H2AX核焦点主要形成于未修复的双链断裂断端,是双链断裂的原位标记,γ-H2AX核焦点的持续存在表明双链断裂未能被修复。此结果证明NES-BRCA1 mutant、NLS-BRCA1 mutant的突变影响BRCA1定位,定位在胞核的细胞较BRCA1定位在胞质的细胞DNA双链断裂损伤修复能力强,未修复的DNA损伤量少。
三种载体转染细胞给予4 Gy放射处理或ABT-888处理后,转染WT-BRCA1和NES-BRCA1 mutant细胞处理后的凋亡细胞量均较少,转染NLS-BRCA1 mutant细胞处理后的凋亡细胞量明显增加。克隆形成实验进一步验证了转染WT-BRCA1和NES-BRCA1 mutant对放射和ABT-888不敏感;转染NLS-BRCA1 mutant细胞对放射和ABT-888的杀伤作用更敏感。已有研究表明乳腺癌相关蛋白BARD1的氨基末端有1个CRM1依赖的NES序列参与其蛋白的出核。Yang等[13]报道诱导BARD1出核也可使细胞凋亡增加,与本实验结果一致。
综上所述,BRCA1在细胞内的定位可影响其同源重组介导的双链断裂修复功能,并可预测肿瘤对放射和PARP抑制剂的敏感性。诱导BRCA1出核将可增加细胞对放射和PARP抑制剂的敏感性。
[1] Dantzer F, Schreiber V, Niedergang C,etal. Involvement of poly (ADP-ribose) polymerase in base excision repair[J]. Biochimie, 1999,81(1-2):69-75.
[2] Ame J C, Spenlehauer C, de Murcia G. The PARP superfamily[J]. Bioessays, 2004,26(8):882-893.
[3] Farmer H, McCabe N, Lord C J,etal. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy[J]. Nature, 2005,434(7035):917-921.
[4] 朱亚宁,吴 健,周武碧,张智弘. 三阴型乳腺癌中BRCA1的表达及其预后意义[J]. 临床与实验病理学杂志, 2015,31(7):740-743.
[5] Fong P C, Boss D S, Yap T A,etal. Inhibition of poly (ADP-ribose) polymerase in tumors from BRCA mutation carriers[J]. N Engl J Med, 2009,361(2):123-134.
[6] Tutt A, Robson M, Garber J E,etal. Oral poly (ADP-ribose) polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and advanced breast cancer: a proof-of-concept trial[J]. Lancet, 2010,376(9737):235-244.
[7] Scully R, Chen J, Och R L,etal. Dynamic changes of BRCA1 subnuclear location and phosphorylation state are initiated by DNA damage[J]. Cell, 1997,90(3):425-435.
[8] Rodriguez J A, and Henderson B R. Identification of a functional nuclear export sequence in BRCA1[J]. J Biol Chem, 2000,275(49):38589-38596.
[9] Jiang J H, Yang E S, Jiang G C,etal. p53-dependent BRCA1 nuclear export controls cellular susceptibility to DNA damage[J]. Cancer Res, 2011,71(16):5546-5557.
[10] Miki Y, Swensen J, Shattuck-Eidens D,etal. A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1[J]. Science, 1994,266(5182):66-71.
[11] Couch F J, Weber B L. Mutations and polymorphisms in the familial early-onset breast cancer (BRCA1) gene[J]. Breast Cancer Information Core[J]. Hum Mutat, 1996,8(1):8-18.
[12] Rodriguez J A, Schüchner S, Au W W,etal. Nuclear-cytoplasmic shuttling of BARD1 contributes to its proapoptotic activity and is regulated by dimerization with BRCA1[J]. Oncogene, 2004,23(10):1809-1820.
[13] Yang E S, Xia F. BRCA1 16 years later: DNA damage-induced BRCA1 shuttling[J]. FEBS J, 2010,277(15):3079-3085.
[14] Au W W, Henderson B R. The BRCA1 RING and BRCT domains cooperate in targeting BRCA1 to ionizing radiation-induced nuclear foci[J]. J Biol Chem, 2005,280(8):6993-7001.
[15] Chen C F, Li S, Chen Y,etal. The nuclear localization sequences of the BRCA1 protein interact with the importin-αsubunit of the nuclear transport signal receptor[J]. J Biol Chem, 1996,271(51):32863-32868.
[16] Thompson M E, Robinson-Benion C L, Holt J T. An amino-terminal motif functions as a second nuclear export sequence in BRCA1[J]. J Biol Chem, 2005,280:21854-21857.
theFirstAffiliatedHospital,GuangzhouMedicalUniversity,Guangzhou510120,China;2DepartmentofPathology,theFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China)
The effect of subcellular localization of tumor BRCA1 on the sensitivity of cell radiation and PARP inhibitor
JIANG Ju-hong1, LIU Jing1, LI Zhi2, GU Ying-ying1
(1TheStateKeyLaboratoryofRespiratoryDisease,GuangzhouInstituteofRespiratoryDisease,
Purpose To investigate the effect of subcellular location of tumor BRCA1 on the sensitivity to ionizing radiation (IR) and PARP inhibitor. Methods siRNA of BRCA1 were first used to inhibit endougenous BRCA1 expression in MCF7 cells. Then, plasmids of pCMV-3xFlag-WT-BRCA1, pCMV-3xFlag-NES-BRCA1 and pCMV-3xFlag-NLS-BRCA1 were transfected in MCF7 cells. Immunofluorescence staining was used to detect BRCA1 subcellular location as well as the formation of Rad51 and γ-H2AX foci. Apoptotic cells were analyzed by flow cytometry, and colony formation assay was performed to evaluate the survival of cells. Results There were 47% cells with nuclear BRCA1, 23% cells with cytoplasmic BRCA1 and 30% cell with mixed nuclear and cytoplasmic BRCA1 expression in WT-BRCA1 transfected cell. There were 87% cells with nuclear BRCA1 in NES-BRCA1 transfected cell, and 82% cells with cytoplasmic BRCA1 in NLS-BRCA1 transfected cell. There were 87%, 84% and 13% Rad51 foci positive cells at 2 hours after 4 Gy radiation treatment and 22%, 25% and 59% γ-H2AX foci positive cells at 24 hours after 4Gy radiation treatment in WT-BRCA1, NES-BRCA1 mutant and NLS-BRCA1 mutant transfected cell respectively. ABT-888 and radiation treatment induced more apoptosis and fewer colonies in NLS-BRCA1 transfected cell than WT-BRCA1, NES-BRCA1 mutant transfected cell. Conclusion Subcellular location of BRCA1 might affect homologous recombination repair of DNA double strand breaks and can be used to predict sensitivity to IR and PARP inhibitor.
BRCA1 subcellular location; homologous recombination; ionizing radiation; PARP inhibitor
时间:2017-3-16 14:23
http://kns.cnki.net/kcms/detail/34.1073.R.20170316.1423.005.html
国家自然科学基金(81272901)
1广州医科大学附属第一医院呼吸疾病国家重点实验室/广州呼吸疾病研究所, 广州 5101202中山大学附属第一医院病理科,广州 510080
姜桔红,女,博士,副研究员。Tel:(020)83205060,E-mail:juhongjiang2006@163.com 顾莹莹,女,主任医师,通讯作者。E-mail: gyblgyy@126.com
R 737.9
A
1001-7399(2017)03-0253-05
10.13315/j.cnki.cjcep.2017.03.005
接受日期:2017-02-09
