39株内生放线菌次级代谢产物的合成潜能
2017-06-05王海强安向向侯淑芬郝盼龙张秀敏河北大学生命科学学院河北省微生物多样性研究与应用重点实验室河北保定0700河北大学附属医院泌尿内科河北保定0700
王海强,安向向,侯淑芬,郝盼龙,张秀敏(.河北大学 生命科学学院,河北省微生物多样性研究与应用重点实验室,河北 保定 0700;.河北大学附属医院 泌尿内科,河北 保定 0700)
39株内生放线菌次级代谢产物的合成潜能
王海强1,安向向1,侯淑芬2,郝盼龙1,张秀敏1
(1.河北大学 生命科学学院,河北省微生物多样性研究与应用重点实验室,河北 保定 071002;2.河北大学附属医院 泌尿内科,河北 保定 071002)
为了解药用植物内生放线菌次级代谢产物合成潜能,采用2种不同的发酵培养基对39株分离自5种药用植物根部的内生放线菌进行发酵,利用甲醇抽提发酵液,然后对抽提液进行13株病原指示菌的抗菌活性测定.结果显示32株(82%)供试菌的发酵抽提液至少对1种病原指示菌表现出抑制活性.为进一步评价供试菌株的次级代谢产物合成潜能,对所有供试菌株的基因组DNA进行了聚酮合酶(PKS)基因与非核糖体肽合成酶(NRPS)基因的扩增及检测.结果表明:所有供试菌株至少能扩增出1种次级代谢产物合成基因,其比例为PKS I型①(59%)),PKS I型②(62%),PKS II型(82%),NRPS①(100%),NRPS②(100%),表明大多数药用植物内生放线菌具有合成聚酮类和非核糖体肽类化合物的潜能,在适宜的培养条件下可能产生这些种类的活性物质,有待进一步开发.
内生放线菌;抗菌活性;聚酮合酶(PKS)基因;非核糖体肽合成酶(NRPS)基因
细菌耐药性已成为世界抗感染治疗领域面临的严峻问题,努力挖掘新抗生素是解决细菌耐药性问题的迫切需要.放线菌是抗生素的主要产生菌,20世纪40年代Waksman发现了第1个放线菌产生的抗生素——链霉素,并认为寻找抗生素最好的地方是土壤[1].自此以后,人们就在持续不断地对土壤放线菌进行研究,至今已有近100年的历史.大量的放线菌被重复发现,新的活性物质被发现的几率越来越小,已成为目前制约放线菌来源的药物开发的一大难题.因此,从其他自然环境中获得更多更新的活性放线菌资源是发现新抗生素的前提.
随着分子生物学技术的发展,已经有150多种放线菌的次级代谢产物合成基因簇被克隆和测序.目前研究最多的是聚酮类化合物合成的基因簇(PKS)、非核糖体肽类化合物合成的基因簇(NRPS)和杂合聚酮-非核糖体肽类(PKS-NRPS)化合物形成的基因簇,在已研究的生物合成基因簇中,这3类化合物的基因簇所占的比例为80%.聚酮合酶的KS结构域和非核糖体肽合成酶的A结构域具有高度保守性[2],利用其设计简并引物,可定向扩增聚酮合酶(PKS)和非核糖体肽合成酶(NRPS)基因并筛选具有合成PK和NRP潜能的菌株.
本研究主要以河北省微生物多样性研究与应用重点实验室保藏的39株分离自板蓝根(Isatisindigotica)、桔梗(Platycodongrandiflorus)、地黄(Rehmanniaglutinosa)、远志(Polygalatenuifolia)和车前草(Plantagoasiatica)5种药用植物根部的内生放线菌菌株为研究对象,将菌株在2种不同的培养基中进行发酵,利用甲醇粗提其代谢产物,之后采用滤纸片法对菌株的发酵粗提液进行抑菌活性测定,并通过PKS和NRPS基因的扩增来评价药用植物内生放线菌合成次级代谢产物的潜能,为进一步开发新的抗生素奠定基础.
1 材料和方法
1.1 材料
1.1.1 供试药用植物内生放线菌
本实验所用的39株供试菌株为河北省微生物多样性研究与应用重点实验室保藏的分离自板蓝根、桔梗、地黄、远志和车前草根部的内生放线菌.
1.1.2 病原指示菌
指示病原真菌:①棉花黄萎病菌(VerticilliumdahliaeKleb.);②小麦根腐病菌(Bipolarissorokiniana);③苹果轮纹病菌(Botryosphaeriaberengerianaf.sp.piricola);④水稻胡麻斑病菌(BipolarisoryzaeShoem.);⑤葡萄灰霉病菌(BotrytiscinereaPers.);⑥小孢拟盘多毛孢菌(Pestalotiopsismicrospora);⑦玉米弯孢病菌(Curvulatalunata);⑧禾谷镰刀菌(FusariumgraminearumSchwab.);⑨棉花枯萎病菌(Fusariumoxysporumf.sp.vasinfectum);⑩白菜黑斑病菌(Alternariabrassicae).以上10种植物病原真菌均由河北农业大学植物分子病理学实验室提供.
1.1.3 培养基
种子培养基(g/L):葡萄糖1;可溶性淀粉2;酵母膏0.5;酶解酪素0.5;CaCO30.1;pH =7.2;121 ℃灭菌30 min.
发酵培养基A(g/L):可溶性淀粉 15 ;葡萄糖 1;蛋白胨 1;MgSO4·7H2O 0.1;KH2PO40.5;CaCl2·2H2O 1;生物缓冲试剂(MOPS) 10.5;大孔吸附树脂(Diaion HP20) 5;pH =7.0;115 ℃灭菌30 min.
发酵培养基B(g/L):大豆粉 12.5;酶水解酪素2;葡萄糖 12.5;CaCO31;NH4Cl 1.5;大孔吸附树脂(Diaion HP20) 5;pH=6.8;115 ℃灭菌30 min.
1.2 方法
1.2.1 菌种活化
分别挑取适量甘油管保藏的药用植物内生放线菌菌株,转接入R2A斜面培养基[3],28 ℃恒温培养至斜面长出菌落.
1.2.2 发酵培养
挑取活化好的菌种接入盛有10 mL种子培养基的发酵管中,28 ℃、210 r/min振荡培养48 h之后镜检,确定无染菌后按10%(V/V)接种量分别接入A和B 2种发酵培养基中,每种发酵培养基各发酵2份,28 ℃、210 r/min振荡培养10 d.
1.2.3 发酵液的抽提
1)将1.2.2得到的4瓶发酵液混合在一起,加入20 g 湿的Amberlite XAD-7 树脂(对分泌在发酵液中的复合物进行吸附吸收),振荡混合1 h;2)将混合均匀的发酵液10 000 r/min离心10 min,弃上清液,收集树脂与菌体;3)将收集的树脂与菌体用200 mL的甲醇抽提2次(总共400 mL),10 000 r/min离心10 min,收集上清液;4)将收集的上清液经旋转蒸发仪蒸发浓缩后保存在-80 ℃冰箱中,备用.
1.2.4 发酵液的抑菌活性检测
1)指示菌的扩大培养:从斜面挑取病原指示菌分别接入盛有10 mL LB液体培养基的发酵管中,28 ℃、210 r/min振荡培养48 h,镜检,确定无染菌后将病原真菌和细菌的培养液按5%(V/V)的量分别加入到已经熔化并冷却至55 ℃的马铃薯葡萄糖琼脂培养基(PDA)和牛肉膏蛋白胨琼脂培养基(NA)中,倒平板.2)抑菌活性检测:将准备好的无菌圆形滤片浸在发酵抽提液中,取出风干,用镊子将其平放在已凝固的含有病原指示菌的培养基平板中,每个平板放置3片滤纸片(2个蘸有一种发酵抽提液作为平行,1个蘸有无菌水作为空白对照),将平板倒置培养在28 ℃培养箱中,24 h后观察有无抑菌圈.
1.2.5 PKS和NRPS基因的扩增及检测
1)DNA的提取:供试菌株基因组DNA的提取参考Kutchma et al.[4]的方法.2)PKS与NRPS的扩增:PKS与NRPS基因的扩增引物序列见表1.PCR扩增体系见表2.各引物的PCR扩增参数见表3.

表1 PKS与NRPS的扩增引物Tab.1 Information of amplification primer of PKS and NRPS genes

表2 PKS与NRPS基因扩增体系的组成Tab.2 Composition of the amplification system of PKS and NRPS genes

表3 PKS与NRPS基因的扩增反应参数Tab.3 Amplification reaction parameters of PKS and NRPS genes
将PKS和NRPS基因的PCR扩增产物用10 g/L的琼脂糖凝胶电泳进行检测.
2 结果
2.1 发酵提取液的抑菌活性检测

A.营养相对贫瘠;B.营养丰富.图1 菌株EA36的2种不同发酵液Fig.1 Two different kinds of fermented liquid of strain EA36
采用A(营养相对贫瘠)、B(营养丰富)2种不同的发酵培养基对39种供试菌株进行发酵培养,同时为了增加捕获内生放线菌次级代谢产物(有可能对微生物细胞有毒性或使其产量很低)的几率,培养基中添加了Diaion HP20树脂,可以对微生物产生的次级代谢产物进行吸附,且使用普通有机溶剂即可很容易地游离出吸附物质,在发酵结束后加入Amberlite XAD-7树脂进一步吸附分泌到上清液中的次级代谢产物.从实验结果来看,同一菌株在2种不同的发酵培养基中发酵7 d后的生长情况(包括菌体的生物量和发酵液的颜色)有明显的差异(图1.),这表明供试菌株在A、B 2种培养基中产生的次级代谢产物可能不同.
对于每株供试菌,2种不同的发酵液混合在一起收集菌体和树脂,之后用甲醇抽提得到的粗提液作为一个样品.利用13种病原指示菌来检测供试菌株发酵粗提液的抑菌活性,通过抑菌圈的有无进行判定.经统计,共有32株供试菌株(82%)的发酵粗提液至少对1种病原指示菌表现出抑制活性,表明这32株供试菌株在本实验条件下可以产生特定的次级代谢产物,可记为“生产性的”菌株,它们分别为菌株114619、EA25、EA35、SBS11030、EA36、EA28、EA12、SNS1103、174622、174639、174627、EA25、SCJG114318、EA4、EA32、TJ23、BF11、BF4、174612、YZ1、EA42、SCN1104、TJ49、JGFYS1、EA19、BF3、EA1、EA3、FN11033012、FBS11033001、EA9和BF1.其中有26株(66.7%)只对真菌表现抑菌活性,分别为菌株SBS11030、EA36、EA28、EA12、SNS1103、174622、174639、174627、EA25、SCJG114318、EA4、EA32、TJ23、BF11、BF4、174612、YZ1、EA42、SCN1104、JGFYS1、EA19、BF3、EA3、FN11033012、FBS11033001和EA9;有6株(15.4%)既表现抗真菌活性又表现抗细菌活性,分别为菌株174619、EA1、EA15、EA35、TJ49和BF1,且大多数的抗真菌活性是抗④水稻胡麻斑病菌(BipolarisoryzaeShoem.)、⑤葡萄灰霉病菌(BotrytiscinereaPers.)和⑥小孢拟盘多毛孢菌(Pestalotiopsismicrospora)(表4).此外,菌株EA49、174613、BF8、SCJG11031805、FN11033018、SCJG11031802和SCJG11040906共7株菌(18%)并未检测到抑菌圈,这些未检测到抑菌活性的菌株称之为“非生产性的”菌株.
在32株活性菌株中,分离自远志、车前草、桔梗、地黄和板蓝根5种药用植物的内生放线菌都至少有一株对13种病原菌都没有抑制活性(表中加粗的菌株);除地黄外,从其他4种药用植物中都分离到了既抑制病原真菌又抑制病原细菌的内生放线菌.图2显示的是部分供试菌株发酵抽提液菌的抑菌圈.

表4 发酵粗提液的抑菌活性检测结果Tab.4 Antimicrobial activity results of crude fermentation extracts
“+”代表有抑菌活性;“-”代表无抑菌活性
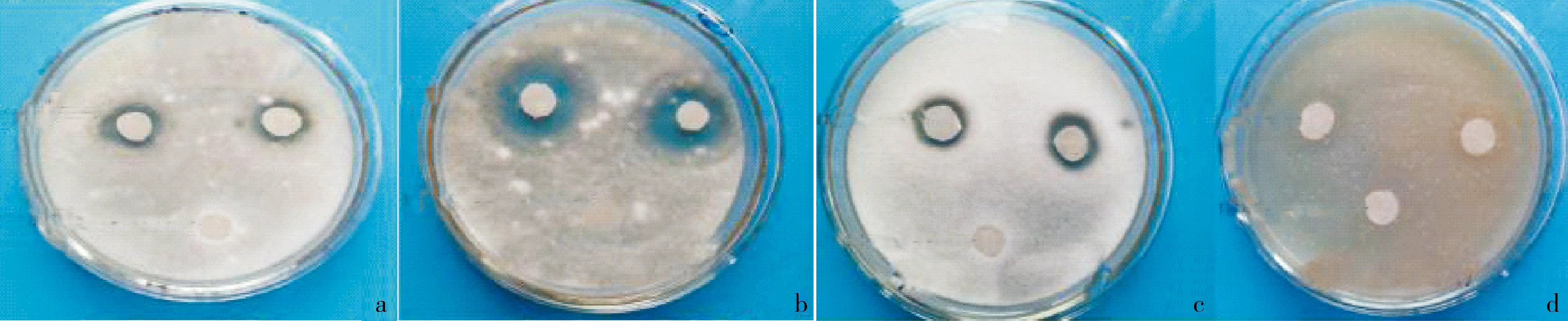
a.SBS11030对小孢拟盘多毛孢菌的真菌抗性;b.SBS11030对灰葡萄孢菌的真菌抗性;c.SBS11030对棉花枯萎病菌的真菌抗性;d.EA49对金黄色葡萄球菌的细菌抗性.图2 发酵粗提液对部分指示菌的抑菌圈Fig.2 Bacteriostatic rings of the fermentation crude extracts
2.2 PKS和NRPS基因的检测结果
根据发酵提取液抑菌活性检测结果可知,在39株供试菌株中有7株菌(18%)未检测到抑菌圈,即“非生产性的”菌株,推测是在这项研究中使用的2种发酵培养基可能没有提供刺激其产生次生代谢物所需的营养物质和条件.为了进一步验证其到底有没有合成次级代谢产物的潜能,对所有39株供试菌株(“生产性的”和“非生产性的”) 的PKS和NRPS基因进了扩增,进而对供试菌株的次级代谢产物生物合成潜能进行更准确的评价.
PKS与NRPS基因扩增及电泳检测结果表明,39株供试菌株至少扩增出了1条预期大小的目的条带,比例为:PKS I型①(59%) 、PKS I型②(62%)、PKS II型(82%)、NRPS①(100%)、NRPS②(100%)(图3).32株“生产性的”菌株都检测到至少含有1种PKS或NRPS基因,正是由于这些基因的存在,使得这些菌株在本研究的发酵条件下能够合成相应的活性次级代谢产物.供试菌株SBS11030、174622、TJ23的PKS基因检测结果见图4;部分菌株的NRPS基因检测结果见图5和图6.
尤其值得指出的是,未检测到抑菌活性的7株“非生产性的”的菌株都扩增出了NRPS①和NRPS②基因,除此之外,菌株174613还扩增出了PKS I型①和PKS I型②基因;菌株EA49和BF8都扩增出PKS II型基因;菌株SCJG11031802和SCJG11031805扩增出PKS I型②基因;菌株FN11033018扩增出PKS I型①基因(表5).这说明它们本身具有合成次级代谢产物的潜力,可能是由于本研究中所用的发酵培养基不适合其产生这些次级代谢产物,或者实验所用的敏感指示菌的种类有限不足以展示其活性.
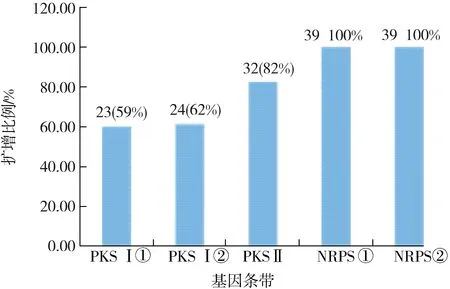
图3 不同次级代谢产物合成基因扩增检测结果统计Fig.3 Amplification detection results of different secondary metabolites synthesis gene
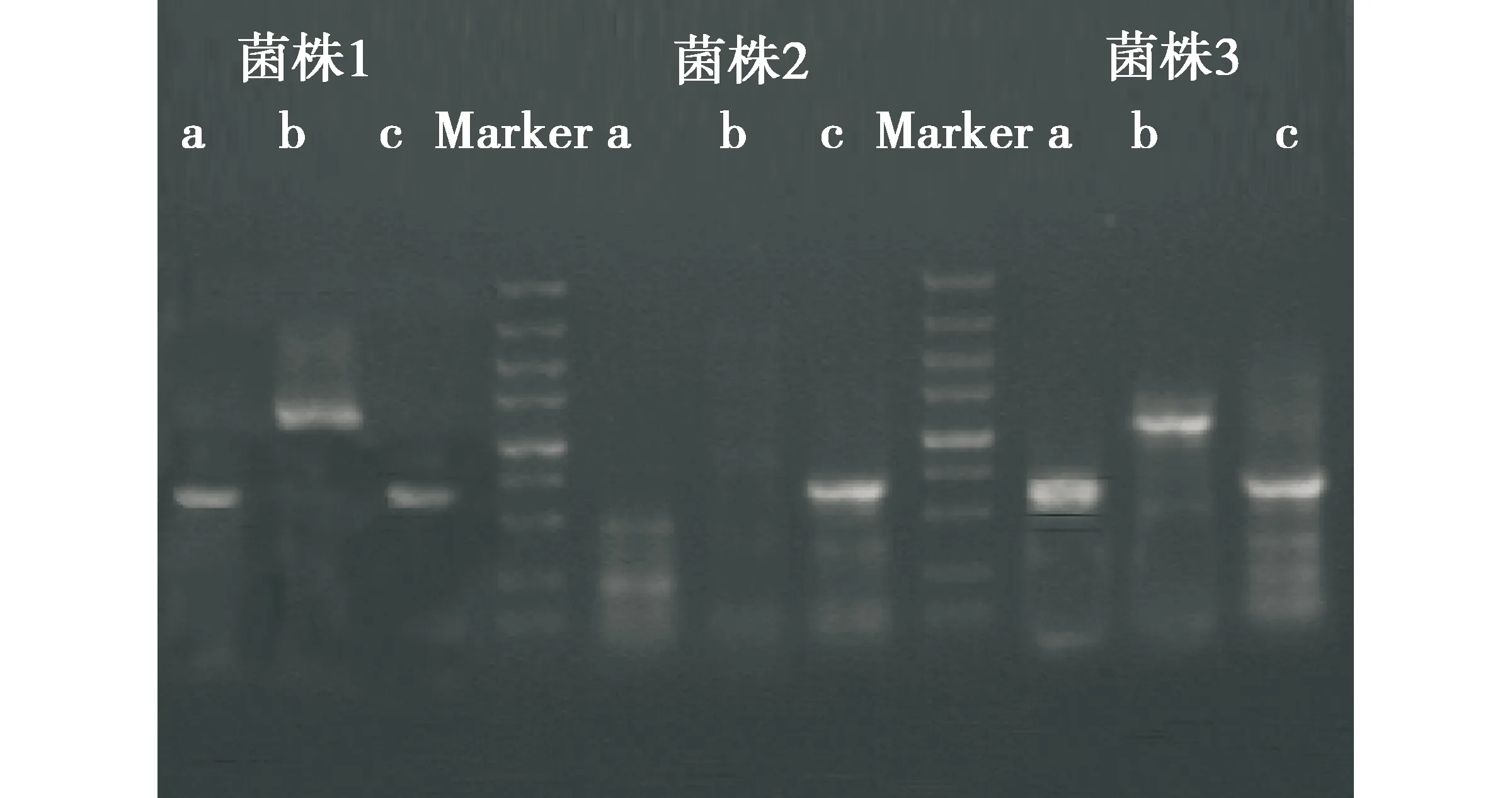
菌株1.SBS11030;菌株2.174622;菌株3.TJ23;a.PKS I型①,大小为750 bp左右;b.PKS I型②,大小为1 500 bp左右;c.PKS II型,大小为750 bp左右;Marker.5 000 ku DNA Marker.图4 PKS基因扩增电泳图检测Fig.4 PKS genes amplification electrophoresis figure

1.菌株SBS11030;2.菌株174622;3.菌株TJ23;4.菌株EA49;5.菌株BF8;6.菌株JGFYS;7.菌株SSCJG11031805;8.菌株FN11033018;Marker.5 000 ku DNA Marker.

图5 NRPS①基因扩增电泳图检测 (目的条带大小为500~750bp)Fig.5 NRPS①genesamplificationelectrophoresisfigure(sizeoftargetfragment:500~750bp)图6 NRPS②基因扩增电泳图检测(目的条带大小为750~800bp)Fig.6 NRPS②genesamplificationelectrophoresisfigure(sizeoftargetfragment:750~800bp)
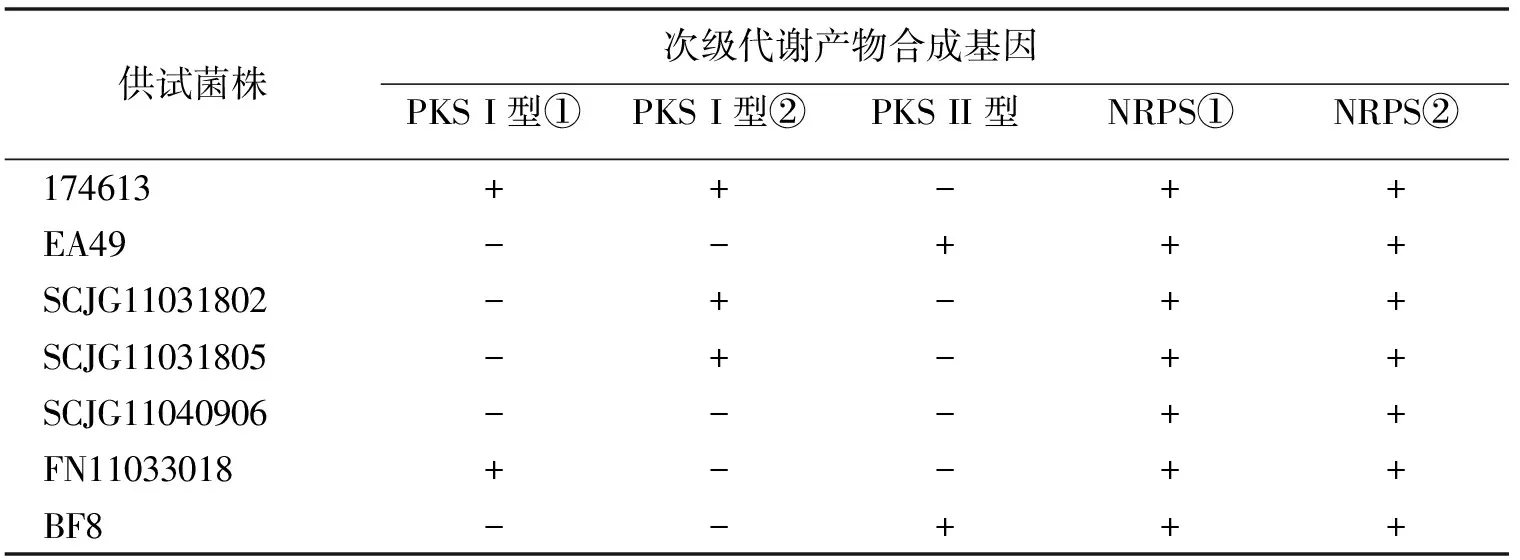
表5 PSK和NRPS生物合成基因在7株“非生产性的”菌株中的分布Tab.5 Distributions of PKS and NRPS biosynthetic genes in seven of “unproductive”strains
“+”代表有目的条带;“-”代表无目的条带.
3 讨论
为了评价药用植物内生放线菌的次级代谢产物合成潜能,本研究采用了抑菌活性以及次级代谢产物合成基因检测2种方法.首先利用2种不同的发酵培养基进行发酵,并在培养基配制过程中加入一定量的大孔吸附树脂以尽可能多地捕捉到活性次级代谢产物.从实验结果来看,同一菌株在不同发酵培养基中发酵后的生长情况(菌体的生物量和发酵液的颜色)有着明显差别,表明菌株在不同的发酵培养基中产生的次级代谢产物可能不同.通过对39株药用植物内生放线菌的发酵粗提液进行抗菌活性检测,有32株(82%)供试菌株是具有对至少1种指示菌产生抑菌活性的“生产性的”菌株,说明本研究所用的Diaion HP20树脂和Amberlite XAD-7树脂的确捕捉到了这些供试菌株产生的次级代谢.虽然有7株(18%)供试菌株未能直接检测到抗菌活性,即“非生产性的”菌株,但不能说明这些菌株不具有合成活性代谢产物的能力,可能由于本研究应用的2种发酵培养基具有局限性,不能够提供这些内生放线菌菌株发酵产生次级代谢产物所必须的营养成分.
通过对39株供试菌株进行PKS和NRPS基因的扩增检测,表明所有供试菌株至少扩增出了1条预期大小的目的条带.尤其值得指出的是,未检测到抑菌活性的“非生产性的”菌株同样能扩增出至少1种次级代谢产物合成基因,这充分说明这些菌株具有较强的合成次级代谢产物的能力,对此进行研究,可以为进一步开发新的抗生素,尤其是抗耐药菌活性的新抗生素提供有价值的参考.
[1] COMROE J H.Pay dirt:the story of streptomycin.Part I:from Waksman to Waksman[J].Am Rev Respir Dis,1978,117(4):773-781.DOI:10.1164/arrd.1978.117.4.773.
[2] 邹颖钦.深海微生物来源PKS/NRPS合成基因(簇)的筛选及其初步功能分析[D].厦门:厦门大学,2011. ZOU Y Q.Screening and preliminary analysis of the function of Deep-sea microbial source PKS/NRPS synthetic gene (clusters) [D].Xiamen:Xiamen University,2011.
[3] REASONER D J,GELDREICH E E.A new medium for the enumeration and subculture of bacteria from potable water[J].Appl Environ Microbiol,1985,49(1):1-7.
[4] KUTCHMA A J,ROBERTS M A,KNAEBEL D B,et al.Small-scale isolation of genomic DNA fromStreptomycesmycelia of spores[J].Biotechniques,1998,24:452-457.
[5] HE M,HALTLI B,SUMMERS M,et al.Isolation and characterization of meridamycin biosynthetic gene cluster fromStreptomycessp.NRRL 30748[J].Gene,2006,377:109-118.DOI:10.1016/j.gene.2006.03.021.
[6] AYUSO S A,GENILLOUD O.New PCR primers for the screening of NRPS and PKS-I systems in actinomycetes:detection and distribution of these biosynthetic gene sequences in major taxonomic groups[J].Microbial Ecology,2005,49(1):10-24.DOI:10.1007/s00248-004-0249-6.
[7] METSA K M,SALO V,HALO L,et al.An efficient approach for screening minimal PKS genes from Streptomyces[J].FEMS Microbiology Letters,1999,180(1):1-6.DOI:10.1111/j.1574-6968.1999.tb08770.x.
[8] BUSTI E,MONCIARDINI P,CAVALETTI L,et al.Antibiotic-producing ability by representatives of a newly discovered lineage of actinomycetes[J].Microbiology,2006,152(3):675-683.DOI:10.1099/mic.0.28335-0.
(责任编辑:赵藏赏)
Biosynthetic potential of 39 strains of endophytic actinomycetes
WANG Haiqiang1,AN Xiangxiang1,HOU Shufen2,HAO Panlong1,ZHANG Xiumin1
(1.Key Laboratory of Microbial Diversity Research and Application of Hebei Province,College of Life Scineces,Hebei University,Baoding 071002,China;2.Urinary of Internal Medicine,Affiliated Hospital of Hebei University,Baoding 071002,China)
In order to understand the biosynthetic potential of medicinal endophytic actinomycetes,39 strains isolated from roots of 5 species of medicinal plants were fermented in two different media.Then methanol was used to extract the fermentations.After getting the crude extracts,the bioactivity test of crude extracts were performed on 13 strains of indicator bacteria and fungi.About 32 (82%) of the crude extracts exhibited bioactivity to one of the 13 indicator bacteria and fungi at least.To further verify the biosynthetic potential of the 39 strains,the polyketide synthases (PKS) and nonribosomal peptide synthetases (NRPS) genes were amplified.One of the several genes at least could be amplified from genomic DNAs of all of the strains,and the proportions for the type I PKS①,type I PKS②,type II PKS,NRPS① and NRPS② are 59%,62%,82%,100% and 100%,respectively.These results above suggested that the endophytic actinomycetes from medical plants possessed significant biosynthetic potential,and they could produce active compounds under certain conditions.
endophytic actinomycetes;antimicrobial activity;polyketide synthase genes;non ribosomal peptide synthetase gene
2016-11-07
国家自然科学基金资助项目(31270053);河北省自然科学基金资助项目(C2014201141);河北省生物工程重点学科建设经费资助项目(1050-5030023)
王海强(1991—),男,河北保定人,河北大学在读硕士研究生.E-mail:1490692245@qq.com
张秀敏(1970—),女,河北保定人,河北大学教授,博士,主要从事微生物系统学及多样性研究. E-mail:zhxiumin1106@126.com
10.3969/j.issn.1000-1565.2017.03.006
Q939.13
A
1000-1565(2017)03-0254-08
