辽细辛和北马兜铃ISSR-PCR的引物筛选及反应体系的建立与正交优化※
2017-06-05朱连连赵容李诗慧赵思慧刘洋洋梁一凡
朱连连 赵容 李诗慧 赵思慧 刘洋洋 梁一凡
辽细辛和北马兜铃ISSR-PCR的引物筛选及反应体系的建立与正交优化※
朱连连 赵容*李诗慧 赵思慧 刘洋洋 梁一凡
(辽宁中医药大学药用植物学教研室,大连116600)
目的探寻适合细辛和马兜铃品种鉴定的ISSR引物。方法利用一个品种对全部100条ISSR引物设置退火温度进行梯度实验,筛选出重复性好、条带清晰的引物5条,从理论上讲,这些筛选的引物可以实现对现有辽细辛和北马兜铃品种的鉴定。马兜铃属ISSR-PCR的引物筛选,利用正交试验设计的方法,从Taq DNA聚合酶浓度、Mg2+浓度、dNTP浓度、引物浓度,这4种因素3个水平,对马兜铃属ISSR-PCR反应体系进行优化分析,并在此基础上对模板DNA浓度、PCR反应过程中的退火温度进行梯度检测。结果从样品中筛选出优选引物,细辛UBC815、UBC826、UBC862、UBC868、UBC888;马兜铃UBC825、UBC827、UBC836、UBC846、UBC848。反应体系的稳定性进行检测结果均稳定可靠。结论得到马兜铃的最佳组合,即20μL ISSR-PCR反应体系中含0.25 Lmol/L引物、1.5 mmol/L Mg2+、1×PCR buffer、150 Lmol/LdNTP和0.5 UTaqDNA聚合酶。PCR反应条件为94℃预变性5 min,以30个循环94℃变性30 s,50℃退火1 min,72℃延伸1 min,最后以72℃延伸10 min。得到细辛的最佳组合,20 μL ISSR-PCR反应体系中含0.50 Lmol/L引物、1.5 mmol/L Mg2+、2×PCR buffer、250 Lmol/L dNTP和2.0 UTaqDNA聚合酶;同时得到最佳模板DNA浓度为10 ng,最佳退火温度为50℃。
辽细辛;北马兜铃;引物筛选;正交优化
马兜铃科植物北马兜铃Aristolochia contorta Bge.或马兜铃Aristolochia debilis Sieb.et Zucc.的干燥成熟果实[3]。马兜铃为多年生的缠绕性草本植物。其根、茎、果实都称马兜铃,苦,微寒。归肺、大肠经。马兜铃具有清肺止咳、降气平喘、清肠消痔的功效,马兜铃有强烈致癌物质成分,马兜铃中含有的马兜铃酸可导致马兜铃酸肾病。贮藏置干燥处[8-11]。
细辛来源于汉城细辛Asarum sieboldii Miq.var.se oulense Nakai或华细辛Asarwm sieboldii Miq.北细辛AsarumheterotropoidesFr.Schmidtvar.mandshuricum (Maxim.)Kitag.的干燥根和根莲[3]。前2种习称“辽细辛”。夏季果熟期或初秋采挖,除净地上部分和泥沙,阴干。辛,温。归心、肺、肾经。解表散寒,祛风止痛,通窍,温肺化饮。贮藏置阴凉干燥处。本文的主旨是建立马兜铃属植物——细辛和马兜铃的ISSR优化体系[1-2]。
1 材料和方法
1.1 材料22份细辛和7份马兜铃种质资源采自辽宁省抚顺市新宾、清原镇,丹东凤城市爱阳镇,经辽宁中医药大学尹海波,王冰教授鉴定,植株保存在辽宁中医药大学孵化器,DNA保存于超低温冰箱中。本文中的马兜铃都是北马兜铃,细辛都是辽细辛。
1.2 方法植物辽细辛,北马兜铃材料的基因组DNA提取采用经典CTAB法。然后0.8%琼脂糖凝胶上检测辽细辛,北马兜铃基因组DNA质量,接着用快速蛋白质-核酸分析仪分析DNA浓度和纯度,最后稀释到20 ng/L并-20℃保存备用。
本实验扩增反应在Biometra PCR扩增仪上进行。ISSR采用20 μL反应体系,其中包括了4种dNTP各200 μmol/L,引物各0.5 μmol/L,1×PCRbuffer,1.5 mmol/L MgCl2,rTaq酶1.0 U,基因组DNA 20 ng。本实验的PCR反应条件为95℃然后预变性2 min,以40个循环94℃变性1 min,然后50℃退火1 min,再72℃延伸2 min,最后以72℃延伸5 min。实验所用PCR相关试剂均购自TaKaRa(宝)生物工程(大连)有限公司。ISSR引物使用加拿大哥伦比亚大学(Univer-sity of British Columbia,UBC)所设计100条引物,由上海生物工程技术服务有限公司合成[1]。
1.3 提取植物基因组总DNA本实验采用CTAB法提取辽细辛和北马兜铃基因组总DNA,使用0.8%的琼脂糖电泳检测,最后实验时把DNA浓度稀释至20 ng/μL。
1.4 辽细辛和北马兜铃引物筛选从22份细辛中选取一份细辛样品,用100条引物筛选(本实验所用引物为哥伦比亚大学UBC公布的100条ISSR通用引801-900,由华大公司合成),从中优选出5条,一条用于做正交实验,另外4条备份。马兜铃同理。
1.5 辽细辛和北马兜铃ISSR-PCR反应体系正交试验设计与PCR扩增采用L9(34)正交试验设计,分别对引物浓度、Mg2+浓度、dNTP浓度、TaqDNA聚合酶浓度进行筛选,方案如表1、2。

表1 ISSR-PCR反应体系的因素与水平L9(34)[2]

表2 ISSR-PCR反应体系的正交试验设计[2]
根据以上表1、2配制辽细辛和北马兜铃PCR反应总体积为20[0]μL,再加入DNA和PCR达到总体积,马兜铃引物选用UBC827,细辛引物选用UBC868,每组处理设置2次重复。本实验辽细辛,北马兜铃扩增PCR程序为:94℃预变性5 min;然后94℃变性30 s,45℃退火60 s,72℃延伸60 s,此循环30次;72℃延伸10 min。所得的PCR产物通过凝胶成像系统拍照分析。
1.6 辽细辛和北马兜铃的ISSR-PCR反应体系中模板DNA浓度的优化根据两种材料正交试验结果选出最佳反应体系组合,再筛选出合适的模板DNA浓度。两种材料反应体系为20 μL,DNA质量分别为10 ng、20 ng、40 ng、60 ng、80 ng、100 ng、120 ng七个处理,每个处理设2次重复,其它程序与正交实验相同。
1.7 辽细辛和北马兜铃的ISSR-PCR反应体系中退火温度的优化在上述试验确定的最佳反应体系基础之上,对退火温度进行梯度试验,筛选出最佳退火温度。在PCR梯度扩增仪上设置最低退火温度为40℃,最高为58℃,PCR反应8个梯度,即45℃、49℃、50℃、51℃、55℃、56℃、57℃、58℃,每个梯度设2次重复,其它程序与正交实验相同。
1.8 辽细辛和北马兜铃的ISSR-PCR反应体系的稳定性检测分别选择辽细辛,北马兜铃的另外四个ISSR引物:马兜铃为UBC825、UBC836、UBC846、UBC848;细辛为UBC815、UBC826、UBC862、UBC888根据以上筛选稳定性进行检测,每个引物设2次重复实验。
2 结果和分析
2.1 辽细辛和北马兜铃引物筛选从22份细辛中选取一份细辛样品,用100条引物筛选,从中优选出5条,一条用于做正交实验,另外4条备份。马兜铃从7份马兜铃中选取一份马兜铃样品,用100条引物筛选,从中优选出5条,一条用于做正交实验,另外4条备份。细辛选择引物UBC868,马兜铃选择引物UBC827供实验使用。
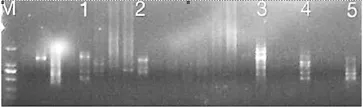
图1 细辛

图2 马兜铃
2.2 辽细辛和北马兜铃ISSR-PCR反应体系的正交优化
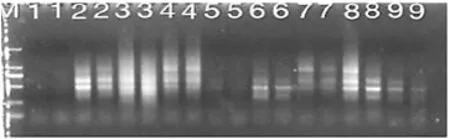
图3 细辛的正交试验设计ISSR-PCR反应体系的扩增结果

图4 马兜铃的正交试验设计ISSR-PCR反应体系的扩增结果
根据文献和《药典》,最佳组合应筛选确定为谱带清晰以及谱带稳定等优点的组合,故本实验辽细辛选择组合8为最佳组合,即20 μL ISSR-PCR反应体系中含0.50 mmol/L引物、1.5 mmol/L Mg2+、2×PCR buffer、250 mmol/L dNTP和2.0UTaqDNA聚合酶;北马兜铃选择组合为1最佳组合,即20 μL ISSR-PCR反应体系中含0.25 mmol/L引物、1.5 mmol/L Mg2+、1× PCR buffer、150 mmol/L dNTP和0.5 UTaqDNA聚合酶。
2.3 辽细辛和北马兜铃不同模板DNA浓度对ISSR-PCR反应体系的影响根据正交试验结果选择组合8对模板DNA浓度进行梯度筛选。由图5看出,由于模板DNA浓度不同,扩增结果存在差异。因此,本实验确定最佳模板DNA浓度为10 ng。

图5 马兜铃ISSR-PCR反应体系中不同模板DNA浓度的扩增结果(引物:UBC827)

图6 细辛ISSR-PCR反应体系中不同模板DNA浓度的扩增结果(引物:UBC868)
2.4 辽细辛和北马兜铃不同退火温度对ISSR-PCR反应体系的影响从下图7和8可以看出,退火温度由40℃升到58℃,退火温度为50℃时,谱带清晰、谱带稳定、谱带多态性高的组合清晰、杂带少。综上,本实验最终确定引物UBC868,UBC827的最佳退火温度确定为50℃。
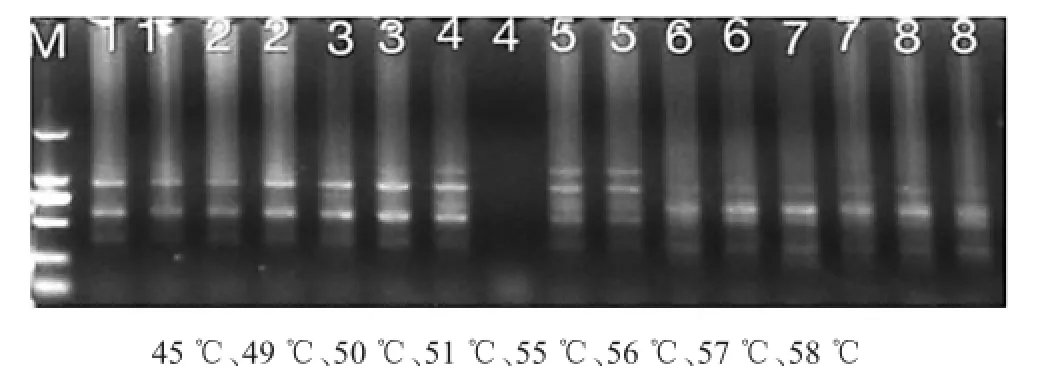
图7 北马兜铃ISSR-PCR反应体系中不同退火温度的扩增结果。引物:UBC827
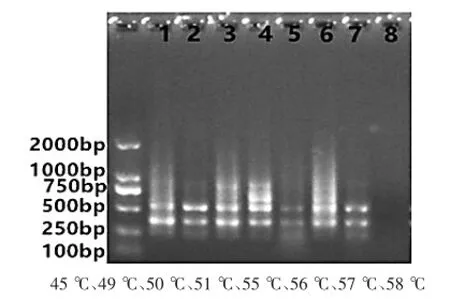
图8 细辛ISSR-PCR反应体系中不同退火温度的扩增结果。引物:UBC868
2.5 辽细辛和北马兜铃ISSR-PCR反应体系的稳定性检测选择北马兜铃另外4条ISSR引物分别为UBC825、UBC836、UBC846、UBC848,再选择辽细辛另外4个ISSR引物细辛UBC815、UBC826、UBC862、UBC888对优化反应体系的稳定性进行检测。由图9看出,均能扩增出谱带,表明优化确立的辽细辛和北马兜铃ISSRPCR反应体系是稳定可靠的。

图9 北马兜铃、辽细辛ISSR-PCR反应体系中不同引物的稳定性扩增结果
3 讨论
本研究是采用ISSR对药用植物马兜铃属—辽细辛,北马兜铃进行研究。项目创新之处,首次对药用植物马兜铃属—辽细辛,北马兜铃进行分子方面的实验。首次同时对辽细辛和北马兜铃进行ISSR鉴别。通过在第四次全国中药资源普查期间采集实验材料,22份细辛和7份马兜铃种质资源采自辽宁省抚顺市新宾、清原镇,丹东凤城市爱阳镇。
本研究中,前期进行了大量的基础性工作,样品干燥,研磨,DNA提取采用CTAB法,筛选DNA,最后从22份细辛中选取一份细辛样品,用100条引物筛选,从中优选出5条,一条用于做正交实验,另外4条备份。马兜铃从7份马兜铃中选取一份马兜铃样品,用100条引物筛选,从中优选出5条,一条用于做正交实验。细辛UBC815、UBC826、UBC862、UBC 868、UBC888;马兜铃UBC825、UBC827、UBC836、UBC846、UBC848。
参考其他文献[4-16]和《药典》,采用正交试验设计实验对引物浓度、Mg2+浓度、dNTP浓度、TaqDNA聚合酶浓度进行4因素3水平筛选,由于本实验为辽宁省大学生创业基金项目(编号201510162000055)实验人员为本科生,实验条件不理想,知识储备不足,实验操作中的误差等,使得在得到谱图方面结果不是太理想,最终筛选确定北马兜铃1最佳组合,即20 μL ISSRPCR反应体系中含0.25 mmol/L引物、1.5 mmol/L Mg2+、1×PCR buffer、150 mmol/L dNTP和0.5 UTaqDNA聚合酶,基因组DNA为10 ng。扩增反应在Biometra PCR扩增仪上进行。PCR反应条件为94℃预变性5 min,以30个循环94℃变性30 s,退火温度为50℃1 min,72℃进行延伸1 min,最后以温度72℃进行延伸10 min。辽细辛组合8为细辛最佳组合,即20 μL ISSRPCR反应体系中含20 μL ISSR-PCR反应体系中含0.50 mmol/L引物、1.5 mmol/L Mg2+、2×PCR buffer、250 mmol/L dNTP和2.0UTaqDNA聚合酶;最佳模板DNA浓度为10 ng;最佳退火温度筛选确定为50℃。根据实验结果表明优化确立的辽细辛和北马兜铃ISSR-PCR反应体系是稳定可靠的。
对影响马兜铃属中药—辽细辛和北马兜铃ISSRPCR反应体系的主要因素进行优化筛选分析,筛选出了最佳实验组合。所以,对会受多种因素影响的ISSR-PCR反应体系来说,正交试验设计可以弥补实验结果的缺陷。ISSR分子标记法是检测辽细辛,北马兜铃遗传多样性的可靠方法,可检测到丰富的遗传多样性信息。本实验所建立的ISSR-PCR反应稳定体系可以为辽细辛,北马兜铃品种鉴定、亲缘关系分析、遗传多样性分析、遗传图谱构建等提供实验基础。
[1]王志清.利用ISSR和SRAP标记分析细辛资源遗传多样性与亲缘关系[J].植物遗传资源学报,2015,16(5):1035-1044.
[2]李嵘.丹参ISSR-PCR反应体系的建立与正交优化[J].广西植物,28(5): 599-603.
[3]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015.
[4]吕国庆,姬可平,牛宪立,等.建立我国中药材DNA条形码数据库方法的探讨和前景展望[J].新乡医学院学报,2010,27(4):416-418.
[5]陈孟兰,朱正兰.北马兜铃属植物的生物活性和药理作用研究进展[J].时珍国医国药,2007,18(3):702-704.
[6]陈念,赖小平.药用植物DNA条形码物种鉴定技术[J].中药材,2010,33(4):648-650.
[7]于华会,杨志玲,杨旭,等.药用植物种质资源ITS序列研究进展[J].中草药,2010,41(3):491-496.
[8]刘宝玲,王利生,朱延萍.北马兜铃的本草考证与原植物鉴定[J].药物分析杂志,1994,32(1):59-61.
[9]赵辉,刘绣华.北马兜铃属(Aristolochia L)药用植物研究概况[J].河南大学学报(自然科学版),2003,33(4):73-77.
[10]孙睿,张丽丽,罗志文,等.药用植物北北马兜铃的开发利用价值与栽培技术概述[J].安徽农业科学,2011,39(24):14620-14621.
[11]王明明.ISSR标记技术及其在药用植物遗传育种中的应用[J].中草药,2007,38(1):134-137.
[12]王建波.ISSR分子标记及其在植物遗传学研究中的应用[J].遗传,2002,24(5):613-616.
[13]张忠廉.SSR ISSR标记技术及其在生药学中的应用进展[J].辽宁中医药大学学报,2008(11):79-81.
[14]李水仙.正品青叶胆遗传多样性的ISSR分析[J].时珍国医国药,2015(7):1748-1749.
[15]吴生.正交设计优化翼梗五味子ISSR-PCR反应体系[J].中草药,2011,42(5):976-979.
Primer Screening of Aristolochicaceae-Liao Asarum and Aristolochia mansoni by ISSR-PCR and Establishment and Orthogonal Optimization of Reaction System
ZHU Lianlian,ZHAO Rong*,LI Shihui,ZHAO Sihui,LIU Yangyang,LIANG Yifan
(Department of Pharmaceutical Botany Liaoning University of Traditonal Chinese Medicine,Liaoning Province,Dalian 116600,China)
ObjectiveTo explore the ISSR primers for identification of varieties and Aristolochia asarum.Methods The annealing gradient experiment for all 100 ISSR primers were screened using a variety of high polymorphism primers,5 primers with good repeatability,theoretically,these primers screening can achieve identification of existing species of Aristolochia contorta and asarum. Primer screening of Aristolochia ISSR-PCR,using the method of orthogonal experimental design,the primer concentration,Taq DNA polymerase concentration,Mg2+concentration and dNTP concentration of 4 factors and 3 levels to optimize the analysis of Aristolochia ISSR-PCR reaction system,and on the basis of template DNA concentration,annealing temperature of PCR reaction in the process of gradient detection.Results Preferably selected primers from samples,UBC815,UBC826,UBC862,UBC868,UBC825,UBC827, UBC888;aristolochic UBC836,UBC846,UBC848.The stability of the reaction system is stable and reliable.Conclusion he optimal combination of aristolochic acid,namely 20μL ISSR-PCR reaction system containing 1×PCR buffer,150Lmol/L dNTP,0.25Lmol/ L primer,1.5mmol/L Mg2+and 0.5UaqDNA polymerase.The PCR reaction conditions were denaturation at 94℃for 5 min, denaturation at 94℃for 30s,annealing at 50℃for 1 min,extension at 72℃for 1 min and extension at 72℃for 10 min.The optimal DNA concentration was 20ng and the optimal DNA concentration was 20ng.The optimal conditions were as follows:20μL ISSR-PCR reaction system containing 2×PCR buffer,250Lmol/L dNTP,0.50Lmol/L primer,1.5mmol/L Mg2+and 2.0UTaqDNA polymerase;And the optimum template DNA concentration was 10 ng,The annealing temperature was 50°C.
Aristolochia asarum;Aristolochia contorta;primer screeni;reaction system optimization
10.3969/j.issn.1672-2779.2017.10.060
1672-2779(2017)-10-0137-04
:张文娟本文校对:邢艳萍
2017-01-24)
辽宁省大学生创业基金项目【No.201510162000055】
*通讯作者:zhaoxiaorong1985@163.com
猜你喜欢
——凹脉马兜铃
