过表达Oct4B1诱导结直肠癌SW480细胞发生上皮间质转化①
2017-06-05陈奕霖文坤明胡水清陈正权曾庆良
陈奕霖 文坤明 胡水清 陈正权 曾庆良
(遵义医学院附属医院胃肠外科,遵义563000)
过表达Oct4B1诱导结直肠癌SW480细胞发生上皮间质转化①
陈奕霖 文坤明 胡水清 陈正权 曾庆良
(遵义医学院附属医院胃肠外科,遵义563000)
目的:探讨Oct4B1基因过表达是否诱导人结直肠癌SW480细胞发生上皮间质转化(EMT)及其可能的机制。方法:用带G418抗性的Oct4B1基因过表达质粒及阴性对照质粒转染人结直肠癌SW480细胞株,分别称为实验组(SW480-Oct4B1)及对照组(SW480-NC),转染成功后用G418筛选建立稳定转染的细胞株,对两种稳定转染细胞进行如下检测:① RT-qPCR检测Oct4B1的mRNA水平;②划痕实验和Transwell小室实验检测迁移和侵袭能力;③Western blot检测EMT相关标记物E-cadherin、N-cadherin及Vimentin蛋白表达;④RT-qPCR和Western blot检测EMT转录因子Twist的mRNA及蛋白表达。 结果:稳定转染细胞株建立后,实验组与对照组比较:Oct4B1基因表达水平明显升高(P<0.01);细胞迁移明显增强(P<0.01);细胞侵袭能力明显提高(P<0.01);上皮标记物E-cadherin蛋白表达量明显下降(P<0.01);而间质标记物N-cadherin及Vimentin蛋白表达量明显上调(P<0.01);Twist 的mRNA及蛋白表达量均明显升高(P<0.01)。结论:过表达Oct4B1基因可诱导人结直肠癌SW480细胞发生EMT,增强细胞迁移及侵袭能力,其分子机制可能与提高Twist表达有关。
结直肠癌细胞;Oct4B1;上皮间质转化;Twist
Oct4不但是调控胚胎干细胞(Embryonic stem cell,ES)特性的重要转录因子[1],研究还发现Oct4参与肿瘤干细胞(Cancer stem cells,CSCs)及肿瘤细胞上皮间质转化(Epithelial-mesenchymal transitions,EMT)过程的调控[2,3]。Oct4B1作为Oct4重要的亚型,在结直肠癌及胃癌等肿瘤细胞中高表达,具有抗肿瘤细胞凋亡的作用[4,5],Oct4B1是否调控肿瘤细胞EMT过程,目前鲜见文献报道。本研究拟过表达人结直肠癌SW480细胞中的Oct4B1基因,明确Oct4B1基因是否能够诱导人结直肠癌SW480细胞发生EMT及其可能的机制。
1 材料与方法
1.1 材料 人结直肠癌SW480细胞株购于中国科学院上海细胞库;L-15培养基购于北京迈晨生物有限公司;胎牛血清(FBS)购于美国 Hyclone公司;带G418抗性的Oct4B1过表达质粒及阴性对照质粒于上海吉凯基因化学技术公司构建;LipofectamineTM2000购于美国Invitrogen公司;Transwell小室购于加拿大Biofil公司;Matrigel胶购于美国Clontrch公司;RNA提取试剂盒、反转录试剂盒、SYBR TAQ Real time试剂盒购于大连TaKaRa公司;细胞全蛋白提取试剂盒购于南京凯基公司;兔抗人E-cadherin、N-cadherin、Vimenti、Twist一抗购于美国Eptomics公司;G418购于美国Sigma公司;鼠抗人GAPDH一抗及山羊抗兔、山羊抗鼠二抗购于北京中杉金桥公司。
1.2 方法
1.2.1 瞬时转染实验 转染步骤:①将人结直肠癌SW480细胞于含10%FBS的L-15培养基中培养,待细胞生长状态良好时,用于转染实验;②将呈对数生长期的SW480细胞1×106/孔接种于6孔板,按说明书用LipofectamineTM2000 转染试剂盒将带G418抗性的Oct4B1过表达质粒及阴性对照质粒转染到该细胞中分别得到实验组(SW480-Oct4B1)与对照组(SW480-NC);③转染后48 h收集两组细胞,提取RNA并逆转录成cDNA,用RT-qPCR检测Oct4B1 mRNA的表达水平(具体方法见1.2.5),确定Oct4B1过表达质粒的瞬时转染效果。
1.2.2 构建稳定转染细胞株 (1)因质粒带G418抗性基因,在构建稳定转染细胞株前首先检测G418对SW480细胞的最佳作用浓度:①将SW480细胞接种于24孔板(1×105个/孔)中培养,待融合度达80%用于最佳G418浓度的筛选;②用含10%FBS的 L-15 培养基配制成含不同浓度梯度的G418培养基(0、200、400、800及1 600 μg/ml)分别加入到各孔中,观察细胞凋亡情况,确定最佳的G418浓度。(2)用前述最佳作用浓度的G418加入到瞬时转染质粒后的两组细胞的培养液中,未转染的细胞因G418作用而凋亡,成功转染的细胞因带G418抗性而存活下来,逐步筛选得到的稳定转染的细胞株,用于后续实验,所有实验均重复3次以上。
1.2.3 细胞迁移能力检测 将稳定转染后的细胞株接种于6孔板(1×106个/孔)中培养,待铺满孔板后用针头(1 ml注射器)垂直划出间距约0.5 mm均匀直线,用PBS清洗后继续培养,观察12 h和24 h后细胞在划线处伤口愈合的情况,用愈合率来反映细胞的迁移能力。
1.2.4 细胞侵袭能力检测 实验前12 h用无血清培养两组细胞使其处于饥饿状态,按说明书用无血清培养基把Matrigel胶稀释为2 mg/ml,把Transwell小室放于24孔板后在小室中加入100 μl稀释后的Matrigel胶,于37℃培养箱中静置4 h,在24孔板(下室)加入含20%FBS的L-15培养基600 μl,在Transwell小室(上室)中加入用无血清培养基制备好的细胞浓度为1×105个/ml的细胞悬液250 μl,培养24 h后取出Transwell小室去掉基质胶表面残留的细胞,用2%结晶紫染色,在显微镜下随机观察四个视野求得每个视野穿膜细胞数平均值,通过穿膜细胞数反映其侵袭能力。
1.2.5 RT-qPCR 细胞刮刮取两组细胞,RT-qPCR 法检测目的基因的mRNA水平:①按说明书用RNA提取试剂盒提取细胞的RNA;②逆转录合成cDNA;③SYBR Green染料法进行实时定量PCR反应。反应条件:95℃ 30 s;95℃ 5 s,59℃ 30 s,40个循环;65℃ 5 s,95℃ 5 min;绘制熔解曲线,每次检测设立3个复孔,重复3次。选择GAPDH基因为内参,运用2-ΔΔCt法确定目的基因的相对表达水平[3]。引物序列见表1,由大连宝生物公司设计并构建。
1.2.6 Western blot检测蛋白表达 细胞刮刮取两组细胞,Western blot法检测相应蛋白表达:①按说明书用全蛋白提取试剂盒提取细胞蛋白,-80℃冻存备用;②每孔上样量均为40 μg, 根据目的蛋白的分子量予以相应浓度SDS-PAGE胶分离蛋白,用湿法转膜(1 kD/min)将目的蛋白转移至PVDF 膜上,5%脱脂奶粉封闭1 h后用PBST洗涤3次,加入一抗稀释液(目的蛋白稀释比例均为1∶2 000,内参GADPH为1∶1 000),4℃过夜孵育;次日用PBS洗膜后加入相应的山羊抗兔或山羊抗鼠二抗稀释液(二抗均为1∶5 000稀释),室温孵育1 h后PBS洗膜,用ECL发光并拍照。采用Image-Pro Plus软件对条带的吸光度值进行半定量分析。
表1 引物序列
Tab.1 Primer sequence
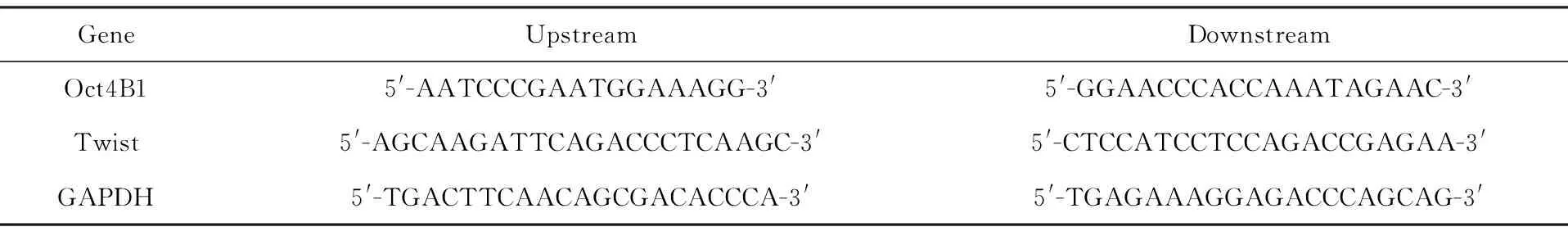
GeneUpstreamDownstreamOct4B15'-AATCCCGAATGGAAAGG-3'5'-GGAACCCACCAAATAGAAC-3'Twist5'-AGCAAGATTCAGACCCTCAAGC-3'5'-CTCCATCCTCCAGACCGAGAA-3'GAPDH5'-TGACTTCAACAGCGACACCCA-3'5'-TGAGAAAGGAGACCCAGCAG-3'
2 结果
2.1 RT-qPCR检测瞬时转染后两组细胞Oct4B1 mRNA表达情况 瞬时转染后48 h,采用RT-qPCR检测两组细胞中Oct4B1 mRNA表达水平,结果实验组较对照组提高了1.3倍,提示瞬时转染成功。
2.2 稳定转染株的构建 G418对SW480细胞的最佳作用浓度为800 μg/ml,在含10%FBS的 L-15 培养基中加入该浓度的G418筛选瞬时转染成功的两组细胞,经筛选成功建立了稳定转染细胞株(见图1A)。稳定转染细胞株建立后,实验组较对照组细胞的Oct4B1 mRNA表达水平提高了1.8倍,实验组明显高于对照组(P<0.01),见图1B。
2.3 细胞迁移能力检测结果 实验组与对照组12 h 在划线处伤口愈合率分别为(45.0±1.2)%和(34.3±1.2)%,继续培养至24 h在划线处伤口愈合率分别为(54.0±1.0)%和(42.0±1.5)%,发现实验组伤口愈合率均明显高于对照组(P<0.01),见图2,提示实验组迁移能力明显强于对照组。
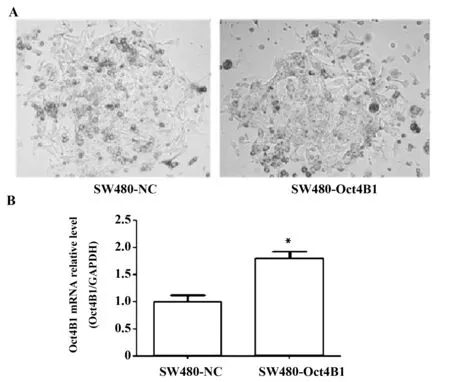
图1 RT-qPCR检测稳定转染后两组细胞Oct4B1 mRNA表达情况Fig.1 Expression of Oct4B1 mRNA in two groups after stable transfection was detected by RT-qPCRNote: Compared with SW480-NC,*.P<0.01.
2.4 细胞侵袭能力检测结果 培养24 h后发现实验组和对照组穿膜细胞数分别为(568.7±20.2)和(398.0±11.0),实验组穿膜细胞数明显高于对照组(P<0.01),见图3,提示实验组细胞侵袭能力强于对照组。
2.5 Western blot检测EMT标记物蛋白表达水平 实验组和对照组中E-cadherin蛋白表达分别为(0.39±0.01)和(0.55±0.02),N-cadherin蛋白表达分别为(0.89±0.03)与(0.61±0.02),Vimentin蛋白表达分别为(1.16±0.04)与(0.68±0.03),实验组上皮标记物E-cadherin蛋白表达量明显低于对照组(P<0.01),而间质标记物N-cadherin及Vimentin表达量显著高于对照组(P<0.01),见图4,以上结果提示实验组相对于对照组细胞发生EMT。
2.6 RT-qPCR检测稳定转染后Twist mRNA表达情况 稳定转染细胞株建立后,实验组较对照组细胞的Twist mRNA表达水平提高了2.1倍,实验组明显高于对照组(P<0.01),见图5。

图2 划痕实验检测12 h和24 h两组细胞的愈合率(×100)Fig.2 Healing rate of two groups of cells was detected by scratch test after 12 h and 24 h(×100)Note: Compared with SW480-NC,*.P<0.01.

图3 Transwell小室检测两组细胞24 h细胞穿膜细胞数(×100)Fig.3 Cell transmembrane number of two groups of cells was detected by transwell assay after 24 h(×100)Note: Compared with SW480-NC,*.P<0.01.
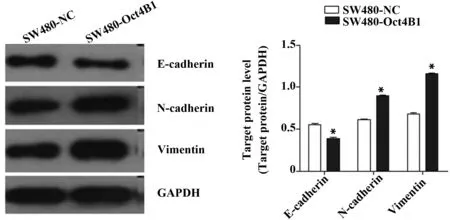
图4 Western blot检测两组细胞E-cadherin、N-cadherin及Vimentin蛋白表达Fig.4 Expression of E-cadherin,N-cadherin and Vimentin protein in two groups of cells was detected by Western blotNote: Compared with SW480-NC,*.P<0.01.
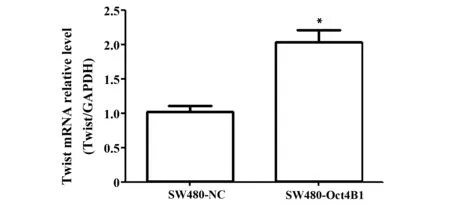
图5 RT-qPCR检测稳定转染后两组细胞Twist mRNA表达情况Fig.5 Expression of Twist mRNA in two groups after stable transfection was detected by RT-qPCRNote: Compared with SW480-NC,*.P<0.01.

图6 Western blot检测两组稳定转染细胞Twist蛋白表达Fig.6 Expression of Twist protein in two groups of cells was detected by Western blotNote: Compared with SW480-NC,*.P<0.01.
2.7 Western blot检测Twist蛋白表达情况 稳定转染细胞株建立后,实验组和对照组中Twist蛋白表达相对水平分别为(0.68±0.02)与(0.40±0.02),实验组较对照组显著增高(P<0.01),见图6。
3 讨论
结直肠癌(Colorectal cancer,CRC)是发病率及死亡率均较高的恶性肿瘤[6],术后复发、转移是其治疗失败的主要原因。研究发现EMT与恶性肿瘤复发、转移密切相关[7]。EMT指的是一个复杂的分子和细胞程序,在这一过程中,上皮细胞失去细胞的极性及细胞间黏附能力,且使得细胞缺乏运动的特性,而获得间质细胞的特性,如运动能力、侵袭力及抗凋亡的能力[8]。EMT的发生由肿瘤微环境中的间质细胞释放相关信号激活EMT转录因子而触发。参与EMT的转录因子包括Snail、Slug、Twist等[9]。EMT的主要特征是上皮表型的缺失及间质特性的获得。上皮细胞的标记物包括E-cadherin、Claudin-1等,而间质的标记物有:N-cadherin、Vimentin、Fibronectin等[9]。
Oct4对ES及CSC均有维持其干细胞特性的作用[1,2],研究还发现Oct4也参与肿瘤EMT过程的调控:Yin等[2]发现在肝癌细胞中Oct4可协同Nanog通过激活STAT3/Snail信号通路增强其迁移、侵袭及增殖的能力,EMT转录因子Twist、Snail及Slug蛋白表达升高,上皮标记物E-cadherin蛋白表达下调,而间质标记物N-cadherin 及Vimentin蛋白表达上调,诱导了EMT发生;Dai等[10]发现在CRC SW620细胞中沉默Oct4基因表达可减弱其迁移和侵袭能力,使E-cadherin蛋白表达上调,vimentin蛋白表达下调,发生了EMT逆转。人Oct4基因按所编蛋白N端差异把它分为3个主要的亚型Oct4A、Oct4B和Oct4B1,之前对Oct4的研究集中在Oct4A上,Oct4B1是最近才发现的Oct4的转录本, Papamichos等[11]认为Oct4B1在维持ES干细胞特性方面的作用比Oct4A更强。研究发现Oct4B1在胃癌、结直肠癌等恶性肿瘤中表达,具有抗肿瘤细胞凋亡的作用[4,5]。而Oct4B1是否在肿瘤细胞EMT过程中起调控作用,目前鲜见文献报道。
为了明确Oct4B1是否诱导结直肠癌细胞发生EMT,我们实施了下列实验:首先用带G418抗性的Oct4B1过表达质粒及阴性对照质粒转染结直肠癌SW480细胞,瞬时转染成功后,予G418筛选成功建立稳定转染的细胞株,用RT-qPCR检测发现实验组(稳定转染Oct4B1过表达质粒)Oct4B1的mRNA水平表达明显高于转染阴性对照质粒的对照组(P<0.01)(见图1B),提示我们所建立的Oct4B1过表达稳定转染细胞株是成功的;接下来研究发现,划痕实验中实验组伤口愈合率明显高于对照组(P<0.01)(见图2),Transwell小室实验中实验组细胞穿膜数显著高于对照组(P<0.01)(见图3),提示过表达Oct4B1基因增强了SW480细胞迁移和侵袭能力;进一步研究发现,Western blot检测实验组上皮标记物E-cadherin蛋白表达明显低于对照组(P<0.01),而间质标记物N-cadherin和Vimentin蛋白表达均明显高于对照组(P<0.01)(见图4)。以上实验结果表明过表达Oct4B1基因可诱导人结直肠癌SW480细胞发生EMT,细胞迁移和侵袭能力提高可能与EMT发生有关。我们进一步采用RT-qPCR及Western blot检测EMT转录因子Twist mRNA及蛋白的表达,结果实验组Twist的mRNA及蛋白水平均明显高于对照组(见图5、6)。提示过表达Oct4B1基因诱导SW480细胞发生EMT,其机制可能与提高Twist表达有关。
综上所述,我们的研究显示过表达Oct4B1基因可诱导人结直肠癌SW480细胞发生EMT,增强细胞迁移及侵袭能力,其分子机制可能与提高Twist表达有关。
[1] Hay DC,Sutherland L,Clark J,etal.Oct-4 knockdown induces similar patterns of endoderm and trophoblast differentiation markers in human and mouse embryonic stem cells[J].Stem Cells,2004,22(2):225-235.
[2] Yin X,Zhang BH,Zheng SS,etal.Coexpression of gene Oct4 and Nanog initiates stem cell characteristics in hepatocellular carcinoma and promotes epithelial-mesenchymal transition through activation of Stat3/Snail signaling[J].J Hematol Oncol,2015,8(1):1-13.
[3] Wen K,Fu Z,Wu X,etal.Oct-4 is required for an antiapoptotic behavior of chemoresistant colorectal cancer cells enriched for cancer stem cells:Effects associated with STAT3/Survivin[J].Cancer Lett,2013,333(1):56-65.
[4] Asadi MH,Mowla SJ,Fathi F,etal.OCT4B1,a novel spliced variant of OCT4,is highly expressed in gastric cancer and acts as an antiapoptotic factor[J].Int J Cancer,2011,128(11):2645-2652.
[5] Gazouli M,Roubelakis MG,Theodoropoulos GE,etal.OCT4 spliced variant OCT4B1 is expressed in human colorectal cancer[J].Mol Carcinog,2012,51(2):165-173.
[6] Miller KD,Siegel RL,Lin CC,etal.Cancer treatment and survivorship statistics,2016[J].CA Cancer J Clin,2016,66(4):271-289.
[7] Smith BN,Bhowmick NA.Role of EMT in Metastasis and Therapy Resistance[J].J Clin Med,2016,5(2):1-17.
[8] Polyak K,Weinberg RA.Transitions between epithelial and mesenchymal states:acquisition of malignant and stem cell traits[J].Nat Rev Cancer,2009,9(4):265-273.
[9] Thiery JP,Acloque H,Huang RY,etal.Epithelial-mesenchymal transitions in development and disease[J].Cell,2009,139(5):871-890.
[10] Dai XZ,Ge J,Wang XH,etal.OCT4 regulates epitheli-al-mesenchymal transition and its knockdown inhibits colorectal cancer cell migration and invasion[J].Oncol Rep,2013,29(1):155-160.
[11] Papamichos SI,Kotoula V,Tarlatzis BC,etal.OCT4B1 isoform:the novel OCT4 alternative spliced variant as a putative marker of stemness[J].Mol Hum Reprod,2009,15(5):269-270.
[收稿2016-11-03]
(编辑 倪 鹏)
Overexpression of Oct4B1 induces epithelial mesenchymal transition in colorectal cancer SW480 cells
CHENYi-Lin,WENKun-Ming,HUShui-Qing,CHENZheng-Quan,ZENGQing-Liang.
DepartmentofGastrointestinalSurgery,theAffiliatedHospitalofZunyiMedicalCollege,Zunyi563000,China
Objective:To investigate whether the overexpression of Oct4B1 gene induces epithelial mesenchymal transition in human colorectal cancer SW480 cells and its possible mechanism.Methods: Experimental group(SW480-Oct4B1):Transfection of SW480 cell lines in colorectal cancer with Oct4B1 overexpression plasmid;Control group(SW480-Oct4B1):negative control plasmid with G418 resistance.Stably transfected cell lines were obtained by G418 culture medium.The two groups were compared with:①Detection of Oct4B1 gene expression in stably transfected cell lines by RT-qPCR;②Scratches and Transwell assays were used to estimate migration and invasion;③Detection of EMT related markers E-cadherin,N-cadherin and Vimentin protein expression by Western blot assay;④Detection of Twist gene and protein expression by RT-PCR and Western blot assays.Results: The transient transfection was confirmed by RT-qPCR and the stable transfected cell lines were obtained from two groups of cells transfected with G418 culture medium.Compared with the control group:①RT-qPCR revealed increased expression of Oct4B1 gene in the experimental group(P<0.01);②Cell migration and invasion were significantly increased(P<0.01);③Epithelial marker:the expression of E-cadherin protein was significantly decreased (P<0.01),interstitial marker:the expression of N-cadherin and Vimentin protein was significantly increased (P<0.01);④Twist mRNA and protein expression were significantly increased(P<0.01).Conclusion: Overexpression of Oct4B1 gene can induce epithelial mesenchymal transition in human colorectal cancer SW480 cells,its molecular mechanism may be related to the promotion of Twist expression.
Colorectal cancer cells;Oct4B1;Epithelial-mesenchymal transitions;Twist
10.3969/j.issn.1000-484X.2017.05.004
①本文受国家自然科学基金(No.81260369)和贵州省科技厅科学技术基金[黔科合(J)字(2012)2365]资助。
陈奕霖(1988年-),男,硕士,住院医师,主要从事大肠癌基础与临床方面研究,E-mail:254575402@qq.com。
及指导教师:文坤明(1978年-),男,博士,教授,主要从事大肠癌基础与临床方面研究,E-mail:381224619@qq.com。
R735.3+5
A
1000-484X(2017)05-0656-05
