TNF-α、IL-1β和LPS诱导人脐静脉内皮细胞增殖和凋亡的研究
2017-06-05段辉
段辉
(大连医科大学附属第一医院 眼科,辽宁 大连 116001)
TNF-α、IL-1β和LPS诱导人脐静脉内皮细胞增殖和凋亡的研究
段辉
(大连医科大学附属第一医院 眼科,辽宁 大连 116001)
目的体外观察眼表烧伤后早期的炎症因子,如肿瘤坏死因子-α(TNF-α)、白介素1β(IL-1β),以及晚期的炎症因子脂多糖(LPS)对体外培养的人脐静脉内皮细胞(HUVEC)增殖和凋亡的影响,并为下一步探讨眼表烧伤后不同时期炎症致内皮损伤的机制提供理论基础。方法本实验随机分为4组:正常组、TNF-α组、IL-1β组和LPS组。采用活细胞计数法试剂盒(CCK-8)法测定细胞的增殖活性,台盼蓝排除染色法检测细胞的增殖数量,吖啶橙/溴化乙锭(AO-EB)染色法检测细胞的凋亡,以及采用流式细胞仪检测细胞的凋亡率。结果①CCK-8法检测结果显示,正常组细胞的增殖活性增高,其余3组细胞的增殖活性下降,且LPS组细胞的增殖活性下降的趋势大于IL-1β组和TNF-α组,IL-1β组细胞增殖活性下降的趋势大于TNF-α组;②台盼蓝排除染色法的定量检测结果趋势类似于CCK-8法检测结果;③AO-EB染色结果显示,正常组细胞被吖啶橙(AO)染成绿色或黄绿色,细胞形态和结构正常,未见细胞核着橘红色荧光的凋亡细胞或死亡细胞,而其余3组均可见细胞核着橘红色荧光的凋亡细胞或死亡细胞。流式细胞仪检测4组细胞的凋亡率,同样TNF-α组、IL-1β组和LPS组细胞的凋亡率均高于正常组细胞,且LPS组细胞的凋亡率大于IL-1β组;IL-1β组细胞的凋亡率大于TNF-α组,差异有统计学意义(P<0.05)。结论早、晚期的炎症介质TNF-α、IL-1β及LPS均可降低HUVEC的增殖活性,增加其凋亡率,但诱导的程度不同,这可能与不同炎症介质激活的主要分子信号通路不同有关。
眼烧伤;肿瘤坏死因子-α;白介素1β;脂多糖;内皮细胞
眼部烧伤是常见的眼科急症之一,致病因素有热烧伤、化学烧伤和辐射烧伤。无论何种病因,眼前段烧伤后24 h内均表现为角结膜、虹膜及睫状体等眼前段组织缺血、水肿、广泛的血栓形成,以及血管内皮细胞的坏死。由于严重的创伤应激,免疫防御系统招募大量炎症细胞,释放的大量炎症介质可进一步激活炎症细胞,导致最初的炎症信号放大,在体内形成瀑布效应,从而介导早期的炎症反应综合征[1]。其次在烧伤后的中、晚期,由于感染大量细菌引发脓毒症,导致前房积脓,迅猛进展的角膜溃疡、穿孔,眼内容物脱出,甚至发生颅内及全身感染,介导全身性炎症反应综合征[2]。烧伤后释放的各类炎症因子均可诱导眼部内皮细胞发生损伤、凋亡,导致角膜缘毛细血管网扩张,通透性增强,血浆成分渗出,进一步使眼烧伤局部眼表组织发生缺血坏死,角膜水肿及混浊[3]。其中内皮细胞是介导眼部烧伤病程进展的关键。
烧伤早期的炎症以无菌性炎症为主要特点,该时期的炎症因子包括肿瘤坏死因子-α(tumor necro sis factor-α,TNF-α)、白介素1β(Interleukin-1β,IL-1β)、白介素3(Interleukin-3,IL-3)、白介素 6(Interleukin-6,IL-6)及白介素8(Interleukin-8,IL-8)等,其中以TNF-α和IL-1β较为关键,是全身性炎症反应综合征发生的始动因素[4]。而烧伤中、晚期并发的脓毒症,主要是由革兰阴性菌引起的,脂多糖(Lipopolysaccharide,LPS)是革兰阴性细菌细胞壁的一种化学成分,因此烧伤脓毒症是以LPS诱导的炎症反应为主要特点[5]。因此,本文使用烧伤后早期的代表性炎症因子TNF-α、IL-1β及烧伤晚期的代表性炎症因子LPS,体外诱导人脐静脉内皮细胞(human umbilical vein endothelia cells,HUVEC),比较各组细胞增殖和凋亡的改变,从而为下一步探讨眼烧伤后不同时期炎症致内皮损伤的机制提供理论基础。
1 材料与方法
1.1 实验标本、主要仪器及试剂
1.1.1 实验标本 HUVEC和内皮细胞无血清培养基(endothelial cell medium-serum free,ECM-sf)购置于美国Scien Cell公司。
1.1.2 主要试剂 胎牛血清(fetal bovine serum,FBS)、青链双抗、台盼蓝染色液(美国Gibco公司),二甲亚砜(Dimethylsulfoxide,DMSO),碘化丙啶(propidium iodide,PI)(美国Sigma公司),活细胞计数法试剂盒(cell counting kit-8,CCK-8)(日本同仁化学公司),吖啶橙/溴化乙锭(acridine orange/ethidium bromide,AO-EB)(南京森贝伽生物科技有限公司),TNF-α、IL-1β(美国PeproTech公司),LPS(美国Sigma公司)。
1.1.3 主要仪器 二氧化碳CO2培养箱(日本SANYO公司),倒置荧光显微镜(德国Leica公司),450型自动酶标仪系统(美国Bio-Rad公司),流式细胞仪(美国Becton Dickinson公司)。
1.2 HUVEC实验分组
选取第3~5代HUVEC进行实验,本实验分为4组,分别为正常组、TNF-α组(100 ng/ml TNF-α)、IL-1β组(100 ng/ml IL-1β)及LPS组(100 ng/ml LPS)。4组分别处理24、48和72 h后进行一系列指标检测。
1.3 观测指标
1.3.1 CCK-8法检测HUVEC的增殖活性 取第3代HUVEC,按2×104个/孔接种于96孔培养板中,培养24 h后分别更换为各处理液0.2 ml,继续培养。分别于24、48和72h取出1个培养板,每孔加入10 μl CCK-8,培养2 h后于酶标仪上测定450 nm波长处的光密度(optical density,OD)值。
1.3.2 台盼蓝排除染色法检测HUVEC的增殖数量 取第4代HUVEC,按1×105个/孔接种于12孔培养板中,24 h后分别更换为各处理液1.5 ml,继续培养。分别于24、48和72 h取出1个培养板,收集细胞后行台盼蓝排除染色法计数各组细胞的数目。
1.3.3 AO-EB染色检测HUVEC的凋亡 取第4代HUVEC,按1×105个/孔接种于预先放有盖玻片的24孔板中,培养24h后分别更换为各处理液1ml;继续培养24和48 h时取出盖玻片,磷酸盐缓冲溶液(phosphate buffer saline,PBS)反复洗涤3次,采用AO-EB染料(100 μg/ml,1︰1)4 μl进行染色,荧光显微镜下观察。
1.3.4 流式细胞仪检测HUVEC的凋亡率 取第5代HUVEC,按8×103个/cm2种植于25 cm2培养瓶中,培养24 h后分别更换为各处理液5 ml培养;第24和48 h时使用0.25%胰蛋白酶消化,收集细胞,用75%冰乙醇固定,PBS漂洗重悬细胞,300目尼龙筛网过滤,加入RNA酶处理RNA干扰,加入PI标记细胞,上流式细胞仪检测4组的细胞凋亡率。
1.4 统计学方法
数据分析采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)表示,用重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 HUVEC的增殖活性
TNF-α组、IL-1β组和LPS组与正常组在培养24、48和72 h的增殖活性比较,采用重复测量数据的方差分析,结果:①不同时间点细胞增殖的活性有差异(F=180.313,P=0.000);②TNF-α组、IL-1β组、LPS组与正常组的细胞增殖的活性有差异(F= 280.189,P=0.000),TNF-α组、IL-1β组、LPS组与正常组比较,细胞增殖活性均下降;③4组的增殖变化趋势有差异(F=89.866,P=0.000)。见表1和图1。2.2 HUVEC的增殖数量
TNF-α组、IL-1β组、LPS组与正常组在培养24、48和72h的增殖数量比较,采用重复测量数据的方差分析,结果:①不同时间点细胞增殖数量有差异(F=1.288E4,P=0.000);②TNF-α组、IL-1β组、LPS组与正常组的细胞增殖数量有差异(F=596.965,P= 0.000),TNF-α组、IL-1β组、LPS组与正常组比较,细胞增殖数量均下降;③4组的增殖数量变化趋势有差异(F=6.474,P=0.000)。见表2和图2。
2.3 HUVEC的细胞凋亡
培养24和48h时,正常组细胞均被吖啶橙(AO)染成绿色或黄绿色,细胞形态和结构正常,未见细胞核着橘红色荧光的凋亡细胞或死亡细胞,而其余3组均可见细胞核着橘红色荧光的凋亡细胞或死亡细胞,且LPS组细胞凋亡的数目大于IL-1β组和TNF-α组。见图3。
表1 4组HUVEC的增殖活性比较 (±s)
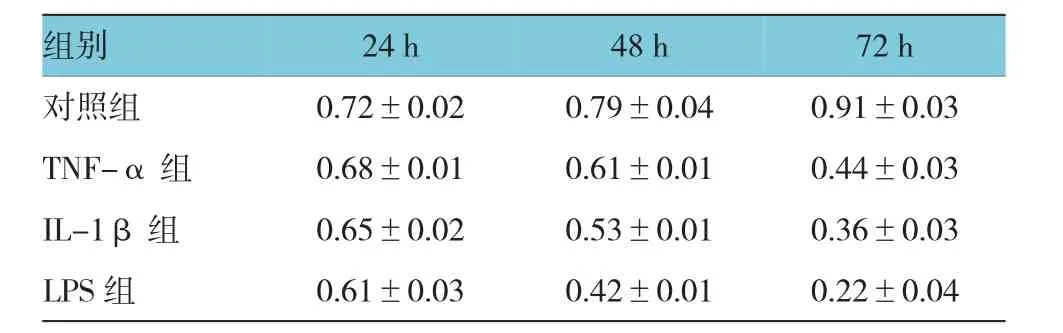
表1 4组HUVEC的增殖活性比较 (±s)
组别72 h对照组 0.72±0.02 0.79±0.04 0.91±0.03 TNF-α组 0.68±0.01 0.61±0.01 0.44±0.03 IL-1β组 0.65±0.02 0.53±0.01 0.36±0.03 LPS组 0.61±0.03 0.42±0.01 0.22±0.04 24 h 48 h
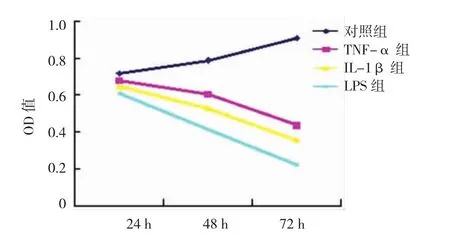
图1 4组HUVEC的增殖曲线
表2 4组HUVEC的增殖数量比较 (个,±s)
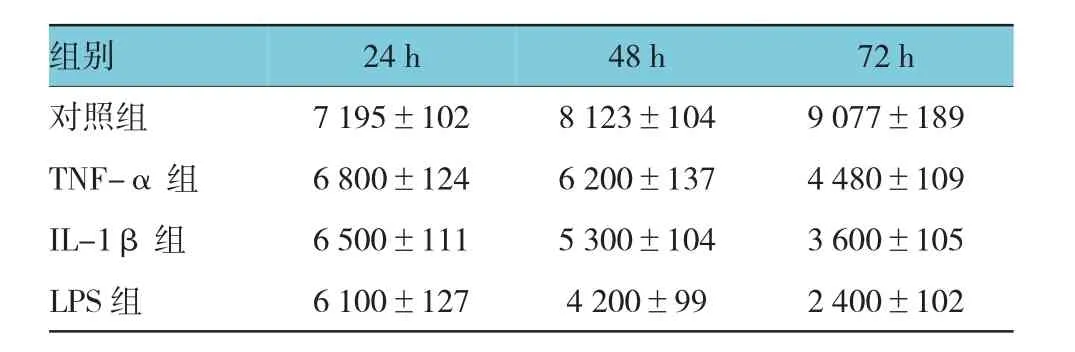
表2 4组HUVEC的增殖数量比较 (个,±s)
组别72 h对照组 7 195±102 8 123±104 9 077±189 TNF-α组 6 800±124 6 200±137 4 480±109 IL-1β组 6 500±111 5 300±104 3 600±105 LPS组 6 100±127 4 200±99 2 400±102 24 h 48 h
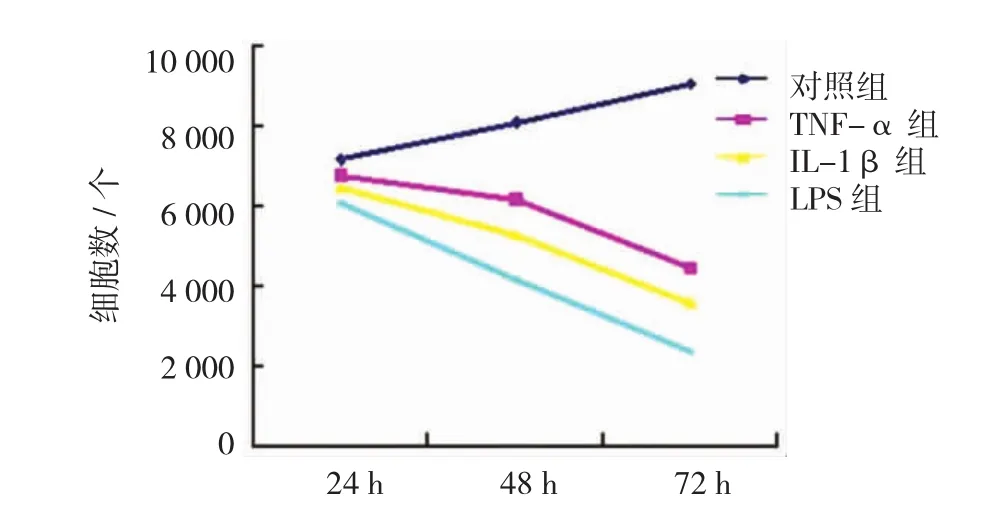
图2 4组HUVEC的增殖数量
2.4 HUVEC的凋亡率
培养24 h,正常组、TNF-α组、IL-1β组及LPS组细胞的凋亡率细胞分别为(2.11±1.30)%、(9.63±1.48)%、(22.19±1.37)%和(29.78±3.20)%。培养48 h后,4组细胞的凋亡率分别为(2.08± 0.72)%、(6.57±0.87)%、(16.42±2.56)%和(24.62± 3.86)%。TNF-α组、IL-1β组、LPS组与正常组在培养24和48 h时增殖数量的比较,采用重复测量数据的方差分析,结果:①不同时间点细胞的凋亡率有差异(F=230.326,P=0.000);②TNF-α组、IL-1β组、LPS组与正常组的细胞凋亡率有差异(F=80.928,P= 0.000),TNF-α组、IL-1β组、LPS组与正常组比较,细胞的凋亡率均增加。③TNF-α组、IL-1β组、LPS组与正常组的凋亡率变化趋势有差异(F=31.471,P= 0.000)。见图4。
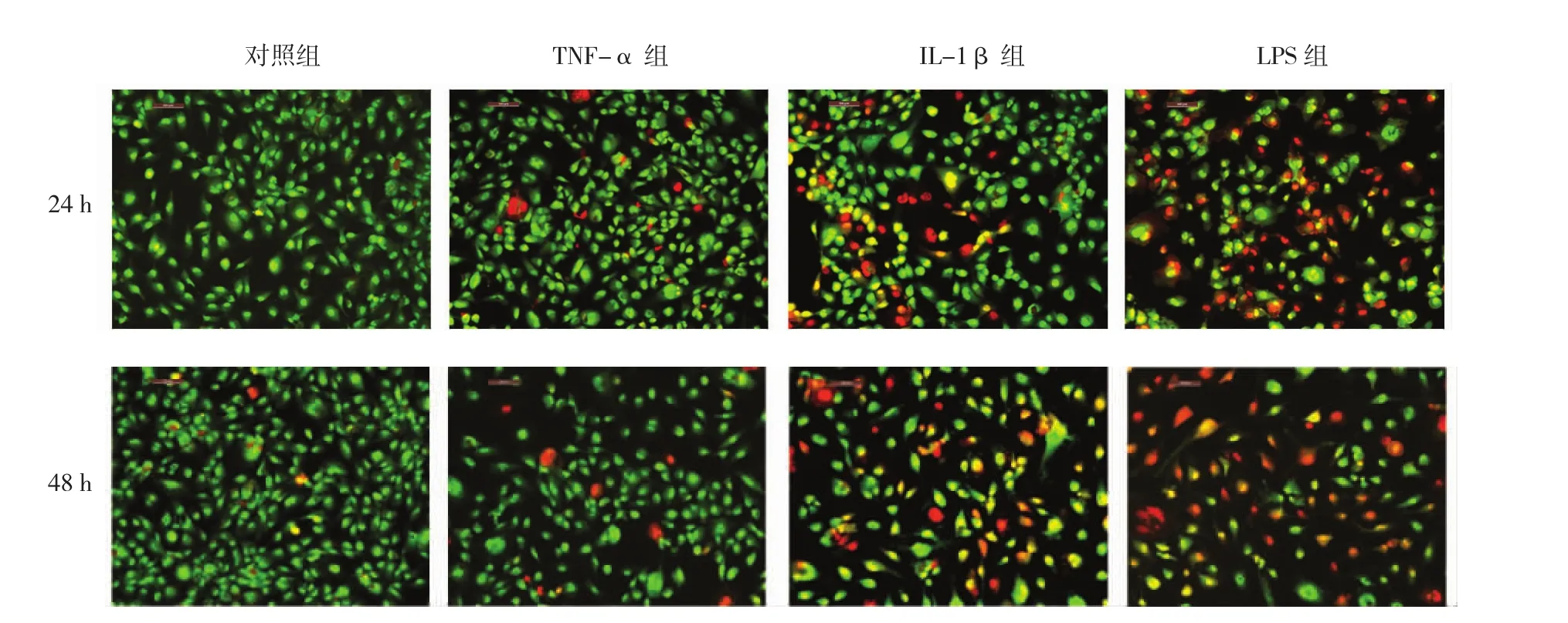
图3 4组HUVEC的凋亡情况 (倒置荧光显微镜,AO-EB染色×100)

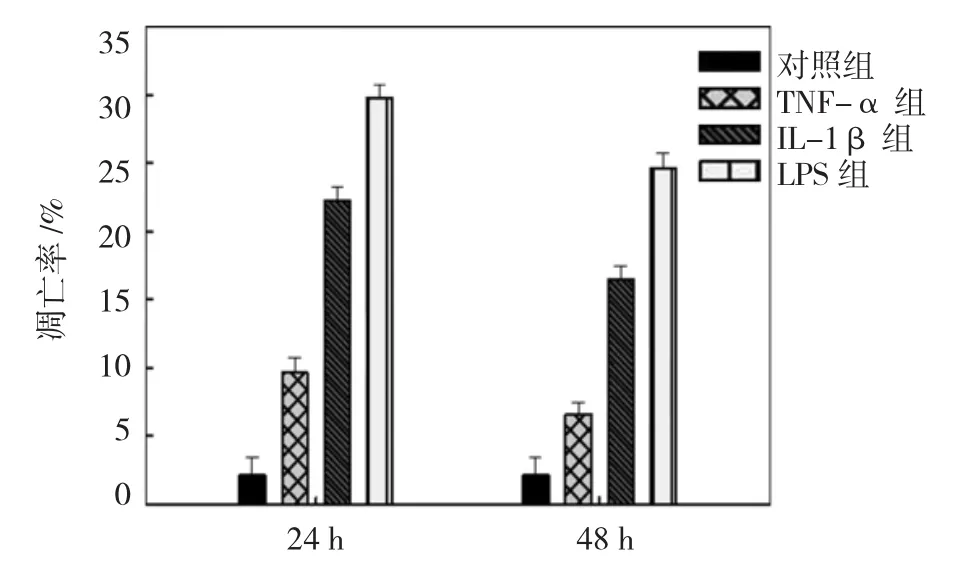
图4 流式细胞仪检测4组HUVEC的凋亡率
3 讨论
烧伤后早期的创伤应激及中、晚期细菌感染引发的脓毒症,均使眼球及其附属器发生严重损伤,结构和功能发生破坏,甚至致盲[6]。烧伤后不同时期引发炎症反应的致伤因子不同,如早期以TNF-α和白介素类因子为主导,中、晚期以LPS为主导,因此介导的发生机制也有所不同[7]。
眼烧伤后早期损伤的关键是血管内皮细胞的屏障结构和功能受损,血管通透性增加,血管内炎症细胞聚集、黏附及渗出导致角膜水肿及混浊。紧随其后的血管增殖期为损伤的毛细血管内皮细胞及炎症细胞释放大量血管活性物质,如血管内皮生长因子(vascular endothelial growth factor,VEGF),促使新生血管形成,影响角膜的透明性[8]。因此内皮细胞是眼烧伤后发生各类并发症基础。也有研究称,内皮细胞是各类炎症介质的效应细胞,各类炎症因子通过与内皮表面表达的相应受体结合,启动其下游的信号,进而介导细胞发生损伤或者凋亡[9-10]。
本研究采用烧伤后早期代表性的炎症因子TNF-α、IL-1β,及中、晚期代表性的炎症因子LPS培养人脐静脉内皮细胞,观察该细胞增殖和凋亡的变化。结果显示,TNF-α、IL-1β和LPS均可降低人脐静脉内皮细胞的增殖活性和增殖数量,且LPS诱导人脐静脉细胞增殖活性和增殖数量下降的趋势大于IL-1β组和TNF-α组;IL-1β组细胞增殖活性和增殖数量下降的趋势大于TNF-α组细胞。同样地,AO-EB染色定性和流式定量检测细胞的凋亡结果显示,TNF-α、IL-1β及LPS可增加人脐静脉内皮细胞的凋亡数量,且LPS诱导人脐静脉细胞凋亡率高于IL-1β组和TNF-α组;IL-1β组细胞凋亡率大于TNF-α组,这可能是3者与细胞表面各自特异的受体相结合,启动下游不同的信号通路有关。TNF-α能诱导激活多条激酶通路,如NF-κB、JNK、ERK、P38及PI3K的信号转导,从而调控包括细胞增殖、分化到凋亡等细胞过程[11]。XU等[12]研究表明,TNF-α可通过与内皮祖细胞表面的受体结合启动下游的ERK/MAPK和NF-κB信号通路,进而诱导内皮祖细胞发生凋亡。同样IL-1β也是与内皮细胞表面相应的受体结合,通过上调凋亡相关蛋白Bax和下调Bcl2,诱导细胞色素C的释放,进一步活化Caspase-3而导致内皮细胞发生凋亡[13]。而LPS可通过激活细胞表面的受体,激活凋亡信号调节激酶1(apoptosis signal regulating kinase-1,ASK-1),以及NF-κB和MAPKs级联过程[14]。
综上所述,虽然TNF-α、IL-1β及LPS在致人脐静脉内皮细胞增殖活性和凋亡发生的趋势相同,但是各组间仍有差异,提示眼烧伤不同时期的血管内皮细胞发生损伤程度并不相同,这可能与其诱导下游不同信号机制有关。仍需进一步探讨其分子机制,为临床治疗提供理论依据。
[1]FARINA J A,ROSIQUE M J,ROSIQUE R G.Curbing inflammation in burn patients[J].Int J Inflam,2013,DOI:10.1155/2013/71 5645.
[2]SILVERSIDES J A,FERGUSON A J,MCAULEY D F,et al. Fluid strategies and outcomes in patients with acute respiratory distress syndrome,systemic inflammatory response syndrome and sepsis:a protocol for a systematic review and meta-analysis[J]. Syst Rev,2015,4(1):162.
[3]JAVORKOVA E,TROSAN P,ZAJICOVA A,et al.Modulation of the early inflammatory microenvironment in the alkali-burned eye by systemically administered interferon-γ-treated mesenchymal stromal cells[J].Stem Cells Dev,2014,23(20):2490-2500.
[4]LIU L,LI X,YANG J,et al.Comparison of systemic inflammation response and vital organ damage induced by severe burns in different area[J].Int J Clin Exp Pathol,2015,8(6):6367-6376.
[5]LIU Y,BAO L,XUAN L,et al.Chebulagic acid inhibits the LPS-induced expression of TNF-α and IL-1β in endothelial cells by suppressing MAPK activation[J].Exp Ther Med,2015, 10(1):263-268.
[6]ZHOU Q,YANG L,QU M,et al.Role of senescent fibroblasts on alkali-induced corneal neovascularization[J].J Cell Physiol, 2012,227(3):1148-1156.
[7]TAO K,BAI X,JIA W,et al.Effects of resveratrol on the treatment of inflammatory response induced by severe burn[J]. Inflammation,2015,38(3):1273-1280.
[8]邱培瑾,姚克,朱丽君,等.鼠角膜碱烧伤后血管内皮细胞生长因子在其角膜中的表达及意义[J].中华眼科杂志,2002,38(5):311-314.
[9]MA J,BAI J.Protective effects of heparin on endothelial cells in sepsis[J].Int J Clin Exp Med,2015,8(4):5547-5552.
[10]SEOK S M,PARK T Y,PARK H S,et al.Fructose-1,6-bisphosphate suppresses lipopolysaccharide-induced expression of ICAM-1 through modulation of toll-like receptor-4 signaling in brain endothelial cells[J].Int Immunopharmacol,2015,26(1): 203-211.
[11]郑晓珂,刘彩霞,翟英英,等.卷柏中穗花杉双黄酮对TNF-α诱导的血管内皮细胞损伤的保护作用[J].药学学报,2013,48(9): 1503-1509.
[12]XU S,ZHAO Y,YU L,et al.Rosiglitazone attenuates endothelial progenitor cell apoptosis induced by TNF-α via ERK/MAPK and NF-κB signal pathways[J].J Pharmacol Sci,2011,117(4): 265-274.
[13]ZHU X,XIE M,WANG K,et al.The effect of puerarin againstIL-1β-mediated leukostasisand apoptosisin retinal capillary endothelial cells (TR-iBRB2)[J].Mol Vis,2014,20: 1815-1823.
[14]CHUANG Y F,CHEN M C,HUANG S W,et al.Protein phosphatase 2A in lipopolysaccharide-induced cyclooxygenase-2 expression in murine lymphatic endothelial cells[J].PLoS One, 2015,10(8),DOI:10.1371/journal.pone.
(童颖丹 编辑)
Effect of TNF-α,IL-1β and LPS on proliferation and apoptosis of human umbilical vein endothelial cells
Hui Duan
(Department of Ophthalmology,the First Affiliated Hospital of Dalian Medical University,Dalian,Liaoning 116001,China)
ObjectiveTo investigate the effect of TNF-α,IL-1β and LPS on proliferation and apoptosis of human umbilical vein endothelial cells (HUVECs)in vitro,so as to further study the mechanism of endothelial cell injury induced by inflammatory cytokines in different period after eye burn.MethodsThe HUVECs were randomly divided into control group,TNF-α group,IL-1β group and LPS group.Cell proliferation activity was assessed by CCK-8.The number of proliferative cells was detected by trypan blue exclusion staining. The apoptosis was assessed by AO-EB staining.The apoptosis rate was detected by flow cytometry.ResultsCompared to the control group,the cell proliferation activity in the other 3 groups were markedly decreased in a downward trend from TNF-α group,IL-1β group to LSP group.Meanwhile,the results of proliferative cell counting were also similar with CCK-8 results.The cell structures in the control group were normal,and apoptotic cells were observed in the other 3 groups.Compared with the control group,the apoptosis rate ofHUVECs in the TNF-α,IL-1β and LPS groups was significantly increased;and the cell apoptosis rate of the LPS group was markedly higher than that of the TNF-α and IL-1β groups,and the cell apoptosis rate of the IL-1β group was markedly higher than that of the TNF-α group (P<0.05).ConclusionsThe inflammatory cytokines such as TNF-α,IL-1β and LPS in early and late stages after burn can significantly decrease proliferative activity of HUVECs and increase the apoptosis rate in different degrees.This may be related to different signaling pathways activated by different inflammatory mediators.
eye burn;tumor necrosis factor-α;interleukin-1β;lipopolysaccharide;endothelial cell
R779.1
A
10.3969/j.issn.1005-8982.2017.09.006
1005-8982(2017)09-0030-05
2016-04-21
