姬松茸多糖ABP-AW1对免疫功能低下小鼠的免疫增强作用
2017-06-05蒋丽艳于智浦姚淑娟刘伯阳刘吉成
蒋丽艳,于智浦,姚淑娟,刘伯阳,刘吉成
(齐齐哈尔医学院1.医学技术学院,2.附属第二医院,黑龙江齐齐哈尔 161000)
·论 著·
姬松茸多糖ABP-AW1对免疫功能低下小鼠的免疫增强作用
蒋丽艳1,于智浦2,姚淑娟1,刘伯阳1,刘吉成1
(齐齐哈尔医学院1.医学技术学院,2.附属第二医院,黑龙江齐齐哈尔 161000)
目的探讨低分子质量姬松茸多糖ABP-AW1对免疫功能低下小鼠的免疫增强作用。方法ICR小鼠ip给予环磷酰胺80 mg·kg-1,连续3 d,制备免疫功能低下小鼠模型;随后分别ig给予ABP-AW1 125,250和500 mg·kg-1,每天1次,连续7 d。治疗结束后处死小鼠,检测小鼠胸腺指数和脾指数,碳廓清实验检测小鼠巨噬细胞吞噬功能,MTT法检测小鼠脾淋巴细胞增殖反应,ELISA法检测小鼠脾淋巴细胞分泌白细胞介素2(IL-2)和干扰素γ(IFN-γ)水平,流式细胞术检测小鼠脾T淋巴细胞亚群CD4+/CD8+比值。结果与正常对照组比较,免疫低下模型小鼠胸腺指数和脾指数以及巨噬细胞吞噬指数均降低(P<0.05);ABPAW1 250和500 mg·kg-1可显著提高免疫低下模型小鼠胸腺指数和脾指数(P<0.05),升高巨噬细胞吞噬指数(P<0.05)。与正常对照组比较,模型小鼠伴刀豆凝集素A(Con A)和脂多糖(LPS)分别诱导的T淋巴细胞增殖反应和B淋巴细胞增殖反应降低,脾细胞分泌IL-2和IFN-γ水平降低,脾细胞CD4+/CD8+比值下降(P<0.05);与模型组比较,ABP-AW1 250和500 mg·kg-1可促进免疫低下模型小鼠Con A和LPS分别诱导的T淋巴细胞增殖反应和B淋巴细胞增殖反应(P<0.05),显著增加脾细胞IL-2和IFN-γ水平(P<0.05),明显逆转免疫低下小鼠脾细胞CD4+/CD8+比值的下降(P<0.05)。结论ABP-AW1对免疫功能低下小鼠具有一定的免疫增强作用。
姬松茸;多糖;ABP-AW1;环磷酰胺;免疫抑制
姬松茸(Agaricus blazeiMurill,ABM)又名巴西蘑菇,原产于巴西,是一种兼具药用及食用价值的名贵真菌[1]。研究表明,药用ABM具有免疫调节、抗炎和抗肿瘤等多种药理学作用[2]。多糖是ABM的主要成分之一,因其具有天然、低毒等优势而受到广大学者的关注。大量实验资料表明,ABM多糖有抗炎和抗肿瘤等功效[3-5]。本实验室从ABM子实体中分离纯化出一种结构新颖的水溶性多糖,代号为ABP-AW1,并经气相色谱和高效凝胶排阻色谱等方法确定其为组分均一的低分子质量(50 ku)多糖[6]。前期研究结果表明,ABP-AW1可以增强卵白蛋白致敏小鼠的体液免疫和细胞免疫功能[7]。本研究观察ABP-AW1对免疫功能低下模型小鼠的免疫增强作用,为其开发应用提供实验依据。
1 材料与方法
1.1 药物、主要试剂和仪器
ABP-AW1由齐齐哈尔医学院医药研究所分离纯化[6],纯度>95%,用生理盐水配置。注射用环磷酰胺(cyclophosphamide,Cy)购自上海华联制药有限公司,用生理盐水配置;RPMI 1640培养基和胎牛血清(fetal bovine serum,FBS)购自美国HyClone公司;小鼠脾淋巴细胞分离液、白细胞介素2(interleukin 2,IL-2)和干扰素γ(interferon-γ,IFN-γ)检测用ELISA试剂盒购自北京达科为生物技术有限公司;大鼠抗小鼠CD4-FITC抗体、大鼠抗小鼠CD8a-PE抗体、MTT和二甲亚砜(DMSO)均购自美国Sigma公司;伴刀豆凝集素A(concanavalin A,ConA)和脂多糖(lipopolysaccharides,LPS)购自美国Sigma公司。酶标仪(奥地利TECAN公司);FACS Calibur流式细胞仪(美国BD公司)。
1.2 动物
健康雌性ICR小鼠,体质量18~22 g,由吉林大学白求恩医学院实验动物中心提供,实验动物合格证号SCXK(吉)-2015-003。小鼠常规饲养于齐齐哈尔医学院实验动物中心,许可证SYXK(黑)2016-001,室温20~24℃,湿度55%~70%,12/12 h光照/黑暗,自由饮水摄食。
1.3 动物分组和给药
将小鼠随机分为5组:正常对照组、模型对照组及ABP-AW1 125,250和500 mg·kg-1组,每组10只。除正常对照组外,各组小鼠ip给予Cy 80 mg·kg-1,每天1次,连续3 d,制备免疫低下模型小鼠;正常对照组小鼠给予等量生理盐水。随后ABP-AW1组小鼠每天分别ig给予ABP-AW1 125,250和500 mg·kg-1,每天1次,连续7 d;正常对照组和模型对照组予以等量生理盐水。
1.4 小鼠巨噬细胞吞噬功能的测定
末次给药后1 h,测体质量,各鼠尾静脉注射印度墨汁(10 mL·kg-1),注射后2 min(T1)和10 min(T2)从小鼠眼眶静脉丛取血20 μL,溶于0.1% Na2CO3溶液2.0 mL,摇匀后放置20 min,于680 nm波长处测定T1和T2时间点样品的吸光度(A1和A2)值。根据公式计算廓清指数(K),K=(lgA1-lgA2)/(T2-T1)[8]。将小鼠处死,取肝和脾称重,计算吞噬指数(α),α=K1/3×体质量/(肝质量+脾质量)[8]
1.5 小鼠脏器指数的测定
分离小鼠脾和胸腺,称重,依据公式计算脾指数和胸腺指数。胸腺指数=胸腺质量(mg)/体质量(g);脾指数=脾质量(mg)/体质量(g)。
1.6 小鼠脾淋巴细胞增殖实验
参照小鼠脾淋巴细胞分离液说明书,分离各组小鼠脾淋巴细胞,制备脾淋巴细胞悬液。按每孔100 μL含5×105细胞将细胞接种至96孔培养板[9]。设细胞对照组、Con A组和LPS组,每组设3复孔。细胞对照组细胞用完全培养基常规培养,Con A和LPS组细胞在接种当天分别给予含Con A 5 mg·L-1或LPS 1 mg·L-1的培养基培养。将细胞置于37℃、含5%CO2的培养箱中培养60 h后,各孔加入MTT 5 g·L-1溶液20 μL,继续培养4 h。随后弃上清液,每孔加入150 μL DMSO,振荡溶解结晶,酶标仪测定570 nm波长处的吸光度(A570nm)值。
1.7 小鼠脾淋巴细胞IL-2和IFN-γ水平的测定
参照IL-2和IFN-γ的ELISA试剂盒说明书,检测1.6项制备的脾淋巴细胞培养上清液中IL-2及IFN-γ的含量。
1.8 流式细胞术检测小鼠脾T淋巴细胞亚群CD4+/ CD8+比值
取各组小鼠脾淋巴细胞悬液50 μL置于流式管中,加入大鼠抗小鼠CD4-FITC抗体和大鼠抗小鼠CD8a-PE抗体,混匀后在室温下避光孵育30 min。加入PBS 2 mL,250×g离心5 min,用PBS洗涤细胞2次。弃去上清,加入PBS 0.5 mL溶液将细胞重悬,用BD FACS Calibur流式细胞仪检测CD4+和CD8+T淋巴细胞,计算CD4+/CD8+比值。
1.9 统计学分析
实验结果数据以x±s表示,应用统计软件SPSS17.0进行数据统计分析,组间比较采用单因素方差(ANOVA)分析和t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 ABP-AW1对免疫低下小鼠巨噬细胞吞噬功能的影响
图1结果可见,与正常对照组相比,Cy诱导的免疫抑制小鼠巨噬细胞吞噬功能减退,吞噬指数显著减小(P<0.05)。与模型组相比,ABP-AW1 250和500 mg·kg-1治疗7 d,可显著提高Cy所致免疫低下模型小鼠巨噬细胞吞噬指数(P<0.05)。

Fig.1 Effect of ABP-AW1,low-molecular-mass poly⁃saccharides isolated from Agaricus blazei Murill,on phagocytic index of cyclophosphamide(Cy)-induced immunosuppression mice.Mice were ip given Cy 80 mg·kg-1once daily for three days,and then were administrated ig with ABP-AW1 for 7 d.,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with Cy group.
2.2 ABP-AW1对免疫低下小鼠脏器指数的影响
图2结果可见,与正常对照组比较,模型组小鼠胸腺指数和脾指数显著降低(P<0.05)。与模型组相比,ABP-AW1 250和500 mg·kg-1治疗7 d显著提高免疫低下小鼠的胸腺指数和脾指数(P<0.05),但尚未达到正常对照组水平。
2.3 ABP-AW1对免疫低下小鼠脾淋巴细胞增殖反应的影响
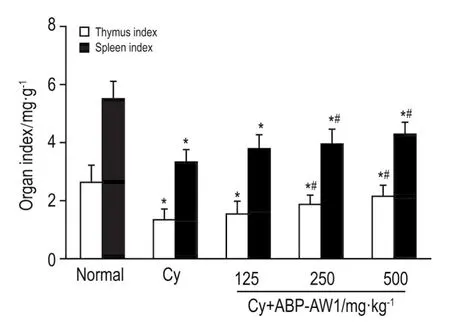
Fig.2 Effect of ABP-AW1 on organ index of Cy-induced immunosuppression mice.See Fig.1 for the mouse treat⁃ment.Thymus index=thymus mass(mg)/body mass(g).Spleen index=spleen mass(mg)/body mass(g).n=10.*P<0.05,compared with corresponding normal control group;#P<0.05,compared with corresponding Cy group.
图3结果表明,采用Con A和LPS分别刺激脾淋巴细胞,模型小鼠脾淋巴细胞增殖反应均受到明显抑制(P<0.05);与模型组相比,ABP-AW1 250和500 mg·kg-1治疗7 d可促进Con A诱导的T淋巴细胞增殖反应(P<0.05)和LPS诱导的B淋巴细胞增殖反应(P<0.05),只有500 mg·kg-1组可以达到正常对照组水平,其余组与正常对照组相比仍有显著差异(P<0.05)。

Fig.3 Effect of ABP-AW1 on spleen lymphocyte prolifer⁃ation induced by concanavalin A(Con A)or lipopoly⁃sacchride(LPS)in Cy-induced immunosuppression mice detected by MTT method.See Fig.1 for the mouse treatment.n=10.*P<0.05,compared with corresponding normal control group;#P<0.05,compared with corresponding Cy group.
2.4 ABP-AW1对免疫低下小鼠脾细胞细胞因子生成的影响
图4结果可见,模型组小鼠脾细胞IL-2和IFN-γ水平较正常对照组显著降低(P<0.05)。给予ABPAW1 250和500 mg·kg-1治疗7 d,能显著增加免疫低下小鼠脾细胞IL-2和IFN-γ的生成(P<0.05),但均未恢复至正常对照组水平(P<0.05)。

Fig.4 Effect of ABP-AW1 on levels of interleukin-2(IL-2)and interferon-γ(IFN-γ)in spleen lymphocytes of Cyinduced immunosuppression mice.See Fig.1 for the mouse treatment.,n=10.*P<0.05,compared with corre⁃sponding normal control group;#P<0.05,compared with corre⁃sponding Cy group.
2.5 ABP-AW1对免疫低下小鼠T淋巴细胞亚群CD4+/CD8+的影响
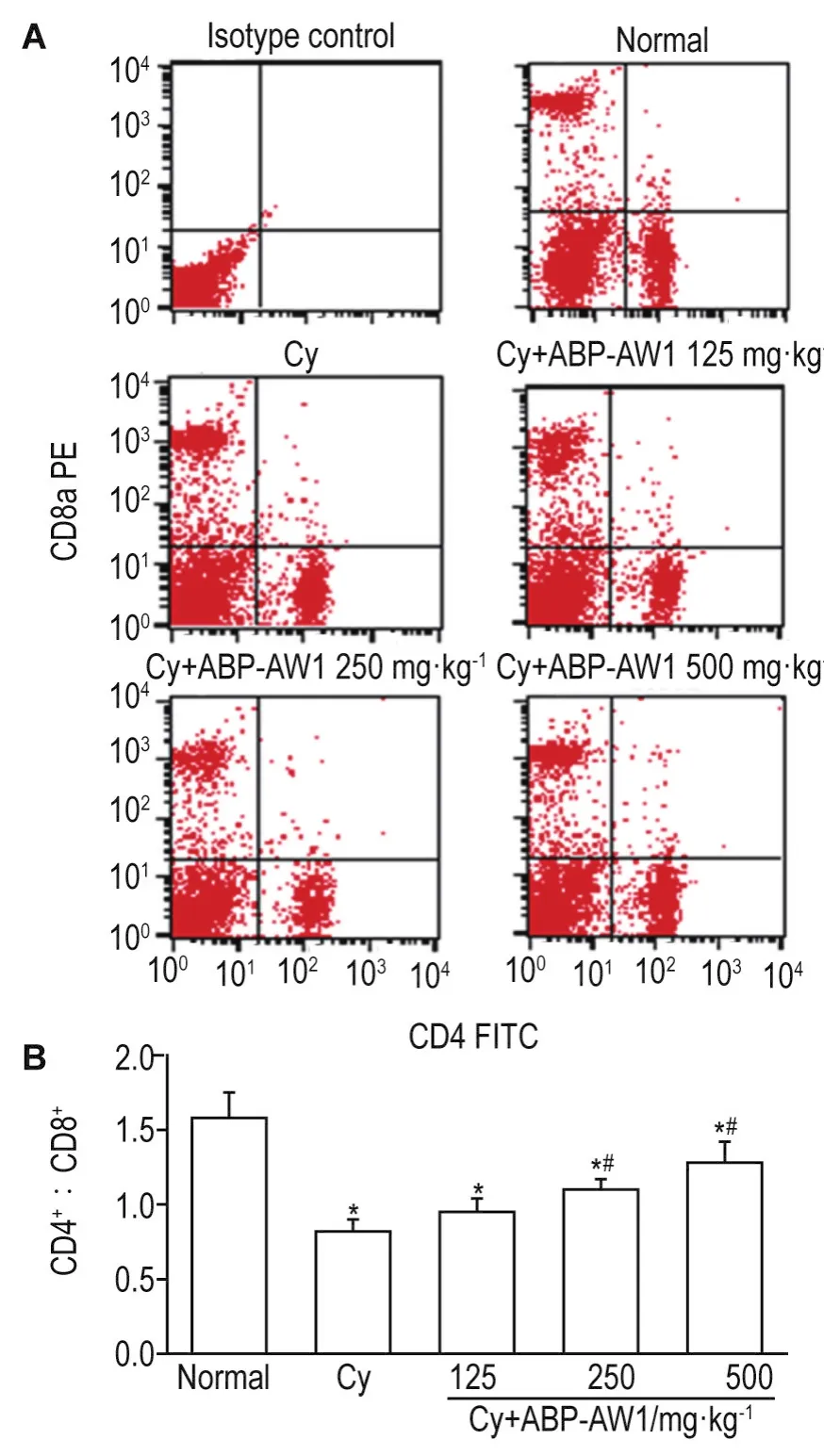
Fig.5 Effect of ABP-AW1 on T lymphocyte CD4+/CD8+ratio in spleen of Cy-induced immunosuppression mice.See Fig.1 for the mouse treatment.A:representative data of flow cytometric analysis;B:the quantification of A.n=10.*P<0.05,compared with normal control group;#P<0.05,com⁃pared with Cy group.
图5结果表明,与正常对照组相比,免疫低下模型小鼠脾T淋巴细胞亚群CD4+/CD8+比值显著降低(P<0.05)。与模型组相比,ABP-AW1 250和500 mg·kg-1治疗7 d可逆转免疫低下模型小鼠脾细胞CD4+/CD8+比值的下降(P<0.05),但尚未达到正常对照组水平。
3 讨论
Cy是一种烷化类免疫抑制剂,可杀伤淋巴细胞,抑制细胞免疫和体液免疫,因而常用于制备免疫功能低下动物模型[10-12]。本研究选用单次ip给予Cy 80 mg·kg-1抑制小鼠免疫功能。结果显示,模型组小鼠免疫功能与正常对照组比较明显降低,表明成功制备免疫功能低下小鼠模型。
本课题组前期研究结果显示,低分子量ABM多糖具有抗肿瘤功效,能显著抑制体外培养肝癌细胞的迁移能力[4]。这种抗肿瘤效应可能与其增强NK细胞活性有关[13],提示低分子质量ABM多糖可能具有免疫增强作用。本研究进一步研究了低分子质量ABM多糖ABP-AW1对免疫功能低下小鼠的免疫增强作用。结果显示,小鼠ig给予ABP-AW1 250和500 mg·kg-1治疗7 d,可改善免疫低下小鼠胸腺和脾萎缩,使胸腺指数和脾指数升高。
单核巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的指标之一[14]。本研究结果表明,ABPAW1 250和500 mg·kg-1组小鼠巨噬细胞吞噬指数较模型组明显提高,提示ABP-AW1对免疫低下小鼠的非特异性免疫功能有一定的增强作用。淋巴细胞增殖反应能够直接反映机体免疫功能状态。淋巴细胞按其功能不同可分为B淋巴细胞、T淋巴细胞和NK细胞。一般以LPS刺激B淋巴细胞增殖,Con A诱导T淋巴细胞增殖,用于检测检测B和T细胞的免疫反应[15-16]。本研究结果表明,ABPAW1治疗7 d能显著促进免疫低下小鼠脾T淋巴细胞和B淋巴细胞增殖反应,提示ABP-AW1可能通过促进机体淋巴细胞的增殖活性,提高机体免疫功能。IL-2和IFN-γ是在机体免疫调节中起重要作用的细胞因子,主要由活化的Th1细胞或CD4+T细胞产生。本研究结果表明,模型组小鼠脾淋巴细胞中IL-2和IFN-γ水平较低,而ABP-AW1 250和500 mg·kg-1治疗能促进免疫低下小鼠脾淋巴细胞生成IL-2和IFN-γ,这可能是ABP-AW1调节机体免疫功能的机制之一。T淋巴细胞亚群在病毒感染和恶性肿瘤等多种疾病中都会发生异常改变。一般认为,CD4+/ CD8+细胞比值在一定程度上可以反映机体的免疫功能状态,CD4+/CD8+细胞比值下降,表明机体免疫功能低下;CD4+/CD8+比值升高,表明免疫功能增强[17-18]。本研究结果显示,模型组小鼠脾CD4+/ CD8+细胞比值明显低于正常对照组,ABP-AW1 250和500 mg·kg-1可使CD4+/CD8+细胞比值明显升高,提示ABP-AW1可改善免疫低下小鼠的免疫功能状态。
综上所述,ig给予ABP-AW1 250和500 mg·kg-1连续7 d,对免疫功能低下小鼠具有免疫增强作用。降低ABP-AW1剂量并延长给药时间,或者提高ABP-AW1剂量能否进一步增强疗效有待进一步研究。
[1]Yue LL,Zhang W,Liu D,Li CC,Lyu YX,Wen XC,et al.Advances in research on the medical value ofAgaricus blazeiMurill[J].China Pharm(中国药房),2011,22(43):4116-4118.
[2]Hetland G,Johnson E,Lyberg T,Bernardshaw S,Tryggestad AM,Grinde B.Effects of the medicinal mushroomAgaricus blazeiMurill on immunity,infec⁃tion and cancer[J].Scand J Immunol,2008,68(4):363-370.
[3] Wang P,Li XT,Sun L,Shen L.Anti-inflammato⁃ry bactivity of water-soluble polysaccharide ofAgari⁃cus blazeiMurill on ovariectomized osteopenic rats[J].Evid Based Complement Alternat Med,2013,2013:164817.
[4]Niu YC,Liu JC,Zhao XM,Cao J.A low molecular weightpolysaccharide isolated fromAgaricus blazeiMurill(LMPAB)exhibits its anti-metastatic effect by down-regulating metalloproteinase-9 and up-regulating Nm23-H1[J].Am J Chin Med,2009,37(5):909-921.
[5]Lee JS,Hong EK.Agaricus blazeiMurill enhances doxorubicin-induced apoptosis in human hepatocellular carcinoma cells by NF-κB-mediated increase of intra⁃cellular doxorubicin accumulation[J].Int J Oncol,2011,38(2):401-408.
[6]Liu JC,Sun YX.Structural analysis of an alkaliextractable and water-soluble polysaccharide(ABPAW1)from the fruiting bodies ofAgaricus blazeiMurill[J].Carbohyd Polym,2011,86(2):429-432.
[7]Cui L,Sun Y,Xu H,Xu H,Cong H,Liu J.A poly⁃saccharide isolated fromAgaricus blazeiMurill(ABP-AW1)as a potential Th1 immunity-stimulating adjuvant[J].Oncol Lett,2013,6(4):1039-1044.
[8]Hu CM,Chen L,Li R,Cheng WM,Li J.Immuno⁃modulatory property of total flavonoids fromLitsea coreanaLeveille on immunosuppressive mice[J].Chin Pharmacol Bull(中国药理学通报),2007,23(6):804-808.
[9]Shao X,Chi XL,Zhou WX,Zhang YX,Qi CH,Zhang XR.Effect of LW-AFC on immune function in cyclophosphamide treated mice[J].Chin J Phar⁃macol Toxicol(中国药理学与毒理学杂志),2010,24(5):333-338.
[10]Hu T,Jiang C,Huang Q,Sun F.A comb-like branched β-D-glucan produced by aCordyceps sinensisfungus and its protective effect against cyclophosphamide-induced immunosuppression in mice[J].Carbohydr Polym,2016,142:259-267.
[11]Shurlygina AV, Mel′nikova EV, Trufakin VA. Chronodependent effect of interleukin-2 on mouse spleen cells in the model of cyclophosphamide immu⁃nosuppression[J].Bull Exp Biol Med,2015,158(4):471-474.
[12]Cho CW,Han CJ,Rhee YK,Lee YC,Shin KS,Shin JS,et al.Cheonggukjang polysaccharides enhance immune activities and prevent cyclophos⁃phamide-induced immunosuppression[J].Int J Biol Macromol,2015,72:519-525.
[13]Niu YC,Liu JC,Zhao XM,Su FQ,Cui HX.Immuno⁃stimulatory activities of a low molecular weight anti⁃ tumoral polysaccharide isolated fromAgaricus blazeiMurill(LMPAB)in sarcoma 180 ascitic tumor-bear⁃ing mice[J].Pharmazie,2009,64(7):472-476.
[14]Gao HY,Li GY,Huang J,Han Y,Sun FZ,Du XW,et al.Protective effects of Zhuyeqing liquor on the immune function ofnormaland immunosup⁃pressed micein vivo[J].BMC Complement Altern Med,2013,13:252.
[15]Silberman DM,Wald M,Genaro AM.Effects of chronic mild stress on lymphocyte proliferative response.Participation of serum thyroid hormones and corticosterone[J].IntImmunopharmacol,2002,2(4):487-497.
[16]Li Q,Hirata Y,Piao S,Minami M.Immunotoxicity of N,N-diethylaniline in mice:effect on natural killer activity,cytotoxic tlymphocyte activity,lymphocyte proliferation response and cellular components of the spleen[J].Toxicology,2000,150(1-3):179-189.
[17] Muller GC,Gottlieb MG,Luz Correa B,Gomes Filho I,Moresco RN,Bauer ME.The inverted CD4∶CD8 ratio is associated with gender-related changes in oxidative stress during aging[J].Cell Immunol,2015,296(2):149-154.
[18]Lee YW,Shin KW,Paik IY,Jung WM,Cho SY,Choi ST,et al.Immunological impact of Taekwondo competitions[J].Int J Sports Med,2012,33(1):58-66.
Immunity-enhancing effect of polysaccharide ABP-AW1 isolated from Agaricus blazei Murill on immunosuppressive mice
JIANG Li-yan1,YU Zhi-pu2,YAO Shu-juan1,LIU Bai-yang1,LIU Ji-cheng1
(1.College of Medical Technology,2.The Second Affiliated Hospital,Qiqihar Medical University, Qiqihar 161000,China)
OBJECTIVETo explore the immunity-enhancing effect of ABP-AW1,a low-molecularmass polysaccharides isolated fromAgaricus blazeiMurill,on immunosuppressive mice.METHODSICR mice were ip injected cyclophosphamide 80 mg·kg-1,once daily for 3 d,to establish an immuno⁃suppressive mouse model.Then,ABP-AW1 125,250 and 500 mg·kg-1were ig given to the immuno⁃suppressive mice,respectively,once daily for 7 d.The mouse thymus index and spleen index were calcu⁃lated,and the phagocytic function of phagocytes was determined using carbon clearance test.Splenic lym⁃phocyte proliferation was measured by MTT method.The interleukin 2(IL-2)and interferon γ(IFN-γ) production from splenic lymphocytes was examined by ELISA.The splenic lymphocyte CD4+/CD8+ratio was determined by flow cytometric analysis.RESULTSCompared with normal control group,the thymus index,spleen index and phagocytic index of phagocytes in the immunosuppressive model mice declined(P<0.05).ABP-AW1 250 and 500 mg·kg-1treatment significantly increased the thymus index,spleen index and phagocytic index in immunosuppressive mice(P<0.05).Compared with normal control group,concanavalin A(Con A)and lipopolysaccharide(LPS)induced T and B lymphocyte proliferation, respectively,and IL-2 and IFN-γ production from splenic lymphocytes in the immunosuppressive model mice was lower(P<0.05).Compared with model group,ABP-AW1 250 and 500 mg·kg-1promoted Con A and LPS induced T and B lymphocyte proliferation(P<0.05),and elevated IL-2 and IFN-γ production from splenic lymphocytes(P<0.05).In addition,ABP-AW1 250 and 500 mg·kg-1reversed the decreased splenocyte CD4+/CD8+ratio in immunosuppressive model mice(P<0.05).CONCLUSIONABP-AW1 has immuneity-enhancing effect on cyclophosphamide-induced immunosuppressive mice.
Agaricus blazeiMurill;polysaccharides;ABP-AW1;cyclophosphamide;immunosup⁃pression
The project supported by National Natural Science Foundation of China(81173609)
LIU Ji-cheng,Tel:13304621328,E-mail:qyybliu@126.com
R285.1
:A
:1000-3002-(2017)05-0393-06
10.3867/j.issn.1000-3002.2017.05.003
2016-11-22 接受日期:2017-05-12)
(本文编辑:齐春会)
国家自然科学基金(81173609)
蒋丽艳,硕士研究生,主要从事药理学研究;刘吉成,博士,教授,主要从事分子药理学和肿瘤药理学研究。
刘吉成,Tel:13304621328,E-mail:qyybliu@ 126.com
