微波辅助提取三叶青多糖工艺优化及其拮抗炎症细胞的研究
2017-06-05黄有强
黄有强
华东医药股份有限公司药材参茸分公司 浙江 杭州 310011
微波辅助提取三叶青多糖工艺优化及其拮抗炎症细胞的研究
黄有强
华东医药股份有限公司药材参茸分公司 浙江 杭州 310011
三叶青多糖 微波 炎症细胞 实验研究
三叶青为葡萄科崖爬藤属植物三叶崖爬藤的块根或全草,具有清热解毒、活血祛风等功效。近年来,现代药理学研究表明其具有抗肿瘤、抗病毒、退高热等特有的作用,受到国内外研究人员高度的关注[1-3]。多糖是三叶青中的重要组成成分[4],目前对三叶青多糖的研究表明,其具有抗肿瘤,抗肝损伤,调节免疫的功效[5],然而尚未见到三叶青多糖抗炎机制研究的相关报道。本文将采用微博辅助法提取三叶青多糖,并对其提取条件进行考察和优化,得到三叶青多糖最佳制备工艺。采用脂多糖(LPS)诱导的炎症细胞模型,探究三叶青多糖拮抗炎症细胞的作用并初步阐明其作用机制。
1 材料与仪器
电子天平AE240(瑞士METTLER),微波炉(EM-925FDN-SS,美的集团),HH-S数控恒水浴锅(金华市文华科教实验仪器厂),YAMATO低温旋转蒸发一体机(日本YAMATO公司),SHIMADZU UV-2450紫外分光光度仪(日本岛津公司),VD115真空干燥器(德国宾得);550型酶标仪(美国Bio-Rad公司);311型二氧化碳细胞培养箱(Thermo Scientific,USA)。三叶青药材,产地为浙江,由杭州华东中药饮片有限公司提供,批号:160121。无水葡萄糖对照品(KAYON公司,批号:20151203)。细胞株:小鼠巨噬细胞系RAW264.7细胞株(中国科学院上海细胞库提供),加入10%的胎牛血清、100U/ml青霉素、链霉素的高糖DMEM,置于5%CO2,37℃培养箱中生长。细胞生长至70%~80%融合后进行传代,2~3天传代1次。LPS(Sigma公司,批号:L2880),鼠 TNF-α、IL-6 ELIS A检测试剂盒(美国R&D公司产品);胎牛血清(美国GIBCO公司产品);DMEM高糖培养基(美国GIBCO公司)。
2 实验方法
2.1 三叶青多糖提取工艺考察:三叶青粉末10g,加15倍蒸馏水,置于微波炉内加热提取后,加无水乙醇,使醇沉浓度达80%,醇沉过夜,获得三叶青多糖,弃去上清液,离心,沉淀真空干燥,称重,计算多糖得率及多糖含量。以多糖含量为考察指标,以溶剂量、提取功率、提取时间为考察因素,各设三个水平,作L9(34)正交试验,见表1。通过正交试验表统计分析软件计算试验结果,确定最佳提取工艺。
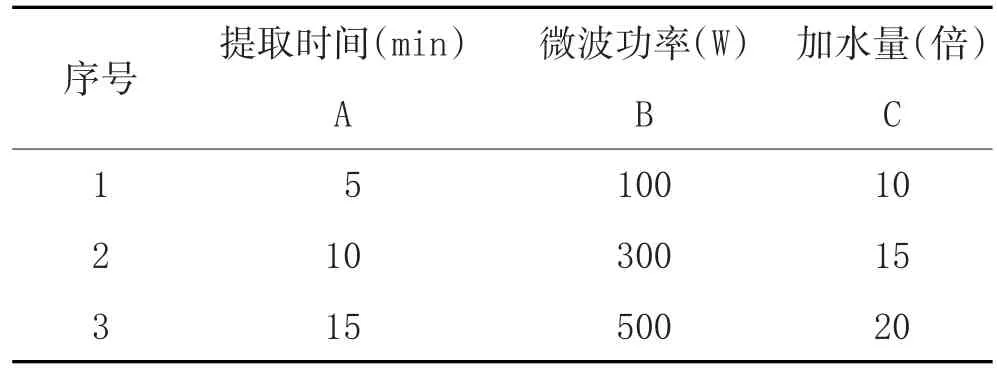
表1 因素水平表
2.2 多糖含量测定:分述如下。
2.2.1 标准曲线制备:精密称取105℃干燥至恒重的无水葡萄糖适量,加水制成0.25mg/ml的对照品溶液。精密吸取梯度浓度的葡萄糖标准液1ml,分别定容至3ml,得系列对照品溶液,各取1ml加入1ml5%苯酚(临用前现配制)及5ml浓硫酸,100℃水浴30min,取出,放入冰水浴中冷却15min,以相应的试剂为空白,在490nm的波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
2.2.2 换算因素:精确称取干燥的三叶青多糖10mg,置于100ml量瓶,用蒸馏水稀释至刻度,摇匀,作为储备液。分别精取多糖溶液0.1ml,按照标准曲线制备的方法操作,测定吸收度。另取葡萄糖标准溶液0.25ml,同法操作,求出多糖溶液中的葡萄糖含量,按下式计算换算因素:F=W/C×D,式中:W为多糖的质量,C为多糖溶液中的葡萄糖浓度,D为稀释倍数。
2.2.3 样品测定:精密量多糖溶液1ml,置100ml容量瓶中,蒸馏水定容,制成供试品溶液,取1ml至10ml具塞试管中,照1.3标准曲线的制备项下的方法,自精密加入5%苯酚溶液起,依法测定吸光度。从标准曲线上读出供试品溶液中无水葡萄糖的含量,按下式计算样品中多糖的含量:多糖含量(%)=Cs×D×F×V/W,式中:Cs为供试品溶液中葡萄糖浓度,D为供试品溶液的稀释因素,F为换算因素,V为供试溶液体积,W为供试品质量。
2.3 三叶青多糖拮抗脂多糖(LPS)诱导炎症细胞模型作用:三叶青多糖、LPS处理小鼠巨噬细胞用10%的小牛血清培养基调整细胞浓度约为2×106个/ml,分为对照组、模型组、三叶青多糖组。对照组加双纯水(2μg/ml);模型组加入LPS(2μg/ml),三叶青多糖组加入LPS (2μg/ml)培养30min后,分别加入浓度100μg/ml,50μg/ml,25μg/ml的三叶青多糖,阳性对照采用地塞米松(5μg/ml)。各组均在37℃、5%CO2培养箱中继续培养24h。收集细胞的上清液,按照试剂盒的说明,检测标本中肿瘤坏死因子(TNF-α)及白介素-6(IL-6)的水平。
3 结果与分析
3.1 最佳提取工艺优化:采用正交设计实验,以加水量、提取次数、提取时间为因素,以多糖含量为考察指标。结果见表2。结果表明,最佳提取工艺为:A2B3C3,故最终确定三叶青多糖的提取工艺:加20倍水,500W微波功率下,提取10min。

表2 三叶青多糖提取正交试验结果
3.2 标准曲线:以葡萄糖对照品浓度为横坐标(X),吸光度为纵坐标(Y)进行回归,得回归方程:y=8.579x+ 0.007,r=0.9995。结果 表 明多 糖 在 0.09mg/ml~0.125mg/ml之间有良好的线性关系。换算因素:根据计算公式F=W/C×D,式中:W为多糖的质量,C为多糖溶液中的葡萄糖浓度,D为稀释倍数。测得F=1.701。
3.3 三叶青多糖抑制细胞死亡及对TNF-α、IL-6的影响:分述如下。
3.3.1 三叶青多糖对RAW264.7巨噬细胞活性的影响:培养24h后,模型组RAW 264.7巨噬细胞只有很少的细胞染成红色,形状多为圆形,说明RAW 264.7巨噬细胞生长少,且大量死亡,表明LPS诱导RAW 264.7巨噬细胞衰老死亡。三叶青多糖组,随着三叶青多糖浓度的增加,RAW 264.7巨噬细胞被染成红色且贴壁生长,形状呈不规则菱形的巨噬细胞数量越来越多,说明三叶青多糖可以抑制LPS诱导的细胞死亡,并促进细胞生长。
3.3.2 三叶青多糖对LPS诱导后巨噬细胞TNF-α以及IL-6的影响:模型组巨噬细胞经过LPS诱导产生的TNF-α以及IL-6含量明显高于空白组(P<0.01),三叶青多糖组中,随着浓度增加,对LPS致巨噬细胞产生TNF-α及IL-6的抑制更加明显。见表3。
表3 各组巨噬细胞TNF-α以及IL-6的含量(±s,ng/L)

表3 各组巨噬细胞TNF-α以及IL-6的含量(±s,ng/L)
注:与模型组比较,*P<0.01。
组别空白组模型组地塞米松组(5μg/mL)三叶青多糖组(100μg/mL)三叶青多糖组(50μg/mL)三叶青多糖组(25μg/mL)TNF-α 30.28± 8.32*302.36±30.32 152.54±26.66*IL-6 21.00± 6.33*408.69±18.52 182.98±15.09*189.30±21.00*185.67±10.65*241.74±25.33*195.36±11.44*265.58±30.45*222.98±15.32*
4 讨论
三叶青多糖是三叶青中含量较高的活性成分,传统的多糖提取工艺均采用煎煮方法,会导致多糖部分水解,而微波辅助法提取多糖可以缩短实验和生产时间,同时还可以提高提取率及产品纯度并且节省溶剂[6]。本实验通微波法对三叶青多糖进行提取,通过正交试验优选出最佳提取工艺,得到多糖的率为14.36%,与传统方法相比缩短提取时间,提高提取效率。
三叶青具有抗炎、镇痛、解热等作用。本研究表明,三叶青多糖对于脂多糖诱导的巨噬细胞死亡有明显的抑制作用,且巨噬细胞中的炎性因子TNF-α、IL-6的含量较模型组明显降低,呈现一定的量效应关系。实验结果显示,三叶青多糖最佳给药剂量为20μg/ml~100μg/ml,同时为三叶青多糖用于脂多糖诱导的巨噬细胞和其他细胞衰老死亡提供了有价值的实验依据。
[1]杨雄志.中药三叶青的药理作用与临床应用[J].吉林中医药,2009,29(6):517-518.
[2]钟良瑞,林霜,魏克民.三叶青黄酮抗肺癌作用研究[J].中国药理学通报,2016,32(4):480-483.
[3]程权,傅华洲.三叶青药理作用及临床应用研究进展[J].辽宁中医药大学学报,2016,18(4):236-238.
[4]饶君凤,吕伟德,倪承珠,等.离子色谱法测定三叶青多糖中单糖组成[J].亚太传统医药,2016,12(12):42-44.
[5]林婧,纪明妹,黄泽豪,等.三叶青的化学成分及其体外抗肿瘤活性研究[J].中国药学杂志,2015,50(8):658-663.
[6]吕佳妮,陈素红,徐娟华.铁皮石斛根中石斛多糖的响应面法提取优化研究[J].浙江中医杂志,2014,49(6):459-461.
2016-09-21
