预热处理对离心运动大鼠骨骼肌超微结构、血清CK、LDH及氧化应激的影响*
2017-06-05李焕春
梁 健, 李焕春
(华南师范大学体育科学学院, 广东 广州 510631)
预热处理对离心运动大鼠骨骼肌超微结构、血清CK、LDH及氧化应激的影响*
梁 健, 李焕春△
(华南师范大学体育科学学院, 广东 广州 510631)
目的:采用离心运动和热处理研究预热处理对离心运动大鼠骨骼肌的保护作用。方法:SD大鼠分安静组(n=8),运动组(n=32)和预热处理运动组(n=40),运动组运动完成后分为运动即刻组(E1)、运动后24 h组(E2)、运动后48 h组(E3)和运动后6 d(E4)组,热处理组在4个周期热处理后分热处理安静组(HE)、热处理运动即刻组(HE1)、热处理运动后24 h组(HE2)、热处理运动后48 h组(HE3)和热处理运动后6 d(HE4)组;运动采用-16°坡度、速度20 m/min、时间120 min的一次性离心力竭跑台运动至力竭模型;预热处理采用每4 d为一个周期, 3 d进行热处理、1 d休息,共4个周期,期间湿度控制在50%,肛温起始温度从39±0.5℃,依次递增到39.5±0.5℃、40.5±0.5℃和41.5±0.5℃,监测大鼠直肠温度达到预定值以后维持15 min。实验后取血和骨骼肌,观察骨骼肌超微结构和血清肌酸激酶(CK)、乳酸脱氢酶(LDH)及氧化应激指标的变化。结果:预热处理运动后不同时相血清CK、LDH值低于单纯运动组,其中HE1及HE2组与同时相的E1、E2的CK值都呈显著性差异(P<0.05),HE1、HE2及HE3组的血清LDH值显著低于同时相的E1、E2及 E3组(P<0.05);HE2及HE3组的血清超氧化物歧化酶(SOD)值都分别高于同时相的E1、E2组,并且两两之间呈显著性差异(P<0.05),HE2组的血清丙二醛(MDA)值显著低于E2组(P<0.05)。结论:运动预热处理对预防运动性骨骼肌损伤有一定作用。
预热处理;大鼠;运动;骨骼肌;超微结构;氧化应激
preheat treatment; rat; exercise; skeletal muscle; ultrastructure; oxidative stress
【DOI】 10.12047/j.cjap.5505.2017.026
运动骨骼肌损伤在运动活动中非常普遍,其生理特征非常复杂,一直是国内外运动医学界研究的重点。研究表明,高强度运动或者超过习惯负荷的运动都有可能导致出现骨骼肌损伤[1],使骨骼肌超微结构发生变化,并伴随着酶、血液氧化应激等生化指标的改变[3]。生物体会对加于它的任
何应激发生非特异性反应,并通过综合性生理体征表现出来。研究表明,热处理能诱导大鼠骨骼肌产生内质网应激反应并诱导大鼠骨骼肌功能发生适应性改变,有利于骨骼肌的保护[2],这为预热处理对运动性骨骼肌损伤的预防提供一种可能。目前预热处理对运动骨骼肌损伤的研究少有报道,本文试图研究预热处理对大强度离心运动后大鼠骨骼肌超微结构、血清CK、LDH及其血清氧化应激变化影响,为预热处理作为运动性骨骼肌损伤的预防措施提供实验依据。
1 材料与方法
1.1 实验动物与分组
平均重量为140.25±12.34 g的清洁级雄性SD大鼠购自南方医科大学实验动物中心,置于温度为22±0.3℃,湿度50%~60%下清洁级动物房中喂养。所有动物自由饮食、饮水,适应性喂养3 d后进行随机分组。大鼠分为安静组(8只)、运动组(32只)及热处理运动组(40只),其中运动组随机分为运动即刻组(E1)、运动后24 h组(E2)、运动后48 h组(E3)和运动后6 d(E4)组,每组8只,热处理组在热处理完成后随机分为热处理安静组(HE)、热处理运动即刻组(HE1)、热处理运动后24 h组(HE2)、热处理运动后48 h组(HE3)和热处理运动后6 d(HE4)组,每组8只。
1.2 实验方法
1.2.1 运动方案 运动方案采用一次性离心力竭跑台运动模型。坡度设置为-16°,跑台恒定速度20 m/min,运动持续时间120 min,直至运动力竭。运动后大鼠运动能力显著下降,间歇次数明显增多,不能再次完成运动,且运动后基本无逃避能力,呈明显疲劳状,表明符合离心力竭运动模型。
1.2.2 预热处理的方法 大鼠置于恒温桑拿环境中进行预热处理,并实时监测肛温。热处理每4 d为一个周期,其中3 d进行热处理,1 d休息,共进行4个周期。热处理期间湿度控制在50%,热处理肛温起始温度从(39±0.5)℃,依次递增到(39.5±0.5)℃、(40.5±0.5)℃和(41.5±0.5)℃,监测大鼠直肠温度达到预定值以后维持15 min。热处理期间,严格控制温度和湿度,并观察大鼠行为。
1.2.3 实验样本的选取与测定方法 大鼠在完成运动和热处理后按分组分别进行宰杀。采用7%水合氯醛(0.4 ml/100 g)腹腔注射麻醉后腹主动脉取血。取血后立即置入抗凝管并分离血清,血清置于-70℃超冰箱中保存待用。取血后进行比目鱼肌分离,所得比目鱼肌按电镜要求快速切取小块肌组织,放入2.5%戊二醛4℃固定。比目鱼肌经2.5%戊二醛4℃固定过夜后进过漂洗、固定、脱水、浸透、包埋、聚合等过程后,制成超薄切片。将制备好的电镜标本置于HITACHI,H-7500透射电子显微镜下观察、拍照。观察内容主要为肌原纤维、肌节排列的规则程度,A带、I带完整情况和位置关系,Z线和内质网、线粒体的改变。血清CK、LDH采用酶动力进行测定,血清SOD通过黄嘌呤氧化酶法测试,MDA采用硫代巴比妥酸(TBA)法进行测试。
1.3 统计学处理
2 结果
2.1 实验后大鼠骨骼肌超微结构的变化
运动后即刻大多数肌原纤维正常,具有排列整齐的Z线,但见部分肌原纤维有小的肌溶灶,Z线模糊,肌质网轻度扩张;肌原纤维间线粒体形态、排列正常(图A);运动后24 h大多数肌原纤维正常,肌原纤维具有排列整齐的Z线,但见部分肌原纤维有小的肌溶灶,Z线消失;肌膜连续,肌膜偶见线粒体堆积,且伴有嵴疏松变性(图B、图C)。运动后48 h大多数肌原纤维正常,肌原纤维具有排列整齐的Z线,但见部分肌原纤维呈水纹样疏松变性;肌膜连续,肌膜偶见线粒体堆积,细胞核周围有线粒体堆积(图D、图E)。
热处理后运动即刻大多数肌原纤维正常,具有排列整齐的Z线,肌原纤维间线粒体形态、肌膜连续,肌膜下偶见线粒体堆积,数量形态正常(图F)。预热处理运动后24 h后肌原纤维正常,肌膜下肌原纤维具有排列整齐的Z线,肌膜连续,肌膜下偶见线粒体堆积,数量形态正常,部分肌质网轻度扩张,肌原纤维间线粒体形态、排列正常(图G,图H)。电镜观察预热适应运动48 h后,肌膜下线粒体堆积较少,可见糖原颗粒;肌细胞核正常;肌膜连续(图I)。肌膜下线粒体堆积较少,肌细胞核正常;肌原纤维结构正常,具有排列整齐的Z线;肌原纤维间线粒体形态、排列正常(图J)。

Fig. 1 The change chart of micro rat skeletal muscle after eccentric exercise(×10K) A: Exercise immediate group; B,C: 24-hour group after exercise; D,E: 48-hour group after exercise
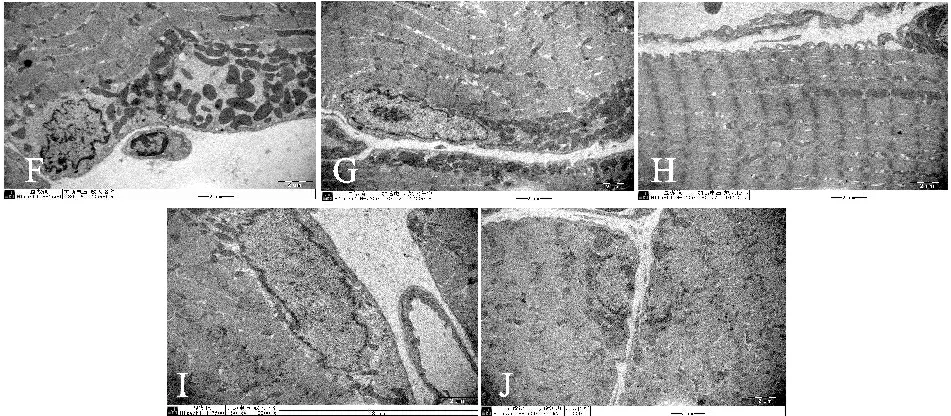
Fig. 2 The change chart of micro rat skeletal muscle after prior heat treated and eccentric exercise(×10K) F: Preheated treatment and exercise immediate group; G,H: Preheated treatment exercise group after 24 hours; I,J: Preheated treatment exercise group after 48 hours
2.2 实验后大鼠血清CK、LDH、SOD活性、MDA浓度的变化
预热处理运动后HE1及HE2组的CK值都分别低于同时相的E1、E2组,并且两两之间呈显著性差异(P<0.05);HE1、HE2及HE3组的值分别显著低于同时相的E1、E2及 E3组(P<0.05);HE4值高于E4,但两者之间无显著性差异(表1)。
热处理后运动即刻大多数肌原纤维正常,具有排列整齐的Z线,肌原纤维间线粒体形态、肌膜连续,肌膜下偶见线粒体堆积,数量形预热处理运动后不同时相血清SOD活性的变化,HE2及HE3组的值均明显高于同时相的E2、E3组(P<0.05),HE1及HE4组的值也分别高于同时相的E1、E4组,但没有显著性异性(表1)。
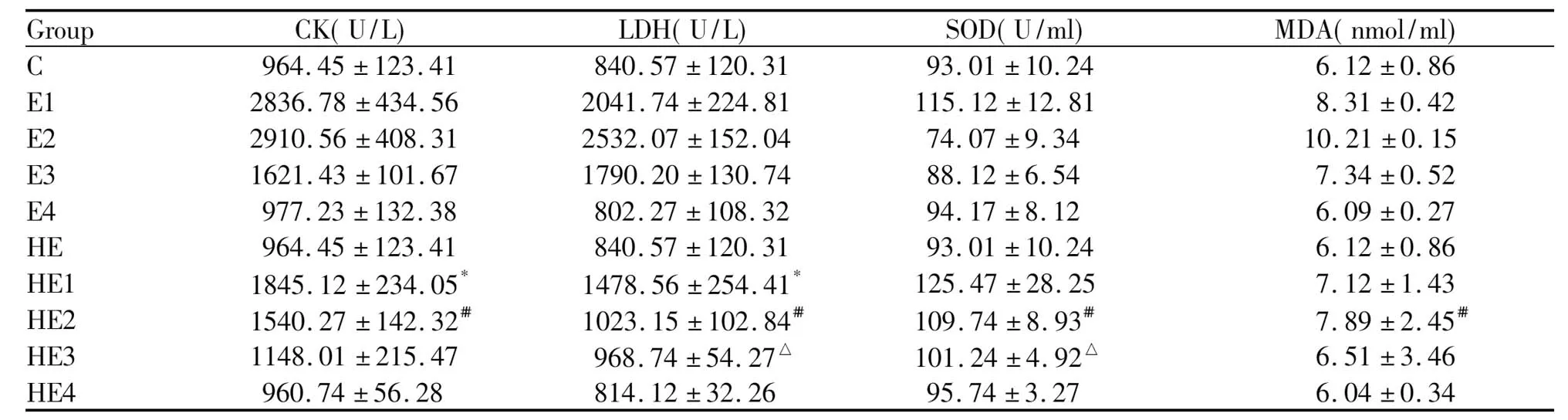
Tab. 1 The change of CK,LDH, SOD activity and MDA concentration comparison in different groups of rats between the exercise group and preheated exercise treatment group
C: Control group; E1: Exercise immediate group; E2: 24-hour group after exercise; E3: 48-hour group after exercise; E4: 6 d group after exercise; HE: Preheated treatment group; HE1: Preheated treatment and exercise immediate group; HE2: Preheated treatment and exercise group after 24 hours; HE3: Preheated treatment and exercise group after 48 hours; HE4: Preheated treatment exercise group after 6 d; CK: Creatine kinase; LDH: Lactic dehydrogenase; SOD: Superoxide dismutase; MDA: Malondialdehyde
*P<0.05vsE1 group;?##P<0.01vsE2 group;?△P<0.05vsE3 group
3 讨论
机体在热应激下会产生内源性保护蛋白抵抗机体抗损伤能力。结果显示,预热处理运动组与单纯运动组比较,预热处理运动后24 h后肌原纤维正常,肌膜下肌原纤维具有排列整齐的Z线,仅部分肌质网轻度扩张。但是在热适应运动48 h后,肌原纤维结构正常,具有排列整齐的Z线,肌原纤维间线粒体形态,肌细胞核正常。预热处理对运动性骨骼肌损伤具有一定的预防作用。其原因可能是机体在热应激下会发生热应激反应并产生热体克蛋白,提高细胞抗损伤能力,并可以通过预期热刺激,使机体预先获得抗损伤的能力,提高细胞对应激的耐受性,从而减少细胞受损程度[3]。本实验热处理骨骼肌运动后的生理特征也证实这一观点。实验证明,热应激产生的热蛋白可以参与到细胞骨架和核骨架中,并且与核仁和细胞膜结合,使细胞结构变得更加稳定,降低核仁和细胞膜对热的敏感性,增强细胞的热耐受力[4],因此本实验预热处理离心运动后骨骼肌的超微结构改变,可能与应激蛋白稳定骨架有关。
血液CK和LDH浓度与骨骼肌及细胞膜受损相关,血清CK、LDH活性的改变与运动强度时间以及运动方式密切相关,本结果证实这一特征。在预热处理后再进行运动,发现 HE1及HE2组CK 活性都分别低于E1、E2组,并呈显著性差异(P<0.05);而E1、HE2及HE3组LHD的活性也分别显著低于同时相的单纯运动组(P<0.05)。表明预热处理可以对抗运动性疲劳或骨骼肌损伤对机体的影响。预热处理对骨骼肌及细胞膜的保护作用,可能通过降低自由基,增强抗氧化机制来实现。其原理是预热应激提高机体抗氧化酶活性,抑制自由基对细胞膜脂质过氧化,从而减轻骨骼肌组织结构的损伤,进而使CK和LDH释放减少。结果显示,预热处理运动后不同时相血清SOD活性的变化,HE2及HE3组的值均明显高于同时相的E2、E3组(P<0.05),因此预热处理预先可能提高骨骼肌抗氧化水平,有利于运动后骨骼肌自由基的消除,并在一定程度上可以防止运动性骨骼肌损伤。研究发现,预热应激可以使大鼠心肌抗氧化酶Mn-SOD和热休克蛋白72表达增加,与应激相关的HSP70在热应激后高表达,而HSP70具有对组织缺血-再灌注损伤的保护作用,这种作用可能是通过SOD产生的增加而实现减少自由基对机体的损伤[5]。
预热处理能提高骨骼肌抗氧化酶SOD活性,降低剧烈运动过程中脂质过氧化反应对骨骼肌影响,对于运动性骨骼肌损伤或延迟性酸痛的机制预防具有较强的实践指导意义。由于热应激机制的复杂性,热处理预防干预运动性骨骼肌损伤应急机制还需做进一步研究。
[1] Butterfield TA, Herzog W. The magnitude of muscle strain does not influence serial sarcomere number adaptations following eccentric exercise [J].PtlugersArch, 2006, 451(5): 688-700.
[2] 李焕春,肖国强. 钙网蛋白介导热处理对大鼠骨骼肌适应性变化钙调机制的研究[J]. 中国应用生理学杂志, 2013, 29(1): 38-41.
[3] Webster KA. Serine phosphorylation and suppression of apoptosis by the small heat shock protein α B-crystallin[J].CircRes, 2003, 92(2): 130-132.
[4] Martin J, Langer T, Boteva R,etal. Chaperonin-mediated protein folding at the surface of groEL through a molten globule-like intermediate[J].Nature, 1991, 352(6330): 36-42.
[5] Bedirli A, Sakrak O, Muhtaroglu S,etal. Ergothioneine pretreatment protects the liver from ischemia-reperfusion injury caused by increasing hepatic heat shock protein 70[J].JSurgRes, 2004, 122(1): 96-102.
2016-10-11
2016-12-14
Q494
A
1000-6834(2017)02-102-03
△【通讯作者】Tel: 020-39310273; E-mail: li374@163.com
