美国食品药品监管大数据实践简介及对我国的启示
2017-06-02杨依晗王广平高惠君
杨依晗+王广平+高惠君


摘 要 数据资源将为监管创新、产业创新提供极大的动力,数据开放成为食品药品安全社会共治的基础。本文基于美国食品药品监督管理局(FDA)的大数据信息化基础、共享平台——“开放FDA”(openFDA)以及应用实践的分析,提出我国食药监管政府大数据应用对策,包括完善数据库基础建设、提升信息公开力度、扩大数据开发主体和挖掘企业行业数据等。
关键词 数据开放 信息公开 大数据 食品药品管理局
中图分类号:R951 文献标识码:C 文章编号:1006-1533(2017)09-0060-06
Brief introduction on big data practice of FDA and its enlightenment to China
YANG Yihan*, WANG Guangping, GAO Huijun
(Shanghai Institute for Food and Drug Safety, Shanghai 200233, China)
ABSTRACT Data resources would provide a great driving force for both regulatory and industrial innovation, and data open to the public will become a basis of social co-governance for food and drug safety. Based on research of the foundation of big data of FDA (Food and Drug Administration), the sharing platform — openFDA and the data application, some strategies for the big data application in food and drug supervision in our country were proposed in this paper, including the infrastructure of database, the improvement of the scale of information disclosure, the expansion of the main body of data development and the data mining in the industry and enterprise and so on.
KEy WORDS data open; information disclosure; big data; Food and Drug Administration
當今世界,新一代信息技术与经济社会各领域的深度融合,我国政府提出信息化与工业化融合。数据资源以其预测、决策等方面的推动作用,将有效地提高社会的生产力和监管水平,为监管创新、产业创新提供极大的动力,并成为食品药品安全社会共治的基础。2009年以来,美国政府开展了“政府大数据计划”,美国食品药品监督管理局(Food and Drug Administration, FDA)逐步向社会开放医疗和健康方面的大数据,为数据开放提供各种便利。2014年6月2日,FDA实现其重要的公共数据开放项目“开放的FDA”(openFDA)。本文通过分析FDA食品药品大数据战略以及大数据应用实践,以期为我国食药监管政府大数据开发、提高监管有效性提供决策参考。
1 美国食品药品监管大数据信息化基础
美国的政府信息公开工作具有起步早、数据多、深度开放等特点,在大数据的开发利用方面具有优势。大数据管理的规范化、标准化是大数据开发利用的前提。明确工作职责,建立标准化数据库,保证数据的完整性,以确保大数据战略顺利实施。
1.1 数据信息专业团队的建立
美国FDA的信息管理源于国家对信息资源管理的顶层设计,具有起步较早、高度重视、数据与信息技术工作相分离、充分借助第三方力量的特点。为确保信息技术的获得和信息资源的有效管理以及推进大数据的使用,1998年FDA设立了首席信息官(Chief Information Officer)[1],2013年任命首位首席健康信息官(Chief Health Informatics Officer)[2],2015年成立健康数据办公室(Office of Health Informatics)[3]。健康数据办公室的工作是和常规信息化工作相分离的,FDA原有的信息管理和技术办公室仍然负责常规信息化系统的运维。
FDA的很多数据项目的启动和维护都依托于第三方的数据信息服务。如:在openFDA项目前期准备阶段,FDA联合Iodine公司建立openFDA项目上传数据和应用程序接口。在项目发布以后,FDA继续与该公司合作,加强数据结构和数据来源,开发数据访问工具[4]。
1.2 数据信息的基础建设
符合大数据特征的数据集是大数据的应用前提。在数据集的建立过程中,大量纸质材料的电子化是数据库建立的一大阻碍。如:FDA不良事件报告系统(the FDA Adverse Event Reporting System,FAERS)中有9万份手工填写的纸质文件。FDA利用数据提取技术将其转为设备可读的数据集,这样的转化成本是使用人力识别的1/8,而准确率高达99%[5]。同时推进行政申请的无纸化过程。2003年起,美国FDA就宣布接受采用国际通用的电子通用技术文档(electronic common technical document, eCTD)格式的新药审批、生物制品许可申请以及试验用新药申请等申请文件。经过数十年的过渡,2017年FDA的大部分新药临床研究和上市申请以及原料药主控文件等都不再接受纸质申请,必须采用eCTD提交[6]。
因为数据库平台和结构不同而产生许多困难,几乎任意两个不同软件之间要实现数据传递都会存在数据转换问题。目前,FDA已成立数据标准管理团队并建立数据标准体系,由FDA的数据标准委员会(Data Standards Council)协调,进行数据的评价、开发、维护和采用,以确保整个机构使用共同的数据标准[7]。汇总与数据标准有关的已有指南文件[8],并建立了数据标准的目录。
1.3 数据挖掘技术的开发应用
FDA的数据挖掘方法和工具最先用于对药品不良事件报告的数据库分析。常用的方法有:非均衡测量法、变点分析(change-point analysis,CPA)、文本挖掘和可视化工具。数据挖掘已协助进行许多重要的药品、医疗器械的安全性信号评价,甚至能发现已上市很久的药品隐藏的毒性信号,如丙基硫氧嘧啶的肝毒性案例;也可以提早发现风险信号,如经回顾性数据挖掘发现,数据挖掘方法可能提早10个月发现植入式心脏除颤器(implantable cardioverter defibrillator, ICD)存在风险信号[9]。
由于数据挖掘方法在不良事件报告分析的成功应用,FDA已开始将此方法应用于其他类型的数据,如在药物应用的临床研究数据和呼叫中心接收问题中,已常规使用,而在MEDLINE、医学文献、医疗设备文件社会媒体、烟草文件等类型数据的挖掘工具正在开发中。
2 大数据共享策略——openFDA
2.1 项目概况
openFDA项目于2013年3月启动,2014年6月正式发布。此项目的重要意义在于推动FDA已公开数据的使用,使数据的检索和使用过程更加便利,促进监管效能提升[10]。截至2015年11月,openFDA注册用户超过6 000个,全球21 000个系统与之相连,有超过2 000万次的数据调用。数据开放促使产生了多种多样的应用FDA数据的手机软件。截至2015年7月,已有30个手机软件在使用FDA的开放数据提供服务。
openFDA项目由开放的数据(原始数据下载)、开放的源代码(可检索的、开放的应用程序编程接口)和开放的社区(技术文档和应用实例的交流平台)3部分组成,最终的产品是形成第三方开发的手机软件(图1)。openFDA项目基于云平台技术,可自动实时更新数据;数据获取方式分为网页和应用程序编程接口2种,以下两节分别介绍。
2.2 网页展示和下载
网页展示和下载数据为非信息技术人员获取数据提供了极大的方便。目前,openFDA已公开了食品、药品、医疗器械和化妆品有关不良反应、召回、标识等数据(表1)。网页展示可按照不同的检索类别进行查询,显示相应的统计数据及其直观图表。同时公众可以下载JSON格式的原始数据压缩包,进行自行分析。
2.3 应用程序编程接口
openFDA使用基于搜索的编程接口,使得开发者能够向搜索引擎一样通过文本字符进行检索。应用程序编程接口的数据获取方式,可在代码检索框输入不同的查询代码查询,还可进入相应的编程接口网址,查询代码模版结构。合理利用查询参数构建表达式,可精确获取数据。openFDA的应用程序编程接口支持4个查询参数:search、count、limit、skip,实现查询特定内容、统计指定变量的分类计数、指定返回结果数目的上限、指定需省略的结果数目等功能。在官方网站可免费获取调用openFDA的编程接口的密钥,使得获取、调用数据更自由[11]。
3 美国食品药品监管大数据应用实践
在FDA建立数据共享平台的基础上,一方面FDA开发手机软件加强信息交流,进行有效的数据交换并探索公共网络数据的开发;另一方面,企业与研究机构利用FDA的开放数据,创造性地开发了数据的商业价值和研究价值,以下对各类应用举例介绍。
3.1 促进双向信息交流——紧缺药信息平台
智能手机的广泛应用使得手机软件成为数据采集的重要途径之一,也是扩大数据应用范围的重要手段。为避免药品短缺延误患者治疗,加强FDA和制药企业的信息沟通,2015年3月4日,FDA创新性地发布其首款手机软件——FDA药品短缺(FDA Drug Shortages),提供了更简单、快捷的方式向FDA报告已发生以及潜在的药品短缺问题,也使公众、医药专业人士和制药公司能获知药品短缺的实时信息,可通过输入药品通用名、适应证或活性成分查找。
3.2 实现部门间数据交換——国家电子病历整合
同样的数据,对于不同监管部门有不同的作用。部门间的数据交换可以作为部门已有数据来源的补充,也可以更有效地解决已有问题。2009年美国启动电子病历系统的推广,这其中包括FDA的药品信息数据库与国家电子病历的电子用药处方对接[12]。数据对接后,患者和医生可以随时查看用药记录,提高处方的准确性和护理质量;FDA也可以查看用药情况,将用药情况与后期诊疗情况结合,挖掘不良事件信号;对制药企业,电子病历意味着更快地识别临床试验候选人,并开展上市后药品的跟踪研究。
3.3 挖掘不良事件信号——公共网络数据开发
FDA的不良事件报告系统中有强制性报告,也有自愿性报告,因此漏报情况时有发生。FDA一直在寻找收集不良事件信号的其他途径,包括社交媒体信息和搜索引擎数据。FDA已与网上患者社群网站(如:PatientsLikeMe)以及大众社交网站(如:推特)开展合作,挖掘隐藏在社交媒体中的药品相关使用信息。2013年,谷歌、微软和斯坦福大学的研究人员等都曾撰文描述通过分析搜索引擎数据发现不良事件的方法[13],证明在信息过滤后,搜索引擎数据可以作为识别不良事件的另一个数据来源。2015年7月,美国FDA已开展与谷歌代表探讨使用谷歌的技术和数据识别不良事件[14],以获得不良事件报告难以发现的长期服药副作用。
3.4 鼓励外部创新数据应用——可视化展示和性别差异研究
以下分别挑选了企业和研究机构应用FDA开放数据的2个案例。
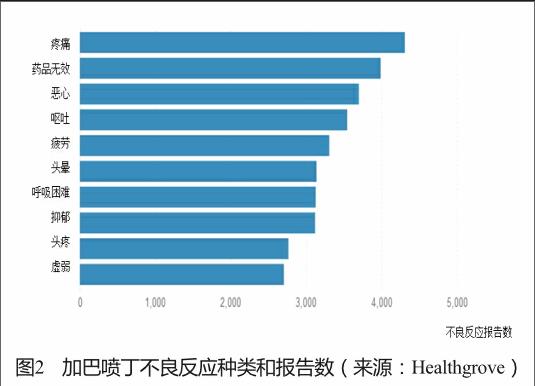
健康树林(Healthgrove)是一个向公众提供专业健康知识的网站,包含大量综合性数据的文章、可视化图表和研究工具。网站通过openFDA的数据接口与FDA药品不良反应数据库的数据对接,提供不良反应报告数、使用人群和召回等药品安全信息,指导科学合理地选择药品。以抗癫痫药加巴喷丁(gabapentin)为例,网站提示:加巴喷丁在2013年有378万患者使用,2013年以来有5次召回,历年涉及91 416例不良反应报告,其中67%是严重的不良反应,按照不良反应的种类和报告年份提供了图表展示(图2、图3)。
瑞典的卡罗林斯卡学院(Karolinska Institute)性别药物研究中心(Centre for Gender Medicine)建立性别反应网站(genderedreactions.com)发布药品对男性和女性不同作用的研究结果,可快速按照男女性别来识别药品副作用的发生率。就针对布洛芬的79 960例不良反应报告而言,女性的不良反应报告数量占到总量的68%。
4 美国食药监管大数据实践对我国的启示
在医药领域,健康和医疗相关的数据大部分掌握在政府行政部门和事业单位中,不对公众开放,缺乏有效地整理和开发。近年来,在我国虽然在食品监管运行机制上实现了“从农田到餐桌”的全过程统一监管,药品监管方面也曾依托药品电子监管码建立电子监管系统(现调整为药品追溯体系),不乏有重视数据采集、开发利用的举措出台,但对大数据技术的挖掘、利用仍处在探索阶段,尤其是数据开放的理念依然没有获得广泛认同,在监管大数据实践方面还有很大的发展空间。我国食药监管政府数据开发策略要遵循总体规划、指标规范、信息共享的方针,实现大数据服务科学监管、服务公众创新。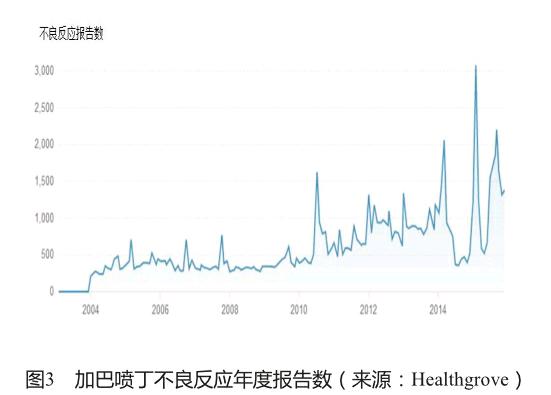
4.1 完善数据库的构建,联接标准化数据
我国食品药品监管数据不但面临“信息孤岛”的挑战,而且已成为高度碎片化的信息孤岛。食药监管系统已有的数据库往往由部门、行业、产品、环节、地域所分隔,在缺乏顶层设计的情况下,甚至一个省级监管机构内药品注册、生产、流通、不良反应监测等不同监管环节也无法实现数据的有效联通。完善数据库需首先清理食药监管机构内的数据,统一数据标准,构建内部数据库,再逐步实现对接跨部门、跨行业的数据,如:原料价格数据、医疗机构的使用数据、药店和药房的零售数据,最终形成真正意义的大数据库。这是提升公共信息资源的价值,实现数据开放和流动的第一步。值得欣喜的是,2014年,国家总局的出台了多项关于数据标准的文件,《食品药品监管信息数据集元数据规范》、《食品药品监管数据库设计规范》、《食品药品监管数据共享与交换接口规范》、《食品药品监管信息基础数据元(机构、人员、药品、医疗器械部分)》等。2016年食品抽检方面的大数据已开展应用。在我国首个全国性食品安全大数据应用项目——“全国食品抽检结果查询系统”中,消费者通过输入食品名称、选择食品分类或者扫描商品条形码即可查询到某一食品两年以来的被抽检结果,其数据库覆盖了全国食品药品监管部门的食品抽检结果数据[15]。
4.2 提升信息公开力度,实现数据自主查询
信息是包含解读和二次加工的数据,数据是原始、可再利用的信息。政府信息公开是政府数据开放的前提和基础,而政府数据开放则是政府信息公开的发展和跃进[16]。推动数据的有效使用应成为信息公开的目的之一。在我国,虽然信息公开从2008年开始实施,但是时至今日,即便在起步较早、公开水平较高的上海,《信息公开条例》并未达到促进政府信息再利用的预期效果[17]。逐年急剧增长的依申请公开申请数量,对比相对稳定的主动公开信息数量,说明公众对信息数据的需求程度与实际公开程度的矛盾愈加激烈。在数据的公开中政府部门有诸多顾虑,如:视数据为政府“私有”资源,不属于政府信息;数据涉密缺乏标准,公开易产生舆情危机;数据本身有缺陷,公开会暴露工作质量问题。但是,主动公开数据库且提供有效的数据检索方式终将成为更加深入和广泛地推进信息公开工作的主要形式。事实上,国家食药监总局和地方食药监管部门在数据主动公开中已建立了一些良好的协作,如:食品抽检、药品抽验、食品生产企业、药品品种以及研发、生产、经营单位等信息。然而,更丰富有效的检索方式、更直观的检索结果展示形式将会更好的推动数据在风险交流、科普宣传、投资引导方面发挥作用。
4.3 扩大数据开发的主体,鼓励公众参与和创新
监管部门的本职是监管,除了以数据手段提升监管效能外,并没有使用数据、挖掘数据价值的责任。食药监局作为一个政府职能部门,纵然掌握了大量数据,也不可能對我国食品药品行业中发生的林林总总情况都提出解决方案。在这个倡导社会共治的时代,只有政府部门开放数据,让社会一起来寻求解决方案,才有可能不断提高饮食用药的安全水平。从国际上看数据开发和开放的发展,都是这样的情况。因此,数据的有效使用,在社会而不是监管部门。数据开放的终极目标在于利用,数据开发中更重要的是公众的参与,以及开放、利用数据之后实际获得的表达权和监督权。同时,信息和数据的共享为社会组织和公民参与管理提供充分条件[18],信息和数据的公开是社会共治的根基。可访问的数据是公众参与数据开发的前提。正如前文介绍的openFDA项目,其启动和维护都依托于第三方企业,构建目的也是为有效刺激公共及私人部门创新、推进学术研究、民众教育以及保护公众健康。开放监管数据能够刺激社会创新从而转化为巨大的经济利益。当监管数据开放后以可忽略不计的成本获得,创新的数据服务企业赋予数据新价值的先进分析技能、发掘数据的全新使用领域将在市场竞争中占据优势。当然,需要注意的是,监管数据的免费开放和数据开发后的有偿使用是两个概念,数据的开发使用将创造价值。因为,监管数据对应于《中华人民共和国政府信息公开条例》中的相关规定“行政机关在履行职责过程中制作或者获取的,以一定形式记录、保存的信息”,是应该及时准确公开的。监管数据应主动公开或依申请公开,依申请公开仅可以收取检索、复制、邮寄等成本费用。“行政机关不得通过其他组织、个人以有偿服务方式提供政府信息。”
4.4 挖掘企業行业数据,推动政企信息共享
2016年6月30日,国家食品药品监督管理总局局务会议审议通过《关于修改〈药品经营质量管理规范〉的决定》,将药品电子监管系统调整为药品追溯体系,要求在企业药品经营质量管理体系中建立相应的管理制度;麻醉药品、精神药品等法规规定的品种仍由药品监管部门建立监控信息网络。这一修订调整了在2015年以前实现全品种、全过程、可追溯的药品电子监管的计划[19]。随着更多由企业自行建立药品追溯体系的出现,药品的全流程信息将不再掌握在政府的电子监管系统中,需要通过推动政企信息的共享,促成具有完备性、覆盖率高的药品信息数据库,实现企业与政府的共赢。基于前文美国食品药品监管大数据应用实践,有许多数据应用需要政府和企业的合作实现,从而达到解决药品短缺等信息对接难题、开展上市后药品的跟踪研究、补充药品不良反应等已有数据库、推动药品安全信息普及、促进药品安全相关科学研究等目的。
参考文献
[1] FDA. SMG 3240.1. FDA staff manual guids, volume IIIgeneral administration[EB/OL]. (1999-08-01)[2016-07-25]. http://www.fda.gov/downloads/aboutfda/ reportsmanualsforms/staffmanualguides/ucm261638.pdf.
[2] FDA. FDA leadership profiles[EB/OL]. (2016-07-11)[2016-07-25]. http://www.fda.gov/aboutfda/centersoffices/ ucm193757.htm.
[3] FDA. Staff manual guide 1114.10[EB/OL]. (2015-7-22)[2016-7-22]. http://www.fda.gov/downloads/aboutfda/ reportsmanualsforms/staffmanualguides/ucm478778.pdf.
[4] PRNewswire. Iodine Inc. Awarded $1.17 Million Contract from the Food and Drug Administration for openFDA project[EB/OL]. (2015-01-29)[2015-07-30]. http://www. prnewswire.com/news-releases/iodine-inc-awarded-117-million-contract-from-the-food-and-drug-administration-foropenfda-project-300027652.html.
[5] JASON S. FDA shows how to cut costs and reduce paperwork[EB/OL]. (2013-11-15)[2015-8-11]. http://www.govtech.com/ data/FDA-Shows-How-To-Cut-Costs-and-Reduce-PaperWork.html?utm_source=related&utm_medium=direct&utm_ campaign=FDA-Shows-How-To-Cut-Costs-and-ReducePaper-Work.
[6] Alexander Gaffney. FDA to require electronic submission of new drug, biologic files in next two years [EB/OL]. (2015-05-07)[2016-07-22]. http://www.raps.org/RegulatoryFocus/News/2015/05/07/22116/FDA-to-Require-ElectronicSubmission-of-New-Drug-Biologic-Files-in-Next-Two-Years.
[7] FDA. FDA resources for data standards[EB/OL]. (2015-02-13)[2016-07-26]. http://www.fda.gov/forindustry/datastandards/ default.htm.
[8] FDA. Individual case safety reports[EB/OL]. (2015-10-07)[2016-07-26]. http://www.fda.gov/ForIndustry/ DataStandards/IndividualCaseSafetyReports/default.htm.
[9] FDA. Data mining at FDA-White Paper[EB/OL]. (2015-11-20)[2016-08-30]. http://www.fda.gov/scienceresearch/ healthinformatics/ucm446239.htm#safetyassessment.
[10] JASON S. Federal CTO Todd Park announces FDA open data portal[EB/OL]. (2014-06-02)[2016-07-26]. http://www. govtech.com/federal/Federal-CTO-Todd-Park-AnnouncesFDA-Open-Data-Portal.html.
[11] 施雯慧, 陈颖, 姚捷, 等. FDA公共数据开放项目中屈螺酮炔雌醇片的分析研究[J]. 中国药物警戒, 2015, 12(9): 552-555.
[12] FDA. Science board to the FDA[EB/OL]. (2015-11-18)[2016-07-22]. http://101.96.10.42/www.fda.gov/downloads/ advisorycommittees/committeesmeetingmaterials/ scienceboardtothefoodanddrugadministration/ucm473504. pdf.
[13] Yom-Tov E, Gabrilovich E. Postmarket drug surveillance without trial costs: discovery of adverse drug reactions through large-scale analysis of web search queries[J]. J Med Internet Res, 2013, 15(6): e124.
[14] Michael M. FDA and Google talk ‘adverse event trending[EB/OL]. (2015-07-16)[2015-07-23]. http://www. raps.org/Regulatory-Focus/News/2015/07/16/22888/FDAand-Google-Talk-Adverse-Event-Trending/.
[15] 国家食品藥品监督管理总局. 全国食品安全大数据应用项目落户海南[EB/OL]. (2016-07-12)[ 2016-07-22]. http:// www.cfda.gov.cn/WS01/CL0005/158742.html.
[16] 张毅菁. 从信息公开到数据开放的全球实践——兼对上海建设“政府数据服务网”的启示[J]. 情报杂志, 2014, 33(10): 175-178, 183.
[17] 肖卫兵. 政府数据开放机制的建立和完善:结合《政府信息公开条例》谈起[J]. 理论探讨, 2015(4): 154-157.
[18] 刘霞, 向良云. 公共危机管理[M]. 上海: 上海交通大学出版社, 2010: 20-21.
[19] 国务院. 国务院关于印发国家药品安全“十二五”规划的通知[EB/OL]. (2012-02-13)[2016-07-22]. http://www. gov.cn/zwgk/2012-02/13/content_2065197.htm.
