猴头菇多糖的超声辅助罐组式动态逆流提取及纯化研究
2017-06-01周丹丹周春晖黄惠华
周丹丹,周春晖,黄惠华
(1.华南理工大学食品科学与工程学院,广东广州 510641;2.广东太阳神集团有限公司,广东广州 510665)
猴头菇多糖的超声辅助罐组式动态逆流提取及纯化研究
周丹丹1,2,周春晖2,黄惠华1,*
(1.华南理工大学食品科学与工程学院,广东广州 510641;2.广东太阳神集团有限公司,广东广州 510665)
本文研究了超声辅助罐组式动态逆流提取及纯化猴头菇多糖的工艺。以正交实验确定单罐提取猴头菇多糖最佳工艺参数的基础上建立罐组式多态逆流提取条件;利用凝胶色谱法分离和鉴别猴头菇提取物中的干扰物质,确定最佳纯化方式。结果表明:采用3个组罐连接,以连续3级(次)超声辅助罐组式动态逆流萃取法,在料液比1∶15,提取温度50 ℃,提取时间2 h后,用超声功率400 W强化提取25 min的条件下,猴头菇多糖得率达13.37%,经75%乙醇沉淀后多糖含量为66.48%;利用凝胶色谱法确定猴头菇多糖以33%乙醇、50%乙醇分级沉淀结合碱性铜试剂选择性纯化的最佳纯化方式。猴头菇多糖采用超声辅助罐组式动态逆流提取法比传统单罐三次提取法得率提高50%以上,提取时间缩短3 h,节约溶剂40%以上。
猴头菇多糖,超声辅助罐组式动态逆流提取,纯化
猴头菇(Hericiumerinaceus)是我国珍贵的药食兼用真菌,又称猴头菌、猴头、猴菇、猴蘑[1]。我国传统医学认为其性平、味甘、益五脏,具有助消化的作用[2],现代医学还发现其具有抗肿瘤[3]、降血脂、抗辐射、抗氧化和能够增强机体的免疫调节功能[4-7]。猴头菇多糖为其主要的功效成分,为水溶性物质[5-9],研究表明[10],多糖的纯度能影响其生物活性,因此,制备高纯度的猴头菇多糖是将其应用于食品、医药及保健食品领域中不可或缺的步骤。
传统的猴头菇多糖提取工艺主要采用的是以静态多功能提取罐为基础的间歇型单罐提取工艺,其存在的主要不足是得率和生产效率不够理想,且提取过程中的能量利用率不高,因此工艺上有改良的必要。目前,人们开始研究其连续提取的新工艺。罐组式动态逆流萃取是在常规静态提取的基础上发展而来[11-13]。此种工艺近年开始应用到白芨多糖碱[14]、丹参素等功效物质的提取生产中,它是通过对多个(或多段)提取单元之间物料和溶剂进行浓度梯度的排列和流程的配置进行优化,结合提取单元组数、提取温度和提取溶媒用量,循环地对物料进行提取的一种新技术。同时,在提取过程中还可以施加超声波处理,利用超声波的具有的起泡效果、气穴空化效应、加压稀薄效应等场效应,强化萃取过程的传质作用,能缩短提取时间,还可明显提高萃取率,降低了能量消耗[15]。
本研究主要探讨利用罐组式动态逆流萃取技术,结合超声处理的强化效应,进行猴头菇多糖的提取新工艺研究。为此种技术在猴头菇深加工过程中的利用提供新的技术支撑。
1 材料与方法
1.1 材料与仪器
猴头菇子实体 福建省古田县恒昌农副食品有限公司;葡萄糖标准品(100 mg/支,100%) 中国药品生物制品检定所;葡聚糖标准品(1 g/支97%) Sigma公司;其它化学试剂除特殊要求外,均为分析纯。铜贮存液的配制:称取3.0 g硫酸铜(五水),30.0 g柠檬酸钠加水溶解至1 L,此溶液可贮存2周,使用时取铜贮存液50 mL,加水 50 mL混匀后加入无水硫酸钠12.5 g,临用现配;铜洗涤液的配制:取水50 mL,加入10 mL铜应用溶液,10 mL 2.5 mol/L氢氧化钠溶液,混匀。
TGCXN-2B(2 L)循环超声提取机 南京先欧仪器制造公司;HH-4 数显恒温水浴锅 金坛市富华仪器有限公司;RE-5202型旋转蒸发仪 上海亚荣生化仪器厂;722型可见分光光度计 上海精密科学仪器有限公司;高效液相色谱仪1260 Agilent公司;凝胶色谱分析仪及凝胶色谱柱 TSK Gel 3000SWXL;7.8 mm×300 mm,TOSOH公司。
1.2 实验方法
1.2.1 猴头菇多糖提取工艺 将猴头菇在60 ℃条件下烘干至水分含量6%左右,粉碎,全粉过40目筛。精密称取猴头菇粉0.2 kg,加入3 L罐组式动态逆流集成超声波提取仪中提取(多个提取罐机组串联,提取溶媒沿着罐组内各罐猴头菇原料的溶质浓度梯度逆向地由低向高顺次输送通过各罐,并与猴头菇保持一定提取时间并多次套用)→多糖沉淀→多糖纯化。
1.2.2 猴头菇多糖得率测定 采用苯酚-硫酸法检测猴头菇多糖含量并计算得率。精确称取105 ℃干燥至质量恒定的无水葡萄糖0.1 g,溶解定容于1000 mL容量瓶中配成质量浓度为0.100 mg/mL的葡萄糖标准溶液,分别精确量取0、0.1、0.2、0.4、0.6、0.8、1.0 mL葡萄糖标准溶液并加蒸馏水至总体积为1.0 mL,然后各加质量分数6 %苯酚溶液1.0 mL、硫酸5.0 mL,迅速摇匀在40 ℃水浴反应30 min,以加蒸馏水的试管为空白,于波长490 nm处测定吸光度。 将测得值以葡萄糖溶液中葡萄糖含量(μg)为横坐标x,以吸光度(A)为纵坐标,绘制标准曲线,得回归方程为A=0.0116 x+0.0324(R2=0.9995)。猴头菇多糖含量及得率分别按如下公式计算:
多糖含量(%)=质量浓度(mg/mL)×定容后体积(mL)/粗多糖质量(g)×103×100
多糖得率(%)=质量浓度(mg/mL)×定容后体积(mL)/猴头菇粉末质量(g)×103×100
1.2.3 多糖分子量测定方法 凝胶色谱柱:TSK Gel 3000SWXL;7.8 mm×300 mm;柱温:35 ℃;流动相:0.025 mol/L NaH2PO4+0.025 mol/L Na2HPO4(pH=6.7),+0.05% NaN3;流速:0.8 mL/min;检测器:示差折光检测器(RID),恒温35 ℃。称取分子量分别为 1.0×103、5.0×103、1.20×104、2.50×104、5.00×104、8.00×104、1.50×105、2.70×105的一系列葡聚糖标准品,用流动相配制成每种标样的质量浓度约为1.0 mg/mL的系列标准溶液,将样品用流动相溶解后,经0.45 μm滤膜过滤后,进行凝胶色谱测定。根据其凝胶色谱的保留时间和峰形进行定性分析。以多糖标样的保留时间为横坐标,多糖相对分子质量的对数为纵坐标作 GPC 的普适校正曲线。根据样品的出峰时间在校正曲线上求得多糖峰的平均相对分子质量及其分布。
1.2.4 单罐单因素实验及优化实验设计 本实验猴头菇经热水浸提后进行超声波辅助提取。首先用过预实验及实际操作分析确定提取过程中的两个重要因素,热水浸提时间(2 h)和提取次数(3次)。提取过程中涉及到四个关键因素:料液比、热水浸提温度、超声功率、超声时间。分别设定四个单因素的水平为:温度70 ℃,浸提时间2 h,超声功率400 W,超声时间15 min,料液比1∶5、1∶10、1∶15、1∶20、1∶25;料液比1∶20,浸提时间2 h,超声功率400 W,超声时间15 min,浸提温度30、50、70、80、90 ℃;温度70 ℃,浸提时间2 h,料液比1∶20,超声时间15 min,超声功率分别为300、400、500、600、700 W;温度70 ℃,料液比1∶20,浸提时间2 h后,超声功率400 W,超声时间为10、15、20、25、30 min。以多糖得率为评价指标,逐个考察各个提取条件对得率的影响。
1.2.5 正交实验设计 以对超声提取多糖影响效果显著的4个因素:料液比、浸提时间、超声时间、超声功率为变量,以得率为考察指标,采用L9(34)正交实验表进行正交实验优化。实验设计中的水平及编码表见表1。
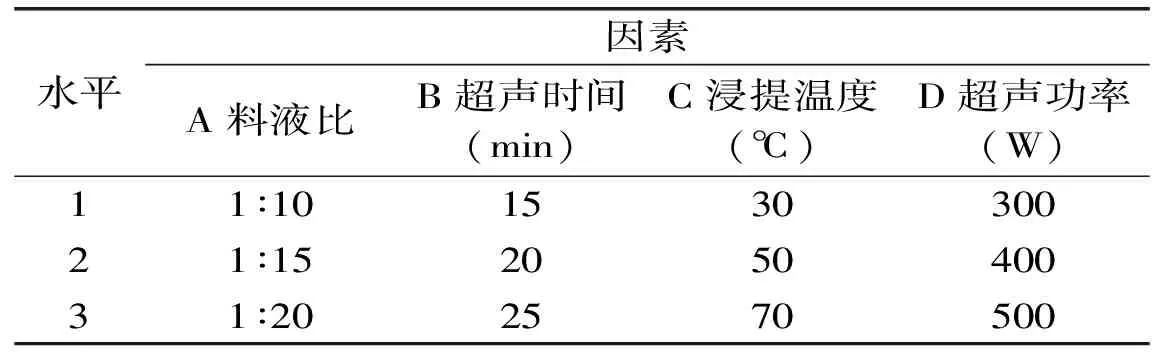
表1 正交实验因素与水平
1.2.6 超声辅助罐组式动态逆流提取猴头菇多糖方法研究 超声辅助罐组式动态逆流提取由真空泵管连接多组提取罐组组成,提取流程及提取设备设计如图1a、图1b所示:罐A第一次提取后,终提取液进入贮罐;罐A第二次提取后提取液进入罐B进行罐B第一次提取,终提取液进入贮罐;罐A第三次提取后,提取液进入罐B进行罐B第二次提取,提取液再进入罐C进行罐C第一次提取,终提取液进入贮罐依次按照此方式,溶质浓度低度由低向高顺次循环提取。
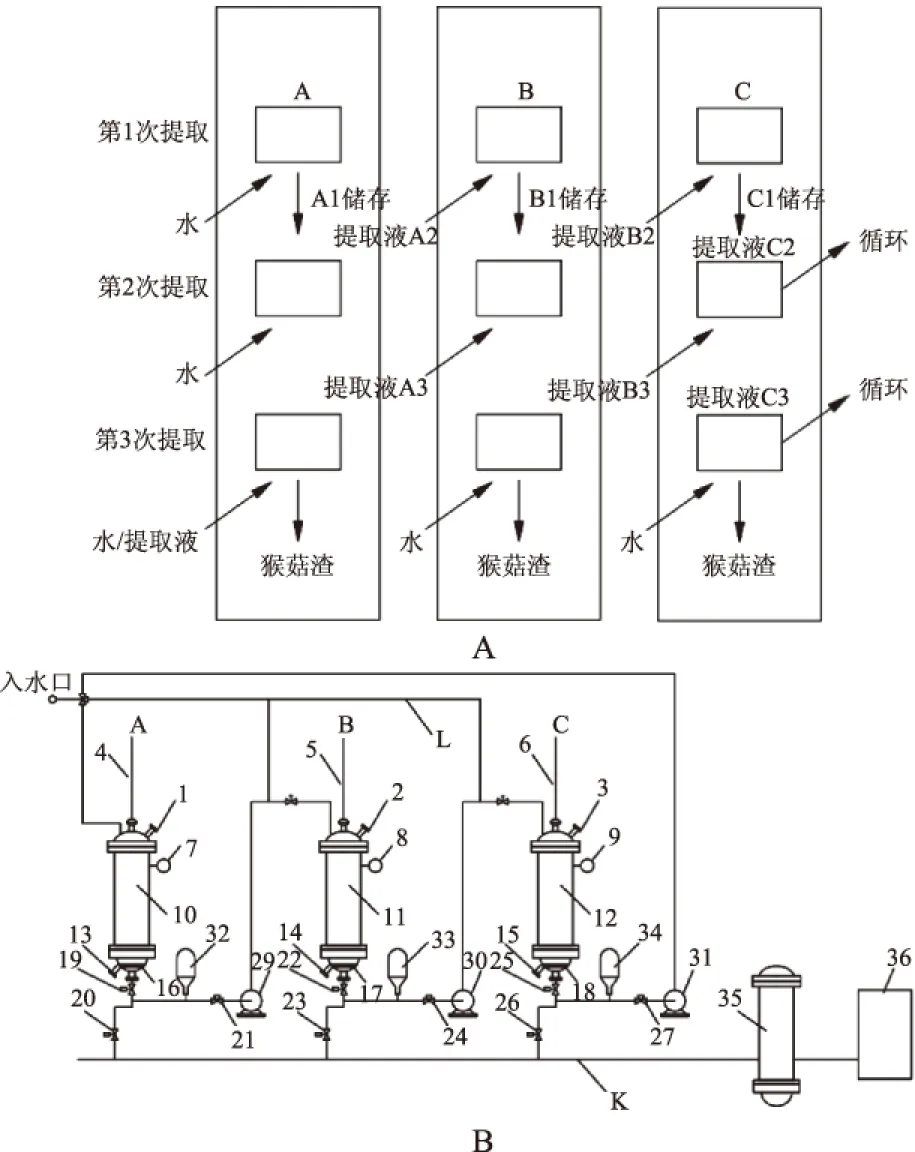
图1 罐组式动态逆流提取猴头菇多糖工艺设计图Fig.1 Multi-stage counter-current solvent extractions of Hericium erinaceus polysaccharide process design注:A、B、C-动态循环提取单元;1、2、3-进料口;4、5、6-超声发生器探头;7、8、9-温度、压力表;10、11、12-提取罐(内含加热管、物料循环器);13、14、15-排料口;16、17、18-纱网隔板;19、20、21、22、23、24、25、26、27-多向阀门;29、30、31-真空循环泵(多向);32、33、34-贮罐;35-总储液罐;36-浓缩系统;K-总管;L-水管。
确定罐组数实验设计:分别设计由2个、3个、4个提取单元组成的提取体系。准确称量猴头菇粉末样品0.2 kg入每个组罐,采用单罐工艺预实验获得的提取参数,以猴头菇多糖得率为指标探索罐组数,选择提取体系的最优罐组数。同时与传统单罐间歇式提取工艺(100 ℃,2 h,提取3次)对比。
1.2.7 猴头菇多糖沉淀的方法研究 将最佳正交条件下提取的粗多糖提取液,分别用70%、75%、80%乙醇对多糖进行沉淀[16]。并用苯酚-硫酸法测定70%、75%、80%乙醇沉淀得到多糖含量,用凝胶色谱(GPC)TSK Gel 4000 SWXL 柱测定粗多糖的分子量[17-19]。
1.2.8 猴头菇多糖纯化的方法研究 对提取出的猴头菇多糖采用凝胶色谱法分析,确定提取物主峰和杂峰的保留时间及分子量。根据猴头菇多糖提取物中的干扰情况,采用多种方法纯化,选择最优纯化方式,具体操作如下:
1.2.8.1 乙醇分级沉淀大分子杂质 采用30%、55%乙醇分级沉淀后,分析凝胶色谱图。
1.2.8.2 Sevage法或三氯乙酸(TCA)除蛋白 取猴头菇粗多糖提取物,用水配制两份浓度为1%的样品溶液,分别用三氯乙酸(TCA)法Sevage法沉淀蛋白,分析凝胶色谱图。
1.2.8.3 透析法除小分子杂质 取猴头菇粗多糖提取物,用水配制成浓度为 1 %的样品溶液,置于透析袋中透析 72 h,分析凝胶色谱图。
1.2.8.4 碱性铜试剂沉淀法除杂质 取适量猴头菇粗多糖提取物加水5 mL溶解,加入2.5 mol/L NaOH 5 mL,铜应用溶液5 mL,混匀在沸水浴中煮沸2 min,冷却后以4000 r/min离心5 min,弃上清液,沉淀用铜洗涤液洗涤2次,加5 % HCl乙醇溶液5 mL混合,4000 r/min离心5 min,沉淀分析凝胶色谱图。
1.3 数据统计分析
所有实验进行3次重复,取平均值并计算标准偏差,采用Minitab® 17统计分析软件进行单因素方差分析(One-Way ANOVA)。显著性水平p<0.05为差异显著,p<0.01为差异极显著。
2 结果与分析
2.1 提取单因素实验结果与分析
2.1.1 浸提温度对猴头菇多糖得率的影响 如图2所示,猴头菇多糖得率随浸提温度增加而提高,浸提温度为30、50、70 ℃时,得率有显著提升,但温度到70 ℃以后得率并无显著增加,考虑继续进行正交实验。

图2 浸提温度对猴头菇多糖得率的影响Fig.2 Influence of extracting temperature on Hericium erinaceus polysaccharide extraction rate注:图2~图5中相同字母代表示无显著性差异(p<0.05)。
2.1.2 料液比对猴头菇多糖得率的影响 如图3所示,得率随料液比增加而提高,当料液为超过1∶10时,猴头菇多糖得率显著增加,但继续增加料液比,得率并无显著变化,选择1∶10、1∶15、1∶20进行正交实验。
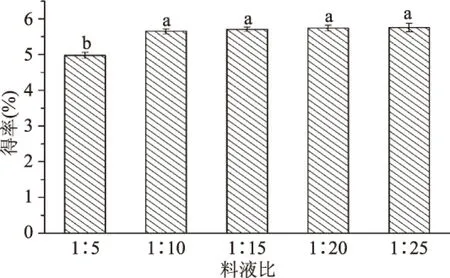
图3 料液比对猴头菇多糖得率的影响Fig.3 Influence of solid-liquid ratios on Hericium erinaceus polysaccharide extraction rate
2.1.3 超声功率对猴头菇多糖得率的影响 如图4所示,300~500 W超声功率处理,猴头菇多糖得率显著增加,500 W达到最大的多糖得率。但继续增加超声功率,得率并无显著变化,并且呈多糖得率有下降的趋势,选择300、400、500 W超声功率进行正交实验。

图4 超声功率对猴头菇多糖得率的影响Fig.4 Influence of ultrasonic power on Hericium erinaceus polysaccharide extraction rate
2.1.4 超声处理时间对猴头菇多糖得率的影响 如图5所示,当超声时间增加到15 min时,猴头菇多糖得率显著增加,但继续增加超声时间,得率并无显著变化。综合工艺条件考虑,选取15、20、25 min继续做正交实验以确定最佳的超声时间。
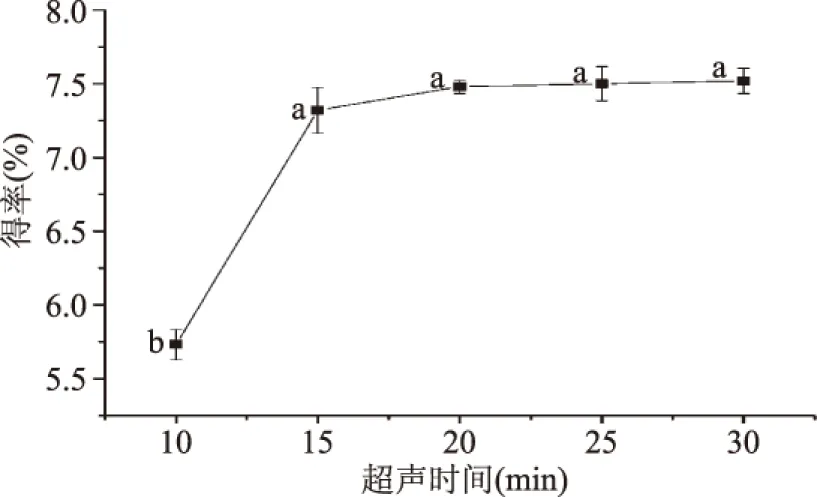
图5 超声时间对猴头菇多糖得率的影响Fig.5 Influence of ultrasonic time on Hericium erinaceus polysaccharide extraction rate
2.2 正交实验结果与分析
由表2的正交实验的结果可知,影响猴头菇多糖得率的主次因素为:超声时间﹥超声功率﹥浸提温度﹥料液比。最佳提取条件是A2B3C2D2,即料液比1∶15、超声时间25 min、浸提温度50 ℃,超声频率400 W。由表3方差分析数据显示,超声时间、超声功率和浸提温度对实验结果影响显著,料液比不显著。
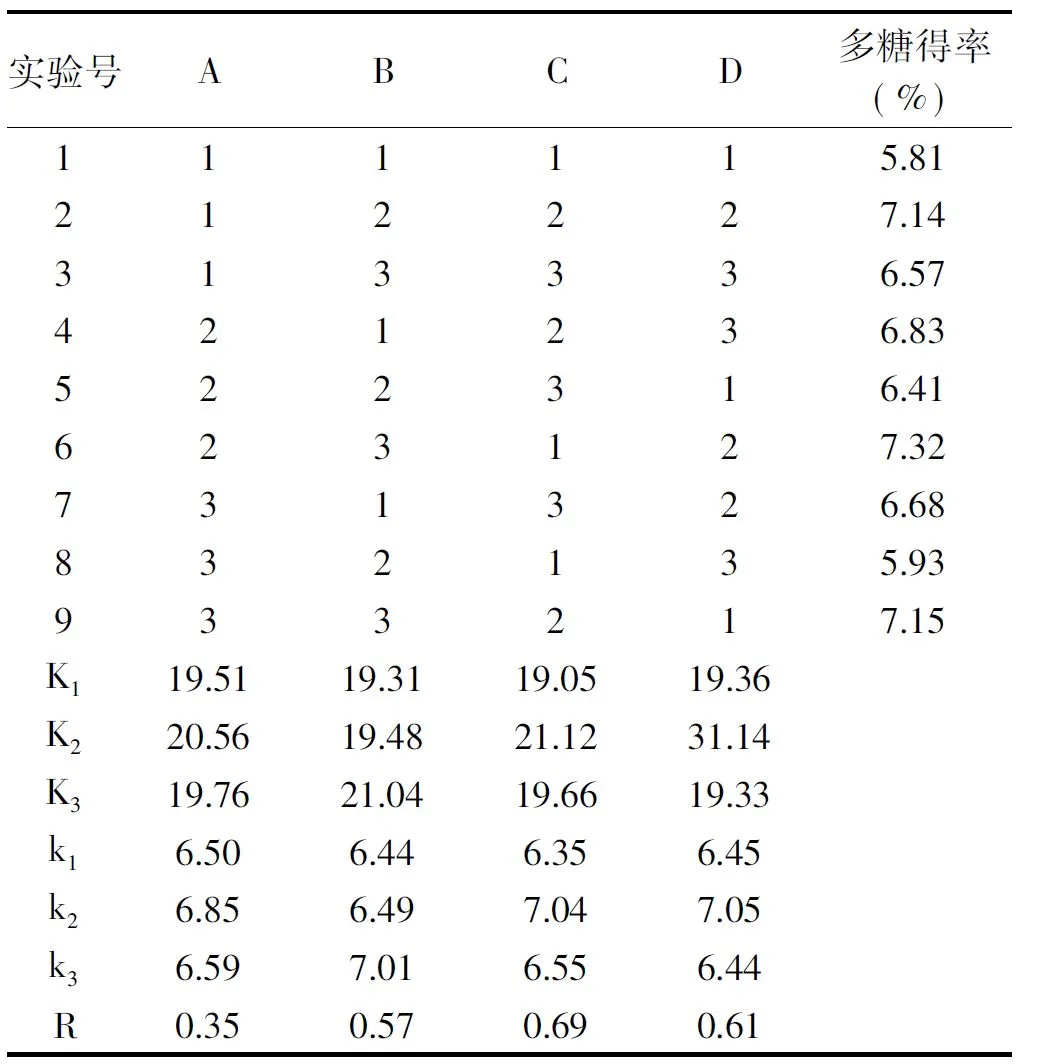
表2 多糖提取L9(34)正交实验猴头菇多糖得率结果
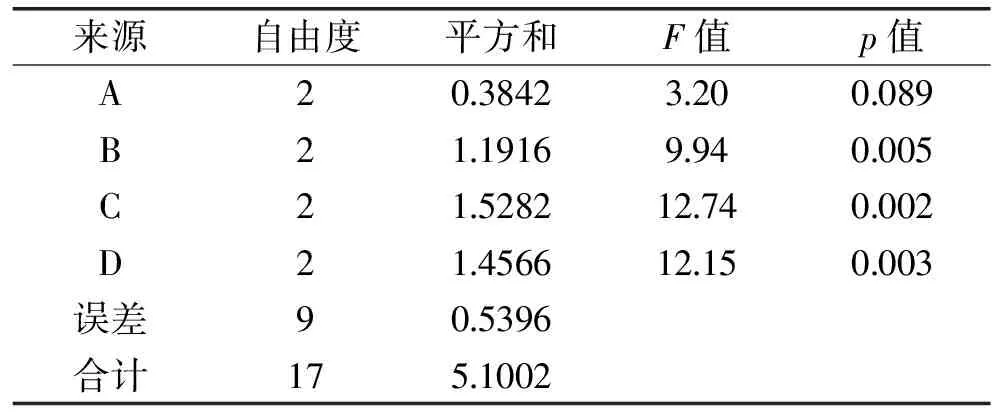
表3 猴头菇多糖提取L9(34)正交实验方差分析
对优化条件进行验证实验,结果表明:优化条件下猴头菇多糖的得率为7.64%,高于正交实验的非优化组合。
2.3 多组罐逆流提取猴头菇多糖方法研究结果与分析
根据正交实验结果,选择最优条件进行提取。由表4可见,猴头菇多糖得率随组罐数增加有上升趋势,但从工艺耗时、提取成本及产品微生物控制时限考虑,选择3个组罐串联提取比较合理。由表5可见,罐组式动态逆流提取工艺与现有技术中的静态多功能提取罐为基础的间歇型单罐提取工艺相比,猴头菇多糖得率增加80%以上,溶剂使用量和耗能均减少40%以上。
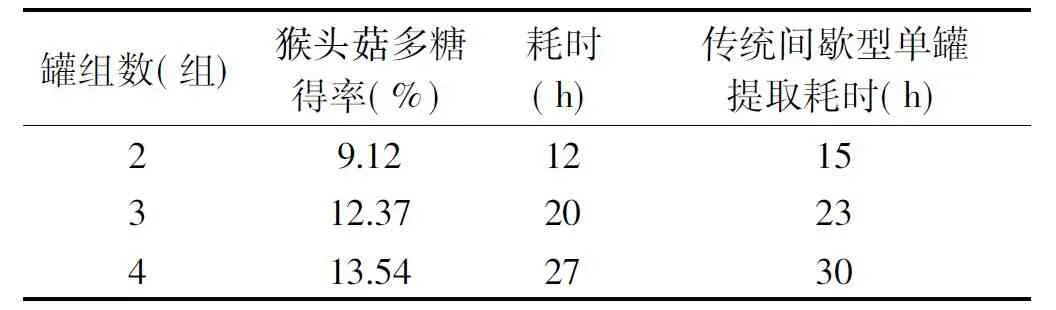
表4 不同组罐数对猴头菇得率及耗时的对比

表5 不同工艺提取猴头菇多糖得率、溶剂及耗能对比
2.4 不同比例乙醇沉淀猴头菇多糖实验结果与分析
分别用70%、75%、80%的乙醇对多糖提取物进行沉淀处理,表6结果表明,75%乙醇沉淀出的多糖量最多,随着乙醇比例的增大,多糖沉淀量量减少,同时粗多糖主峰的分子量降低,小分子部分杂质增多。故选择75%乙醇沉淀多糖,经验证实验后,75%乙醇沉淀后多糖含量为66.48%。

表6 不同比例乙醇沉淀多糖的结果
2.5 猴头菇多糖纯化方法选择分析与结果
2.5.1 分级沉淀除去大分子 对提取出的猴头菇粗多糖采用凝胶色谱法分析,发现主峰分子量为3000~20000之间,杂峰较多,干扰较大;另在保留时间为6.8 min左右、分子量为50万以上有一个较小的峰。从色谱图中发现,杂质峰保留时间在6.8 min左右,多糖主峰的保留时间为11.4 min左右,两峰干扰性弱。如图6所示,33%、50%乙醇沉淀均能有效地将杂质去除,因此可选择先用33%乙醇沉淀除去大分子杂质,再用50%乙醇级沉淀多糖进行纯化。
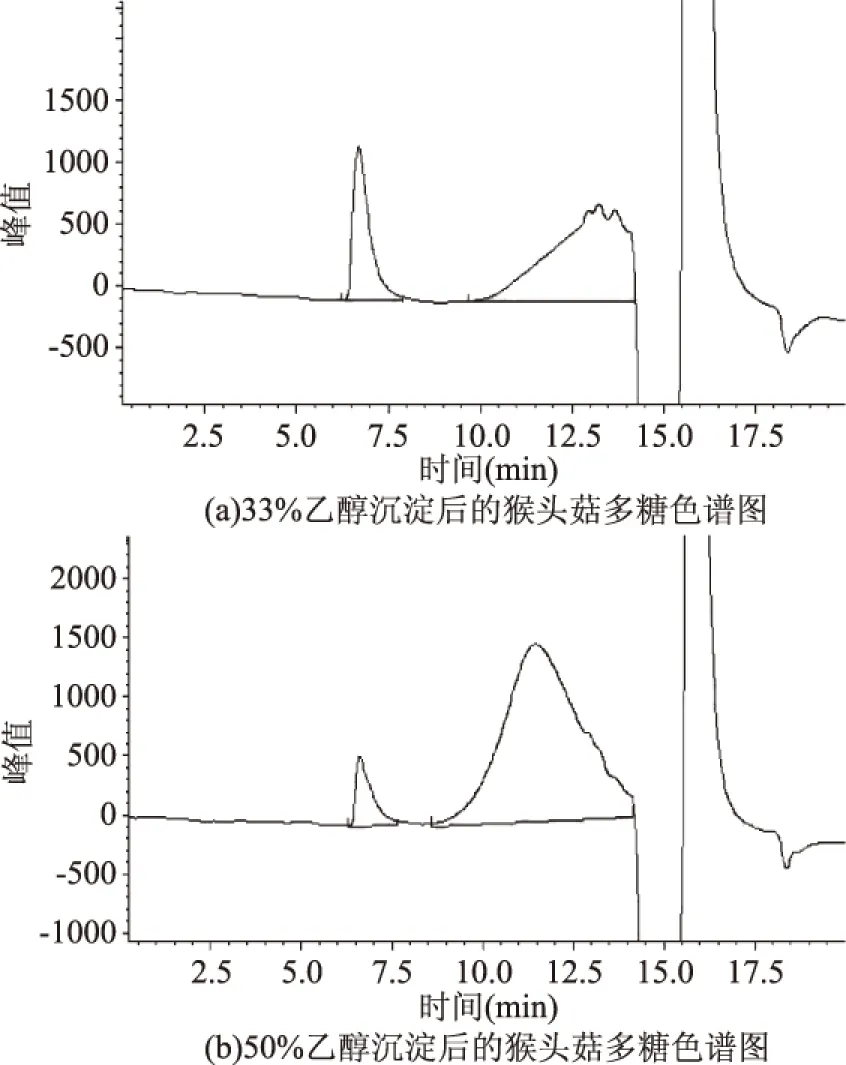
图6 分级沉淀后猴头菇多糖的GPC变化Fig.6 GPC change classification of Hericium erinaceus polysaccharide after precipitation
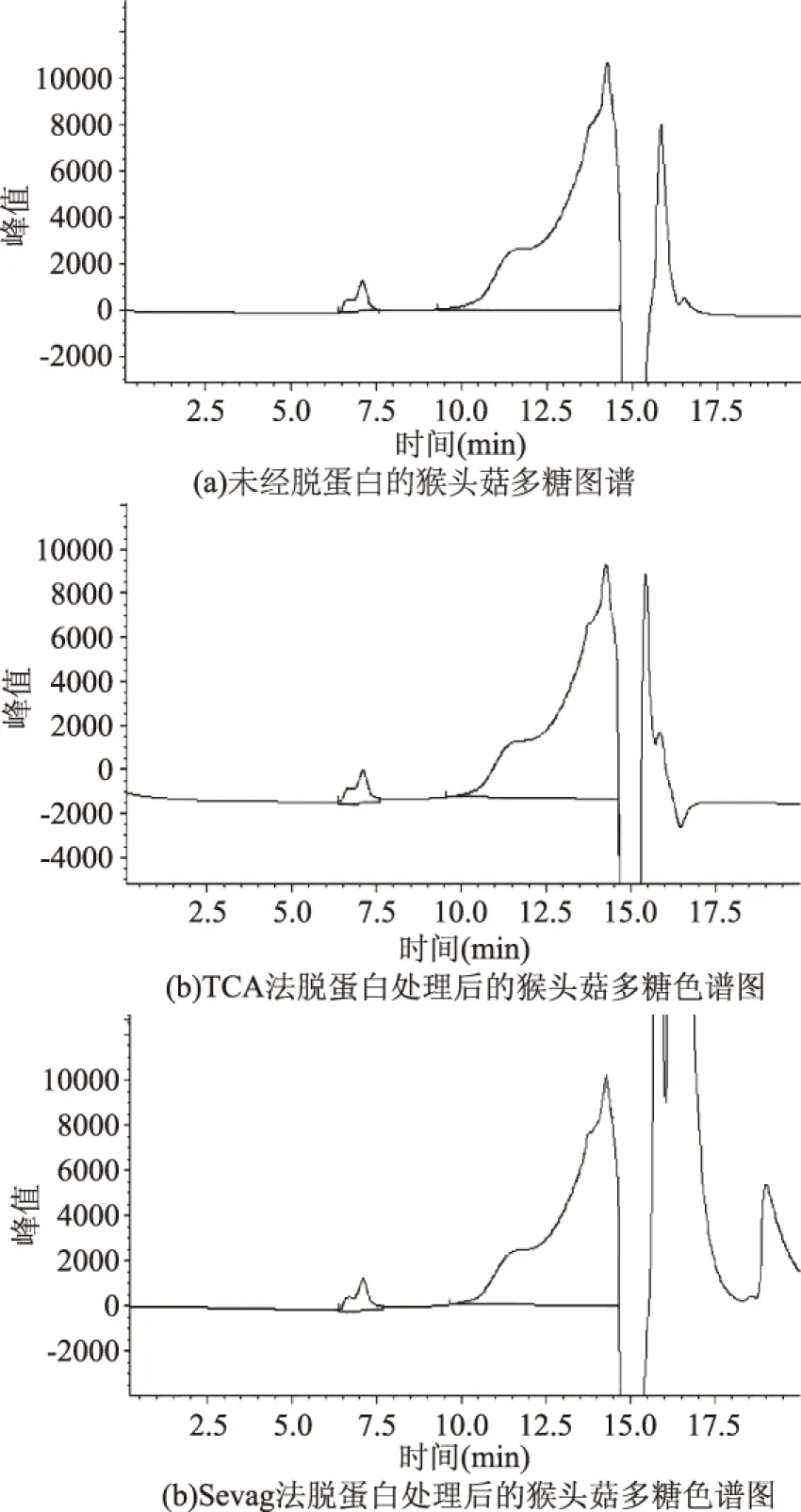
图7 TCA法和Sevage 法脱蛋白后猴头菇多糖的GPC变化Fig.7 The change of GPC of Hericium erinaceus polysaccharide after removing protein by TCA and Sevage method
2.5.2 去除蛋白和杂质的方法比较 由图7的GPC可见,用凝胶色谱法比较猴头菇多糖脱蛋白前后多糖分子量分布基本未发生变。说明利用 TCA或Sevage法除蛋白对多糖的分子量分布影响均不大。
2.5.3 透析法除小分子杂质 透析后样品溶液颜色变浅。由图8的GPC可见,经透析后可以有效除去小分子杂质峰,但多糖的分离效果无明显改善。
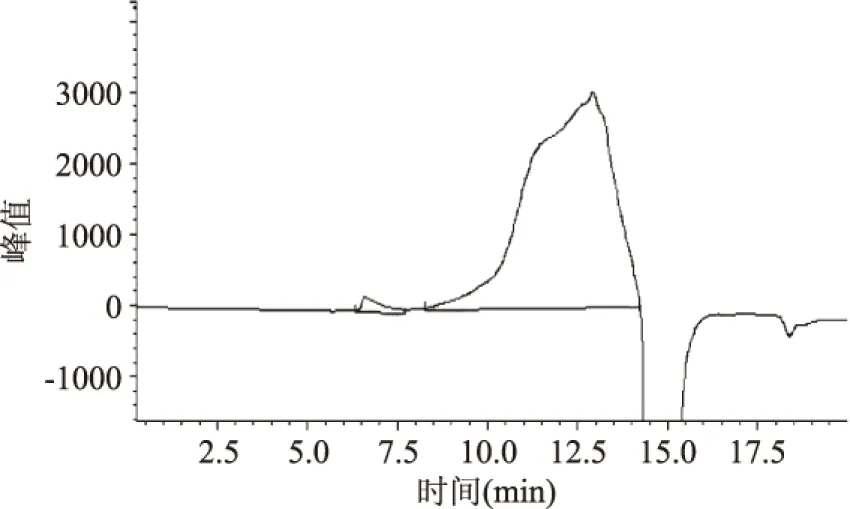
图8 透析法处理后的猴头菇多糖色谱图Fig.8 GPC of the dialysis treated Hericium erinaceus polysaccharide
2.5.4 碱性铜试剂沉淀法除杂质 如图9所示,结果表明效果良好,杂质峰基本去除,多糖色谱峰形对称,无干扰。

图9 碱性铜试剂沉淀后的猴头菇多糖色谱图Fig.9 GPC of Hericium erinaceus polysaccharide precipitated by alkaline copper reagent
以上结果表明,去除杂质的方法中,虽然TCA法和Sevage法可以有效地去除杂蛋白,透析也可以有效去除小分子杂质,但是对改善多糖的GPC图谱效果不大,而选择碱性铜试剂纯化猴头菇多糖粗提物,既能够有效地去除杂质,有能够有效地改善多糖的图谱峰,有利于纯化、收集和分离。
3 结论
采用3个串联超声辅助罐组式动态逆流提取猴头菇多糖,最佳提取参数为料液比1∶15,50 ℃水浸泡提取2 h,然后室温400 W超声波震荡提取25 min,每组管循环提取三次。此工艺的得率可达12.37%,获得猴头菇多糖含量达66.48%;浓缩后的猴头菇多糖采用33%乙醇沉淀除去大分子杂质,再用50%乙醇级沉淀多糖最后在碱性铜试剂条件下沉淀纯化,获得高纯度的猴头菇多糖。
采用超声辅助罐组式动态逆流超声提取方法,在提取过程中,溶剂始终不会达到饱和状态,溶剂和物料存在相对运动,多糖浸出速度快,得率较传统的单罐提取提高80%以上。同时,提取具有连续性,大大提高了生产效率,节约溶剂40%以上。但在工业化生产中仍存在一些缺陷,如需要反复添加和排出物料与浸出液等问题,在今后的研究中,将进一步对如何做得更加连续化进行探讨。
[1]黄年来. 中国食用菌百科[M]. 北京:中国农业出版社.1997.
[2]王薇. 猴头菇的营养保健功能及其在食品工业中的应用[J].食品与药品,2006,8(4):24-26.
[3]郁利平,王莉馨,赵清池,等. 猴头多糖抑制肿瘤生长机理初探[J]. 吉林大学学报:医学版,1992,(6):532-533.
[4]杜志强,杨晨晨,王建英. 猴头菇多糖对小鼠血清抗氧化能力的影响[J].食品研究与开发,2011,32(9):56-58.
[5]杜志强,王建英. 猴头菇多糖抗氧化活性及耐缺氧功能的研究[J]. 江苏农业科学,2011,39(5):398-399.
[6]杜志强,任大明,葛超,等. 猴头菌丝多糖降血糖作用研究[J].生物技术,2006,16(6):40-41.
[7]Md. Asaduzzaman Khan,Mousum i Tania,Rui Liu,et al.Hericiumerinaceus:an edible mushroom with medicinal values.J Complement Integr Med,2013,10(1):253-258.
[8]An-qiang Zhang,Li Fu,Mei Xu,et al. Structure of a water-soluble heteropolysaccharide from fruiting bodies of Hericium erinaceus,Carbohydrate Polymers,2012,(88):558-561.
[9]张劲松,樊华,李玉详,等.几种药用真菌粗提物对多种人体肿瘤细胞株增殖的抑制作用[J]. 天然产物研究与开发,2000,12(2):27-31.
[10]樊伟伟,黄惠华. 猴头菇多糖研究进展[J].食品科学,2008,29(1):355-358.
[11]王艳艳,王团结,陈娟. 连续动态逆流提取技术及其设备研究[J]. 机电信息,2015,431(5):1-9.
[12]李希,谢守德,冯建安,等 动态逆流提取技术在中药提取中的应用[J]. 实用中医药杂志,2008,24(12):806-808.
[13]王巧娥,任虹,曹学丽.动态逆流提取技术及其在天然活性成分提取中应用[J]. 安徽农业科学,2011,39(5):2535-2537,2540.
[14]孙达峰,史劲松,张卫明,等.白芨多糖的连续逆流提取的工艺研究[J]. 中国野生植物资源,2006,25(5):34-45,43.
[15]陈红专,高曙宾,高鹏,等.人参超声逆流提取工艺研究[J],中草药,2012,43(6):1115-1117.
[16]张树海. 猴头菇多糖提取及纯化的研究[J],食品研究与开发,2006,27(11):103-106.
[17]吴扬兰,王远亮,杨力.SEC-RI-MALLS技术在香菇多糖分子量与分子量分布分析方面的应用研究[J].药物分析杂志,2011,31(12):2256-2259.
[18]王国佳,曹红,邢俊.波等凝胶色谱法同时测定香菇多糖制剂中多糖分子量和含量[J]. 中国药事.2013,27(10):1090-1094.
[19]史文涛,庞文生,胡娟. 高效凝胶色谱法测定太子参均一多糖分子量[J]. 中国民族民间医药.2015,2:20.
Research of extraction of polysaccharide fromHericiumerinaceuswith ultrasonic-assisted and multi-stage dynamic countercurrent method
ZHOU Dan-dan1,2,ZHOU Chun-hui2,HUANG Hui-hua1,*
(1.Department of Food Science and Engineering,South China University of Technology,Guangzhou 510641,China;.Guangdong Apollo Co.,Ltd.,Guangzhou 510665,China)
To determine the polymorphism of countercurrent extraction conditions based on the optimum extraction parameters of single tank Hericium polysaccharide with orthogonal experiment. To determine the optimum purification method through separating and identifying the interfering substance of hericium by the use of gel chromatography. The results showed that an extraction process was assembled by three tanks in continuous dynamic countercurrent mode andHericiumerinaceusmaterials were treated under the conditions of 1∶15 of solid-liquid ratio,and 50 ℃for 2 hours and then the extraction was enhanced by ultrasonic at 400 W for 25 minutes. The results showed that polysaccharide extraction rate reached about 13.37%. After 75% ethanol precipitation,the content of polysaccharide was 66.48%. Gel chromatography showed that using 33%,50% ethanol to pretreat crude extract ofHericiumerinaceuspolysaccharide combined with alkaline copper reagent could effectively purify product ofHericiumerinaceuspolysaccharide. Compared to the traditional method of single tank extraction,the extraction rate ofHericiumerinaceuspolysaccharide was increased by more than 50%,and extraction time and used solvent were decreased by about 30% and 40% respectively.
Hericiumerionaceuspolysaccharide;ultrasonic-assisted multi-stage dynamic countercurrent extraction;purification
2016-08-04
周丹丹(1983-),女,工程硕士研究生,工程师,研究方向:保健食品、食品研究与开发,E-mail:haizi_lcj@126.com。
*通讯作者:黄惠华(1959-),男,博士,教授,研究方向:农产品加工与储藏,食品科学与工程,天然活性产物的分离,食品生物技术,E-mail:401603106@qq.com。
广东省科技计划项目(2013B090600008)。
TS202.1
B
1002-0306(2017)05-0279-06
10.13386/j.issn1002-0306.2017.05.044
