非对称双席夫碱铜配合物催化环己烯氧化研究*
2017-06-01张杏梅卢荣程青青吕兴强
张杏梅,卢荣,程青青,吕兴强
(1.西安文理学院化学工程学院,陕西西安710065;2.西北大学化学工程学院,陕西西安710069)
科研与开发
非对称双席夫碱铜配合物催化环己烯氧化研究*
张杏梅1,卢荣2*,程青青2,吕兴强2
(1.西安文理学院化学工程学院,陕西西安710065;2.西北大学化学工程学院,陕西西安710069)
本文合成了一系列含有不同取代基的非对称双席夫碱铜配合物,采用1H NMR、13C NMR FI-IR对其结构进行表征;然后以该类配合物为催化剂、30%H2O2为氧源,研究了其在乙腈/NaHCO3混合溶液中对环己烯环氧化反应的催化活性及反应条件。结果表明:含有两个较强吸电子基团-Br的配合物5的催化活性较优,且反应温度为35℃,时间2h,n(H2O2):n(环己烯)=3时,环己烯的转化率为85.5%,环氧环己烷的选择性为37.9%。
非对称双席夫碱铜配合物;环己烯;双氧水;环氧环己烷
环氧环己烷是一种广泛应用于医药、农药、表面活性剂、香料和高等有机分子材料等领域的有机活性中间体[1,2]。以环己烯为原料合成环氧环己烷的方法主要有空气环氧化法[3,4]、无机过氧酸盐法[5]、有机过氧化物氧化法[6]和过氧化氢法等[7,8],其中过氧化氢法,以H2O2为氧化剂,反应过程中生成水,对环境无污染,成为一种备受关注的绿色生产环氧环己烷方法,该工艺的关键是催化剂,目前,常用的催化剂有:负载型金属配合物[9-12]以及过渡金属掺杂的分子筛和过渡金属席夫碱配合物[13-15],在众多的催化剂中,席夫碱过渡金属配合物由于制备方法简单,反应中具有较好的载氧能力、反应条件温和而受到关注。席夫碱金属配合物的催化性能受到配位的金属离子和席夫碱配体的影响,目前文献报道的主要锰、钴、铬和铜席夫碱配合物的催化烯烃环氧化反应,其中金属铜席夫碱配合物的催化活性最低(5%左右),同时选择性不高。为了提高铜席夫碱配合物的催化活性和选择性,本文合成了一系列不同取代基的非对称双席夫碱铜金属配合物,初步探讨了其催化性能。
1 实验部分
1.1 主要试剂与仪器
环己烯、乙腈、30%H2O2等,分析纯,天津市天力化学试剂有限公司;邻苯二胺、1-苯基-3-甲基-4-苯甲酰基-5-DH-吡唑酮(PMBP)、溴代香草醛、水杨醛、5-溴-水杨醛、3.5-二溴-水杨醛、香草醛,分析纯,Alfa Aesar。
INVOA-400 MHz核磁共振谱仪(美国Varian公司);EQVINOX-55型傅里叶变换红外光谱仪(德国布鲁克公司);GC2060型气相色谱仪(上海锐敏)。
1.2 催化剂的制备
将邻苯二胺(1mol,118.9g)滴加到15mL含有0.1mol PMBP(1mol,278.3g)的无水乙醇溶液中;加热至回流并搅拌6h后冷却至室温,过滤,收集溶液待其挥发,并将收集的滤饼重结晶后收集[16],得到席夫碱配体HL;然后称取席夫碱配体HL(1mmol,0.37g)于50mL的圆底烧瓶中,加入2mL的二氯甲烷溶剂;然后将Cu(Ac)2(1mmol,0.20g)溶解于2mL的乙醇中并将其加入到圆底烧瓶,再加入一定量的乙醇,搅拌回流30min;然后分别加入不同的芳香醛(水杨醛、香草醛、溴代香草醛、5-Br-水杨醛和3,5-二溴-水杨醛)到圆底烧瓶中,向圆底烧瓶中加入2mL的二氯甲烷,搅拌回流1h后,置于空气中挥发,过滤,用无水乙醇洗涤,真空干燥得非对称双席夫碱铜金属配合物(1-5)。收率分别是:51%、62%、65%、48%和75%。其合成路线见图1。

图1非对称双席夫碱铜配合物(1-5)的合成路线Fig.1Synthetic scheme of asymmetric bis-Schiff-base Cu complexes
1.3 环氧环己烷的合成
将配合物催化剂、单体环己烯、按照一定的配比加入乙腈/NaHCO3溶液中,升至设定反应温度后,加入一定量的H2O2,回流状态下反应,反应结束后冷却,用三氯甲烷萃取有机相。产物用气相色谱分析,并使用环氧环己烷分析纯标样定性,气相色谱的测定条件为:氢火焰离子化检测器,N2为载气,色谱柱(SE-30),柱箱温度100℃,汽化室温度230℃,检测器温度220℃。
2 结果与讨论
2.1 配体和催化剂的表征
2.1.1 配体HL的1H NMR表征1H NMR(400 MHz, d6-DMSO),δ:8.02(d,2H,-Ph),7.50(d,2H,-Ph), 7.43(m,3H,-Ph),7.39(m,2H,-Ph),7.15(s,H,-Ph), 7.13(s,H,-Ph),6.84(m,H,-Ph),6.65(d,H,-Ph), 6.28(d,H,-Ph),5.43(s,2H,-NH2),1.45(d,=H, -CH),1.05(s,=3H,=-CH3)。1H NM(400 MHz, d6-DMSO):δ=23.5,47.5,116.6,123.5,124.6,125.5,125.5, 126.3,127.3,128.1,128.2,128.4,128.5,128.9,131.0,134.5, 134.6,139.2,155.7,164.2,169.1。由核磁结果,1.45的-CH和164.2的C=N的吸收峰的存在,证明了目的产物HL的生成[17]。
2.1.2 配体HL和配合物(1~5)的红外表征(图2)
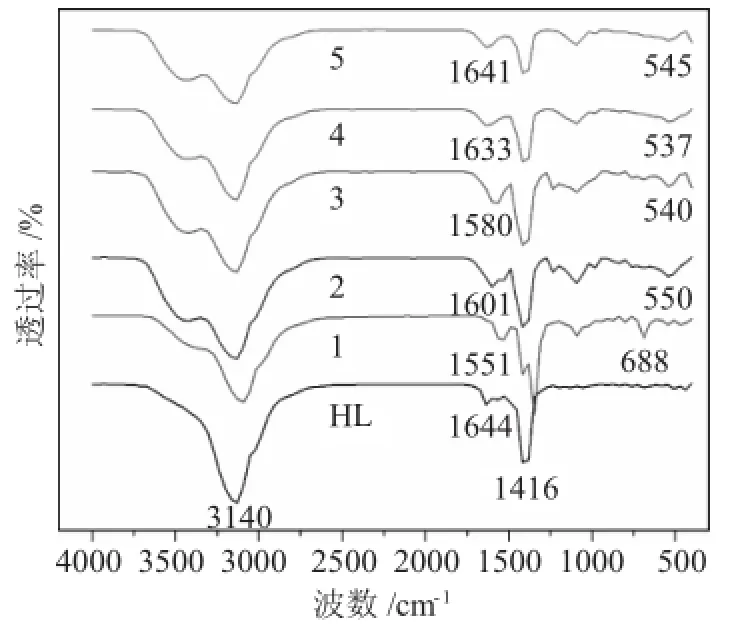
图2配体HL与配合物(1~5)的红外光谱Fig.2FT-IR of spectra of ligand HL and complexes(1~5)
由图2配体HL和配合物(1~5)谱图可知,配体HL的特征吸收峰:3140cm-1处为N-H的伸缩振动吸收,1587-1498cm-1为苯环的骨架振动,1644 cm-1处为C=O的特征吸收峰,831~651cm-1为苯环的面外变形振动,1416cm-1处出现了C=N的吸收峰,说明邻苯二胺和PMBP发生反应,得到了配体HL。当配体HL与金属离子配位后,配体中的C=O吸收峰从1635cm-1附近红移到1551~1641cm-1附近,这主要是由于C-N和C=N键中的O、N原子与金属离子配位后使C=O和C=N键的强度明显减弱,导致这些吸收峰向低频区发生偏移[17],同时在537~688cm-1附件出现了Cu-O的伸缩振动吸收峰,证明了配合物(1~5)的生成。
2.2 催化反应
2.2.1 不同配合物对环己烯环氧化反应的影响以乙腈/NaHCO3溶液为反应溶剂,催化剂用量为0.01mmol,环己烯为1mmol,30%H2O2用量为3mmol,反应温度35℃,反应时间2h,研究含有不同取代基的配合物(1~5)对环己烯氧化反应的影响,结果见表1。

表1 不同催化剂对环己烯环氧化反应的影响Tab.1Effect of catalyst 1~5 on epoxidation of cyclohexene
由表1可知,配合物中的推拉电子效应对环己烯的转化率和环氧环己烷的选择性有着较大的影响,当催化剂为配合物5时,环己烯的转化率为85.5%,环氧环己烷的选择性为37.9%,这主要是由于配合物5中存在着两个较强的吸电子基团-Br,降低了催化剂中心离子Cu2+的电子云密度,减小了环己烯进攻Cu2+的阻力,使得环己烯的转化率和环氧环己烷的选择性都较高;而配合物2和3中存在的推电子基团-CH3O使得配合物中心离子Cu2+的空间位阻增大和电子云密度增加,导致环己烯的转化率降低。因此,选择配合物5为催化剂进行反应条件优化。
2.2.2 反应温度对环己烯环氧化反应的影响以配合物5为催化剂,其他条件不变,研究反应温度的变化对环己烯氧化反应的影响,其结果见图3。

图3反应温度对环己烯环氧化反应的影响Fig.3Effect of reaction temperature on epoxidation of cyclohexene
由图3可知,在较低的温度(0℃)下,环己烯的转化率和环氧环己烷的选择性分别为30.3%和7.0%,当反应温度升高时,环己烯转化率和环氧环己烷的选择性升高,在35℃下反应2h,环己烯的转化率和环氧环己烷的选择性分别达到85.5%和37.9%,达到实验的最佳值,而后随着温度的升高,双氧水的分解速率加剧,使得反应趋于自由基氧化反应[14],并且分解生成的水会使得环氧环己烷发生水解开环并且高温会使得反应环己烯发生深度氧化使得环氧环己烷的选择性降低。
2.2.3 反应时间对环己烯环氧化反应的影响其他条件不变,考察反应时间的变化对环己烯氧化反应的影响。其结果见图4。

图4反应时间对环己烯环氧化反应的影响Fig.4Effect of reaction time on epoxidation of cyclohexene
由图4可知,环己烯的转化率随时间的延长而增加,时间延长至6h时转化率最高为99.6%,而后随时间的延长稍有降低;而环氧环己烷的选择性呈现相反的变化趋势:在反应初期,环氧环己烷的选择性较高(37.9%),随着时间的延长,环氧环己烷的水解开环和环己烯深度氧化等副反应加剧使得其选择性降低[15]。因此,适宜的反应时间为2h。
2.2.4 H2O2用量对环己烯环氧化反应的影响环己烯用量为0.01mmol,其他条件不变,改变H2O2的用量,研究n(H2O2):n(C6H12)比值的增加对环己烯氧化反应的影响,其结果见图5。

图5H2O2用量对环己烯环氧化反应的影响Fig.5Effect of the amount of H2O2on epoxidation of cyclohexene
由图5可知,环己烯的转化率和环氧环己烷的选择性随H2O2用量的增加而增大,当H2O2用量n(H2O2):n(C6H12)=3时,环己烯的转化率为85.5%,环氧环己烷的选择性为37.9%,继续增加H2O2的用量,转化率变化不明显,但环氧环己烷的选择性下降,这主要是由于以H2O2为氧源进行环己烯氧化时,环己烯烯丙位的氧化[13]主要是由于H2O2分解生成氧分子的作用,H2O2用量的增加,使得产生的自由基浓度增加,转化率增加,但过多的H2O2用量,使得环氧环己烷副反应加剧,选择性下降。因此,选择n(H2O2):n(C6H12)=3。
2.2.5 催化剂用量对环氧化反应的影响其他条件不变,考察配合物5用量的变化对环己烯环氧化反应的影响,其结果见图6。

图6催化剂用量对环己烯环氧化反应的影响Fig.6Effect of the amount of catalyst on epoxidation of cyclohexene
由图6可知,当配合物5的用量为0.01mmol时,环己烯的转化率为85.5%,环氧环己烷的选择性较高(37.9%)。当配合物5催化剂用量增加至0.02mmol,环己烯的转化率增加到96.9%,而环氧环己烷的选择性却降低为13.1%;这种现象可由配合物在环己烯环氧化反应的作用进行解释:当催化剂用量较少,不足以提供充分的催化活性中心,随着催化剂用量的增加,催化活性中心增多,环己烯的转化率和环氧环己烷选择性随之增高,但当催化剂用量过多时,副反应加剧而导致环氧环己烷的选择性降低。因此,较适宜的配合物5用量为0.01mmol。
3 结论
本文合成了一系列不对称双席夫碱铜金属配合物,采用1H NMR、13C NMR、FT-IR对其结构进行了表征;并以该类配合物为催化剂、30%H2O2为氧源,考察了乙腈/NaHCO3溶液中H2O2用量、反应温度、反应时间、催化剂用量和配合物取代基的不同对环己烯环氧化反应的影响,实验结果表明:两个吸电子基团-Br的引入使得配合物5的催化活性较优,其转化率最高可达96.9%,而环氧环己烷选择性较低(13.1%),其较优条件为:温度为35℃,时间2h,催化剂用量为0.01mmol,n(H2O2):n(C6H12)=3,此时其转化率为85.5%和环氧环己烷选择性为37.9%。
[1]孙小玲,陈萍.环己烯催化环氧化反应的研究新进展[J].化学世界,2009,(10):631-635.
[2]王张进,崔尚平,韩珺,等.1,2-环氧环己烷的制备与应用进展[J].化学推进剂与高分子材料,2014,(6):50-58.
[3]张萍,杨梅,吕效平.Salen Co(Ⅱ)配合物催化苯乙烯环氧化的研究[J].分子催化,2007,(1):48-53.
[4]晋春,郭永,薛万华,等.MCM-41介孔分子筛固载Schiff碱钴配合物催化烯烃环氧化[J].石油化工,2009,38(5):486-492.
[5]邹晓川,石开云,李俊,等.不同价态Mn(II,III,V)催化的烯烃环氧化反应研究进展[J].2016,36:1765-1778.
[6]Ayse A.,Ece T.S.,Zekeriya B..Investigation of catalytic activity of new Co(II)phthalocyanine complexes in cyclohexene oxidation usingdifferent type ofoxidants[J].Journal ofOrganometallic Chemistry,2013,745-746:18-24.
[7]王晓丽,吴功德,王芳,等.非均相Schiff碱铬(III)配合物催化环己烯环氧化性能的研究[J].催化学报,2011,32(12):1812-1821.
[8]杨丹红,崔丽凤,陈庆忠,等.双醛淀粉Schiff碱钴配合物催化环己烯环氧化反应[J].化学工程,2016,44(3):61-63.
[9]Nandi M.Selwyn F.M..Silica immobilized salicylaldimine Cu(II)and Co(II)complexes as catalysts in cyclohexene oxidation:A comparativestudyofsupporteffects[J].JournalofMolecularCatalysis A:Chemical,2009,312:70-77.
[10]Dinesh R.G.,Haresh D.N.,Digvijaysinh K.P.,et al.Tuningof the reaction parameters to optimize allylic oxidation of cyclohexene catalyzed by zeolite-Y entrapped transition metalcomplexes[J]. Journal ofMolecular Catalysis A:Chemical,2016,415:37-55.
[11]Dinesh R.G.,Haresh D.N.,Digvijaysinh K.P.,et al.Zeolite Y encaged Ru(III)and Fe(III)complexes for oxidation of styrene, cyclohexene,limonene,and pinene:An eye-catching impact of H2SO4on product selectivity[J].Journal of Molecular Catalysis A: Chemical,2017,426:223-237.
[12]刘成,王芳,刘贵,等.纳米级介孔羟基磷酸铁负载金催化剂的制备及其催化苯乙烯环氧化性能的研究[J].现代化工,2016, 36(10):87-91.
[13]张付利,汤昆.Schiff碱铁配合物催化环己烯环氧化[J].有机化学,2011,31(6):921-924.
[14]韩建萍,赵继全,陆敬国,等.丙氨酸席夫碱锰配合物催化环己烯的空气环氧化[J].2004,21(11):1136-1139.
[15]刘红,秦霞,任晓燕.Mn-水杨醛配合物的制备及其催化环烯烃环氧化的研究[J].湖北大学学报(自然科学版),2015,37(5):596-604.
[16]Chu Z.,Ding L.Q.in Ding,Lv X.Q.,A Chiral salen-typeSchiff Base Cu2+Complex for the Vinylic-type polymerization of norbornene[J].Journal of Inorganic and Organometallic Polymers and Materials,2012,20(2):235-241.
Study on epoxidation of cyclohexene catalyzed by asymmetric bis-Schiff base copper complexes*
ZHANG Xing-mei1,LU Rong2*,CHENG Qing-qing2,LV Xing-qiang2
(1.School of Chemical Engineering,Xi'an University,Xi'an 710065,China;2.School of Chemical Engineering,Northwest University,Xi'an 710069,China)
In this paper,a series of asymmetric bis-Schiff base copper complexes with were synthesized,characterized by1H NMR,13C NMR and FT-IR.Then,their catalytic activities and the reaction conditions for epoxidation of cyclohexene were studied with 30%hydrogen peroxide in the acetonitrile/sodium bicarbonate solution.The results showed that complex 5 with the involvement of 3,5-dibromo groups showed the better catalytic activity and the conversion rate of cyclohexene reached 85.5%,the selectivity of cyclohexene oxide was 37.9%under the reaction temperature 35℃,reaction time 2h and n(H2O2):n(cyclohexene)=3.
asymmetric bis-Schiff-base copper complexes;cyclohexene;hydrogen peroxide;cyclohexene oxide
O616
A
10.16247/j.cnki.23-1171/tq.20170501
2017-02-23
陕西省教育厅专项科研计划项目(12JK0577);西安市科技计划创新基金(CXY1531WL31,CXY1531WL21)
张杏梅(1975-),女,博士,讲师,主要从事席夫碱配合物的开发及应用研究。
