5株万古霉素敏感性减低耐甲氧西林金黄色葡萄球菌的graS基因及细胞超微结构分析
2017-06-01刘晓雷强翠欣赵建宏
李 静,刘晓雷,强翠欣,石 磊,赵建宏
(1.秦皇岛市海港医院 检验科,河北 秦皇岛 066000;2.河北医科大学第二医院 检验科 河北省临床检验中心,河北 石家庄 050000;3.华南理工大学轻工与食品学院,广东 广州 51064)
·论著·
5株万古霉素敏感性减低耐甲氧西林金黄色葡萄球菌的graS基因及细胞超微结构分析
李 静1,刘晓雷2,强翠欣2,石 磊3,赵建宏2
(1.秦皇岛市海港医院 检验科,河北 秦皇岛 066000;2.河北医科大学第二医院 检验科 河北省临床检验中心,河北 石家庄 050000;3.华南理工大学轻工与食品学院,广东 广州 51064)
目的 分析在防耐药变异浓度(mutant prevention concentration, MPC)测定过程中筛选出的对万古霉素敏感性减低的耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)在graS基因及细胞超微结构上的变化。 方法 利用Sau-PCR、脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)对筛选菌株进行分析。扩增graS基因,并利用变性梯度凝胶电泳 (denaturing gradient gel electrophoresis, DGGE)技术检测在该基因上是否存在突变。通过电子显微镜技术观察细胞壁结构改变。结果 万古霉素敏感性减低菌株经Sau-PCR和PFGE分型检测,证实部分筛选菌株电泳条带与原始菌株存在有差异,且电镜结果也显示筛选菌株细胞壁有所增厚。DGGE检测未发现在graS基因上存在突变点。结论 试验中的菌株万古霉素敏感性的减低可能不是由graS基因突变造成的,可能存在其他基因位点的突变,或可能存在另外的耐药机制。
抗菌药;葡萄球菌, 金黄色;耐药性,细菌
金黄色葡萄球菌是下呼吸道医院感染最常见的革兰阳性菌[1]。近年来万古霉素以及新型抗耐药金黄色葡萄球菌药物的合理应用问题越来越重要,尤其是如何减缓细菌对其耐药性的形成,防止耐药克隆的形成更加关键。
一直以来临床治疗耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)引起的严重感染主要依靠万古霉素[2]。但近年来,万古霉素中介(vancomycin-intermediate S.aureus,VISA)和耐药金黄色葡萄球菌(vancomycin-resistant S.aureus,VRSA)的报道逐渐增多[3-4]。近来有研究表明经过体外诱导,β-内酰胺类抗菌药能将MRSA诱导成为异质性万古霉素耐药金黄色葡萄球菌(Heterogeneous vancomycin resistant Stapylococcus aureus, hetero-VRSA, hVISA),使其对万古霉素的最低抑菌浓度(MIC)有明显升高[5]。
世界卫生组织发表的首份抗生素耐药重点病原体清单,其中就包括对新型抗生素迫切需求程度二级的MRSA、VISA和VRSA[6]。在我国对万古霉素敏感性降低的菌株广泛存在,尤其是hVISA,万古霉素的选择性压力可使万古霉素敏感性降低,最终可形成均质性的VISA株,导致万古霉素治疗失败[7]。防耐药变异浓度(mutant prevention concentration, MPC)和突变选择窗(mutant selection window, MSW)理论在临床实践中有重要的应用价值。MSW是指药物浓度从能抑制敏感菌株生长的MIC到抑制最不敏感一步耐药突变体生长的MPC这一浓度范围[8-9]。临床治疗时抗生素浓度选择落进了突变选择窗则有可能筛选出耐药突变株。
我们前期研究测定万古霉素对临床分离MRSA的MPC,受试菌经万古霉素MPC测定后筛选出的菌株,重新进行了MIC测定,结果由原来的MIC501μg/ml、 MIC902μg/ml,分别增至2μg/ml和4μg/ml。可见筛选出的耐药突变株的万古霉素敏感性减低。研究表明,金黄色葡萄球菌对万古霉素耐药的机制不是单一的。据文献报道,主要有以下几种观点[10-12]:细胞壁增厚、青霉素结合蛋白的改变、自溶能力下降、基因突变与转录水平变化如双组分信号系统突变等。但目前为止,其确切的机制尚不清楚。本研究试图通过比对筛选前后菌株在基因指纹谱上和细胞超微结构上的差异,在分子水平上初步探讨通过抗生素选择压力筛选出的万古霉素敏感性减低菌株药物敏感性下降的可能机制。
1 材料与方法
1.1 菌株来源 菌株来源于国家科技基础条件平台工作临床微生物项目河北省菌种库中储存的2012年12月至2015年3月河北省石家庄地区临床分离MRSA。前期研究对56株MRSA进行了万古霉素的MPC测定。对接近MPC的药物浓度筛选出的菌株接种于无药平板上,传代两次后,再接种于原筛选浓度的万古霉素平板上,确保筛选出的菌株为万古霉素敏感性减低菌株。共筛选出5株药物敏感性减低菌株。
1.2 试剂及仪器 Sau3AI限制性内切酶,Taq DNA 聚合酶,10×PCR缓冲液、低熔点琼脂糖、琼脂糖(PFGE级)等,为大连宝生物公司产品;引物SAUT(CCGCCGCGATCT)由Invitrogen公司合成。限制性内切酶SmaI(10 U/μl, HIMERx)。十二烷基肌氨酸钠和溶葡萄球菌酶(Lysostaphin,L9043-5MG)为Sigma公司产品;DNA分子量参照物DL2000(东盛生物科技有限公司产品);蛋白酶K购自TaKaRa公司,溶菌酶购自北京普博欣生物科技公司。MIT-P多点接种仪(日本佐久间制作所), DCode Universal Mutation Detection System(美国BIO-RAD公司)。PCR扩增仪:icycler PCR system (美国BIO-RAD公司)。凝胶成像仪:Gel Doc EQ 凝胶成像分析系统(美国BIO-RAD公司)。脉冲场电泳仪:美国Bio-Rad公司CHEF Mapper Pulsed Field型。
1.3 Sau-PCR 对万古霉素作用后筛选出的5株药物敏感性减低菌株及其原始菌株进行Sau-PCR分型检测。反应程序参考文献[13]。
PCR扩增体系包括SAUT引物5μl,dNTPs (10 mmol/L)0.5μl,10×缓冲液2.5μl,Taq DNA聚合酶0.1μl, Sau3AI酶切后的DNA(10 ng/μl)2μl,总反应体积25μl。取PCR产物2.5μl点样于 2%琼脂糖凝胶,电泳条件为100 V电压,电泳35分钟后溴乙锭(EB)染色。将胶块置于凝胶成像系统下照相并鉴定,观察万古霉素筛选出的菌株与原始菌株基因分型有无差异。
1.4 PFGE[14]取单个菌落到2 ml脑心浸液培养基中37 ℃振荡培养24小时。将菌液转移于离心管中,调菌液浓度600 nm处吸光度值为1.2~1.4。吸取上述菌液100μl于另一管中, 离心弃上清,沉淀重悬于150μl1×Tris-乙二胺四乙酸(EDTA),37 ℃水浴平衡10分钟。加入4μl溶葡球菌酶储存液[1 mg/ml加入20 mmol/L醋酸钠(pH4.5)中],将150μl2%低熔点琼脂糖胶加入到上述菌液中充分混匀,灌入胶条中。将上述混合液150μl每孔加入模具,4 ℃放置30分钟,使胶凝固。将栓切成2 mm大小的胶块,将胶栓转入含有2 ml EC裂解液[6 mmol/L Tris-HCl,1 mol/L NaCl,100 mmol/L EDTA,0.2%脱氧胆酸钠0.5% Brij-58,0.2%氯化钠,0.5%十二烷肌氨酸钠(pH7.6)]的离心管中37 ℃反应24小时。每株菌均取出胶块1条,加入300μl1×限制性缓冲液含3μlSmaI(10 U/μl),25 ℃酶切24小时。脉冲条件:14 ℃,30~500 kb,5~40秒,6 V/cm总时间为21小时。
1.5 变性梯度凝胶电泳技术(DGGE)和分子杂交 将上述Sau-PCR分型和PFGE分型有差异的两对菌株进行graS基因扩增。根据GenBank中已发布的基因序列并结合DGGE检测原理设计引物,设计3对引物扩增graS基因包括部分该基因上下游序列共1 151 bp。将一段长度为30~50碱基,富含 GC 的 DNA 附加到双链的一端以形成一个人工高温解链区。将graS基因分成3部分进行扩增。将野生菌株和其对应筛选菌株graS基因产物进行杂交反应。反应过程参照文献[15]。杂交后的DNA分子加入含有变性剂梯度的凝胶进行电泳。电泳条件:130 V电压,在60 ℃,1×Tris-乙酸-EDTA缓冲液环境中电泳9小时左右。电泳完毕后银染15分钟,再放入显影液中10分钟待胶变至茶色。凝胶成像分析系统白光照像。
1.6 电子显微镜检测 对上述两对菌株同时进行扫描电镜和透射电镜观察,受试菌培养物3 000 g离心15分钟,取沉淀加2.5%戊二醛前固定,切成小块,0.1 mol/L磷酸盐缓冲液漂洗3次,1%四氧化锇后固定,梯度酒精脱水后包埋固化,超薄切片机切片,铀铅染色,电镜检查。
2 结 果
2.1 万古霉素作用前后MRSA菌株的分子指纹特征分析 选取5对万古霉素作用前后的原始菌株及耐药突变株进行Sau-PCR和PFGE分型检测。可以看到条带的类型相差不大,但显示5号和16号菌株有个别细小条带的差别,有待进一步分析,见图1~2。
2.2 graS基因扩增及DGGE检测 将上述Sau-PCR分型和PFGE分型有差异的两对菌株5号和16号进行graS基因扩增,DGGE检测在graS基因上是否存在突变。按照DGGE原理如有突变点存在杂交后的DNA分子在电泳图上会出现4个条带。否则将会在电泳图上显示一个条带。我们实验中杂交分子在电泳图上显示出一个条带。试验结果未发现在该基因上存在突变点,见图3。
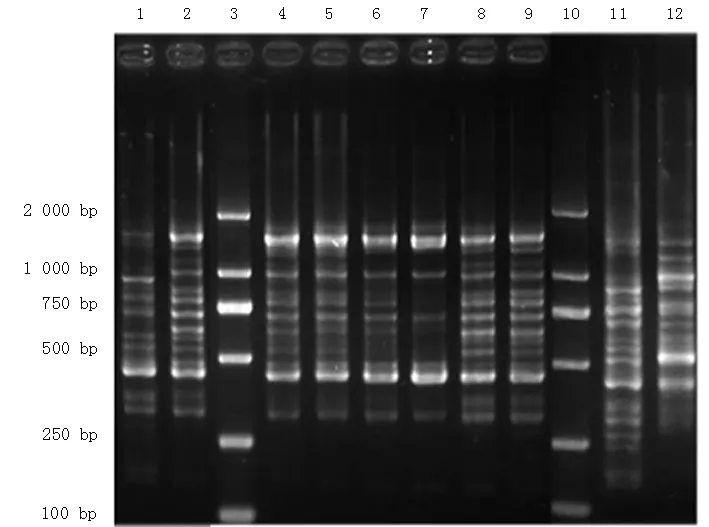
1:原始菌株5; 2:筛选菌株5′; 3、10:标准带; 4:原始菌株2; 5:筛选菌株2′; 6:原始菌株4; 7:筛选菌株4′; 8:原始菌株28; 9:筛选菌株28′; 11:原始菌株16; 12:筛选菌株 16′
图1 5对MRSA菌株的Sau-PCR分型结果
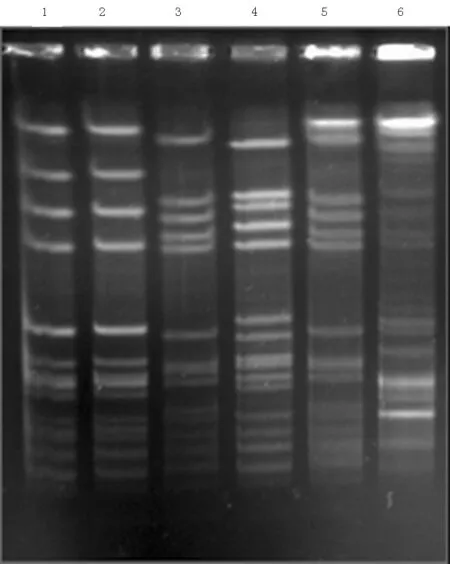
1:原始菌株4; 2:筛选菌株4′; 3:原始菌株5; 4:筛选菌株5′; 5:原始菌株16; 6:筛选菌株16′
图2 MRSA菌株的PFGE
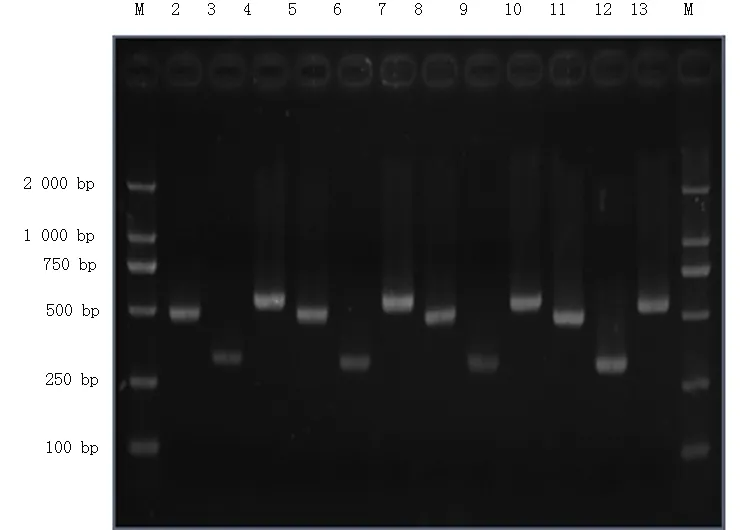
1:14为标准带; 2~4:原始菌株5; 5~7:筛选菌株5′; 8~10:原始菌株16; 11~13:筛选菌株16′。Gene graS-1: 467 bp; gene graS-2: 308 bp; gene graS-3: 538 bp
图3 MRSA菌株graS基因电泳
2.3 电镜下超微结构变化 将上述试验中Sau-PCR分型和PFGE分型有差异的两对菌株进行电镜观察(图4)。发现原始菌株细胞大小较均匀一致,细胞壁较薄,边缘整齐,细胞表面光滑。而在较高浓度万古霉素琼脂平板上筛选出的菌落,电镜观察其细胞形态多样,大小不一,且边缘不整,细胞表面粗糙,似覆有一层膜状物,更为明显的是细胞壁有所增厚。
3 讨 论
试验中,我们将前期MPC测定过程中在较高万古霉素浓度仍存活的MRSA菌落收集起来,与原始菌株同时进行Sau-PCR和PFGE分型检测。仔细观察可在指纹图上发现两种分型方法均证实5和16号菌株在筛选前后有基因分型条带上差异。在VISA形成过程中可出现 SCCmec基因丢失,国内外曾有过类似的报道[16-17],Bhateja等[18]同样在实验室诱导过程中发现mec A丢失的现象,所以推测在这两株较高万古霉素浓度仍存活的MRSA菌落可能存在类似基因片段丢失或突变现象。
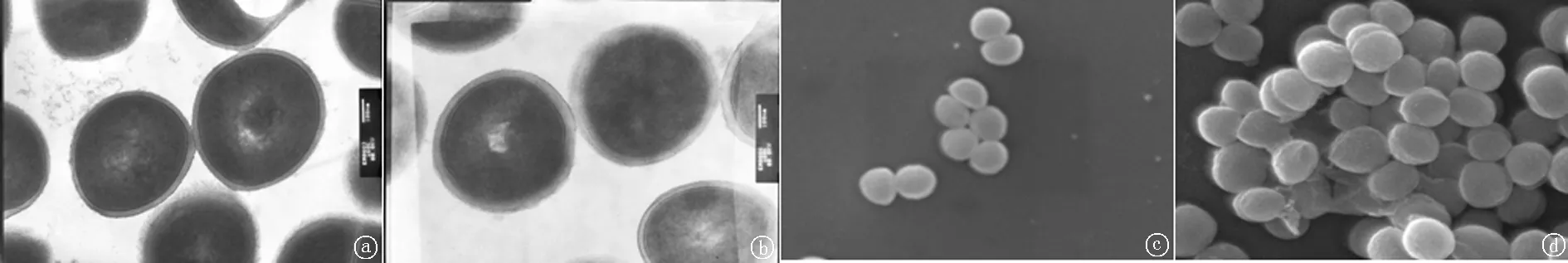
a:筛选前MRSA菌株5透射电镜图; b:筛选后MRSA菌株5′透射电镜图; c:筛选前MRSA菌株5扫描电镜图; d:筛选后MRSA菌株5′扫描电镜图
图4 MRSA菌株的扫描电镜和透射电镜观察
DGGE是一种能检测小分子片段或点突变的分子技术,具有灵敏度高,成本低的特点。当野生菌和突变菌的分子片段同时在同一凝胶上电泳时,按照DGGE原理如有突变点存在,杂交后的DNA分子在电泳图上会出现4个条带。否则将会在电泳图上显示1个条带。因此,我们试图利用DGGE技术检测在graS基因上是否存在突变。
根据澳大利亚学者Howden等[19-20]通过对万古霉素中介的菌株研究,发现了双组分调节感受基因graS基因的突变,并证明该基因的突变与万古霉素耐药表型变化直接相关。我们参考Howden等[19]的研究设计了graS基因的扩增引物,试图通过DGGE检测在graS基因上是否存在突变。试验结果未发现在该基因上存在突变点。提示试验中筛选出的耐药突变株,万古霉素敏感性的减低可能不是由graS基因突变造成的,可能存在有其他基因位点的突变,或另外的耐药机制仍待进一步研究。随着基因测序技术的不断进步,成本逐渐降低,我们将通过基因测序技术重复graS基因检测,并进一步探讨其他基因位点的突变。
同时通过扫描电镜和透射电镜比较它们细胞超微结构上的差异。发现在较高浓度万古霉素琼脂平板上筛选出的菌落,其细胞形态多样,大小不一,且边缘不整,细胞表面粗糙,似覆有一层膜状物。而更为明显的是细胞壁有所增厚,这可能与细菌对万古霉素敏感性减低有关。
[1] 王悦,史利克,张鲁涛,等. 医院获得性下呼吸道感染病原菌分布及耐药性分析[J].临床荟萃,2015,30(11):1269-1272.
[2] 赵建宏,秦小霞,李静.金黄色葡萄球菌临床分离株对万古霉素敏感性的监测[J]. 临床荟萃,2009,24(1):33-36.
[3] Howden BP,Davies JK,Johnson PDR,et al.Reduced Vancom ycin susceptibility in Staphylococcus aureus,including vancomycin-intermediate and heterogeneous vancomycin-intermediate strains:resistance mechanisms,laboratory detection and clinical implications[J].Clin Microbiol Rev,2010,23(1):99-139.
[4] Friaes A,Resina C,Manuel V,et al.Epidemiological survey of the first case of vancomycin--resistant Staphylococcu saureus infection in Europe[J].EpidemiolInfect,2015,143(4):745-748.
[5] 刘明涛,董春花,郭洪萍,等.β-内酰胺类抗菌药物诱导异质性万古霉素中介金黄色葡萄球菌及其药敏试验研究[J].中华医院感染学杂志,2017,27(3):481-483.
[6] Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. [EB/OL]. [2017-2-25].http://www.who.int/medicines/publications/global-priority-list-antibiotic-resistant-bacteria/en/.
[7] 蔡淑梅,朱海平,乔秀梅,等. 万古霉素琼脂平板对异质性万古霉素 中介金黄色葡萄球菌筛查价值Meta分析[J]. 中国抗生素杂志,2015,40(3):213-216.
[8] 李静, 时东彦, 赵建宏.抗菌药物耐药突变选择窗的研究进展[J].临床荟萃,2010,25(2):164-166.
[9] Zhao X, Drlica K. Restricting the selection of antibiotic resistant mutant bacteria: measurement and potential use of the mutant selection window[J]. J Infect Dis, 2002,185(4):561-565.
[10] 程欣,李晓鸥,刘晓峰,等. 耐甲氧西林金黄色葡萄球菌及其对万古霉素耐药的研究进展[J]. 中国实验诊断学,2016,20(10):1785-1787.
[11] Sun H, Yang Y, Xue T, et al. Modulation of cell wall synthesis and susceptibility to vancomycin by the two-component system AirSR in Staphylococcus aureus NCTC8325[J]. BMC Microbiol, 2013,13: 286.
[12] Cameron DR, Ward DV, Kostoulias X, et al. Serine/threonine phosphatase Stp1 contributes to reduced susceptibility to vancomycin and virulence in Staphylococcus aureus[J]. J Infect Dis, 2012,205(11): 1677-1687.
[13] Yan H, Shi L, Alam MJ, et al.Usefulness of Sau-PCR for molecular epidemiology of nosocomial outbreaks due to Burkholderia cepacia which occurred in a local hospital in Guangzhou,China[J].Microbiol Immol,2008,52(5):283-286.
[14] McDougal LK, Steward CD, Killgore GE, et al.Pulsed-field gel electrophoresis typing of oxacillin-resistant Staphylococcus aureus isolates from the United States: establishing a National Database[J]. J Clin Microbiol,2003,41(11):5113-5120.
[15] McCammon MT, Gillette JS, Thomas DP,et al.Detection of rpoB mutations associated with rifampin resistance in Mycobacterium tuberculosis using denaturing gradient gel electrophoresis[J].Antimicrob Agents Chemother,2005,49(6):2200-2209.
[16] Poston SM,Glancey GR,Wyatt JE,et al. Co-elimination of mec and spa genes in Staphylococcus aureus and the effect of agr and protein A production on bacterial adherence to cell monolayers[J]. J Med Microbiol, 1993,39(6):422-428.
[17] 张琴.体外万古霉素中介耐药金黄色葡萄球菌演变过程及分子机制研究[D].重庆:重庆医科大学,2014.
[18] Bhateja P,Purnapatre K,Dube S,et al.Characterisation of laboratory-generated vancomycin intermediate resistant Staphylococcus aureus strains[J]. Int J Antimicrob Agents,2006, 27(3):201-211.
[19] Howden BP, Stinear TP, Allen DL, et al. Genomic analysis reveals a point mutation in the two-component sensor gene graS that leads to intermediate vancomycin resistance in clinical Staphylococcus aureus[J]. Antimicrob Agents Chemother, 2008,52(10):3755-3762.
[20] Howden BP, McEvoy CR, Allen DL, et al. Evolution of multidrug resistance during Staphylococcus aureus infection involves mutation of the essential two component regulator WalKR[J]. PLoS Pathog,2011,7(11): e1002359.
graS gene and cell ultrastructure analysis of five methicillin-resistant Staphylococcus aureus with reduced susceptibility to vancomycin
Li Jing1, Liu Xiaolei2,Qiang Cuixin2, Shi Lei3, Zhao Jianhong2
1.Department of Laboratory Medicine,Qinhuangdao Haigang Hospital, Qinhuangdao 066000, China;2.Department of Laboratory Medicine, the Second Hospital of Hebei Medical University,Hebei Provincial Center for Clinical Laboratory, Shijiazhuang 050000, China; 3.College of Light Industry and Food Sciences,South China University of Technology, Guangzhou 510640,China
Zhao Jianhong,Email:zhaojh_2002@yahoo.com
Objective The methicillin-resistant Staphylococcus aureus (MRSA) with reduced susceptibility to vancomycin which were selected during mutant prevention concentration(MPC) determination were characterized to compare the changes in the graS gene and cell ultrastructure.Methods The strains selected were characterized by pulsed-field gel electrophoresis (PFGE) and Sau-PCR assay. The graS gene was detected by polymerase chain reaction method; Denaturing gradient gel electrophoresis (DGGE) was used to probe for mutations in the graS gene. The electron microscopy was used to compare the differences on cell wall.Results Compared with the parental strains, some strains with reduced susceptibility to vancomycin had different DNA profiles by Sau-PCR assay and PFGE. Electron microscopy showed that the mutant strains had slightly thicker cell walls than those of the wild-type strains. DDGE was used to probe for mutations in the graS gene, but no different banding patterns were observed on the electrophoretogram spectrum. Conclusion The strains with reduced susceptibility to vancomycin were not caused by genetic mutations of graS, there may be mutations in genes other than the graS gene or existence of other resistant mechanisms.
anti-bacterial agents; Staphylococcus aureus;drug resistance,bacterial
国家科技基础条件平台工作重点项目(2005DKA21202-6);河北省卫生厅医学重点课题(08075);河北医科大学第二医院重点课题(2h0200805)
赵建宏,Email:zhaojh_2002@yahoo.com
R916.693
A
1004-583X(2017)05-0405-05
10.3969/j.issn.1004-583X.2017.05.007
2016-12-06 编辑:武峪峰
