熊果酸衍生物的合成及其抗菌活性评价
2017-06-01孟英才詹济华肖水平廖美芳张雨林
孟英才,詹济华,肖水平,谭 洋,廖美芳,张雨林,李 玲*,裴 刚*
(湖南中医药大学药学院,湖南 长沙 410208)
熊果酸衍生物的合成及其抗菌活性评价
孟英才,詹济华,肖水平,谭 洋,廖美芳,张雨林,李 玲*,裴 刚*
(湖南中医药大学药学院,湖南 长沙 410208)
目的 对熊果酸A环进行结构修饰,并研究其体外抗菌活性。方法 以熊果酸(1)为原料,合成A环不同的熊果酸衍生物2-13,并用大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和枯草杆菌这6种细菌对熊果酸衍生物进行体外抗菌活性筛选。结果 大部分熊果酸衍生物显示很强的抗菌活性,其中化合物7对金黄色葡萄球菌的MIC值为6.3μmol/L,化合物8和化合物9对藤黄微球菌的MIC值分别为12.5 μmol/L和6.3 μmol/L,化合物11对六个菌种的MIC值均为3.1 μmol/L,化合物12对大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌、表皮葡萄球菌的MIC值为3.1 μmol/L。结论 熊果酸A环化学结构修饰能够有效提高其抗菌活性,尤其是A环引入双键或环氧基,可为熊果酸抗菌衍生物的进一步研发提供依据。
熊果酸;衍生物;抗菌药;合成;抑制
近年来,细菌感染,尤其是耐药菌的出现,已经成为危害人们健康的重要因素之一[1]。引起细菌感染的因素多种多样,随着人口老龄化的出现、缺乏锻炼导致抵抗力下降、化疗患者的增多和艾滋病的流行等原因导致越来越多的人遭遇细菌感染,在发展中国家尤为严重[2]。由于人们的生活方式多种多样,导致细菌感染的途径也多。因此,寻找新的抗菌药物仍然是目前有效的对抗细菌感染的方法之一。
熊果酸(ursolic acid,UA)是一种α-香树脂醇型五环三萜类化合物,广泛分布于植物界[3]。研究发现UA具有较弱抗菌作用[4],可作为先导化合物,进行结构修饰来提高抗菌活性。据文献报道,UA母核可以进行结构改造的部位主要有C-3位、C-12位和C-28位[5-6]。而A环为UA产生活性的主要部位,许多研究均发现,在UA的A环上进行化学修饰,可以提高其抗菌活性[7]。本研究的目的是对UA的A环引入双键、羰基和羟基等基团,合成12个UA衍生物,通过常规光谱手段对其进行结构确证,并用大肠杆菌和铜绿假单胞菌这两种革兰氏阴性菌和金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和枯草杆菌这四种革兰氏阳性菌对UA衍生物进行抗菌活性评价。研究结果对以UA为先导化合物进行的抗菌药物研发提供了前期基础。UA衍生物的合成路线,见图1。
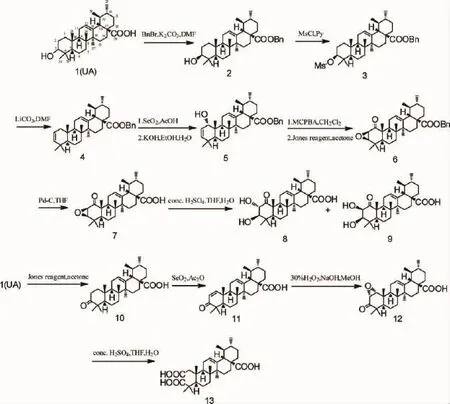
图1 熊果酸衍生物的合成路线
1 实验方法
1.1 仪器与试剂
X-4熔点仪(北京泰克仪器有限公司),温度计未校正;IR-Affinity-1红外光谱仪(日本岛津公司);Bruker-400M/600M超导核磁共振仪 (美国Bruker公司);Agilent 6540 UHD Q-TOF质谱仪 (美国Agilent公司);Autopol IV-T旋光仪(美国鲁道夫公司);ELx800酶标仪 (美国Biotek公司);AL-204型电子分析天平(梅特勒托利多仪器公司)。
UA(质量分数98%,西安万方生物科技有限公司); 环丙沙星 (Ciprofloxacin,Ci) 和头孢拉定(Cephradine,Ce)(Sigma公司);肉汤培养基(北京奥博星生物技术有限公司);其他试剂均为市售分析纯;大肠杆菌ATCC 25922、铜绿假单胞菌ATCC 27853、金黄色葡萄球菌ATCC 29213、表皮葡萄球菌ATCC 12228、藤黄微球菌CMCC(B)28001和枯草杆菌ATCC 6633由湖南中医药大学医学院提供。
1.2 化合物2-13的合成步骤
1.2.1 化合物2-4的合成[8]以UA为原料,苄基保护得到化合物2,再与甲基磺酰氯作用得到化合物3,最后回流形成双键得到化合物4。
化合物2,白色粉末状固体,收率:95.2%,mp:178~180℃;IR(KBr)σ:3 520,2 978,2 929,1712,1 458,1 373,725,690 cm-1;1H-NMR(400 MHz,CDCl3)δ:7.33(m,5H,Ar-H),5.23(t,1H,H-12), 5.12(d,1H,J=12.5 Hz,Bn-H1),4.99(d,1H,J=12.5 Hz, Bn-H2),2.28(d,1H,J=11.3 Hz,H-18),0.94(d,3H,J=5.9 Hz,CH3),0.86(d,3H,J=6.4 Hz,CH3),1.07~0.64(s,15H, 5×CH3);ESI-MS m/z:547.4[M+H]+。
化合物3,白色针状晶体,收率:89.0%,mp:133~135℃;IR(KBr)σ:2 970,2 929,1 726, 1454,1 350,1 172,912,875,752,696 cm-1;1HNMR (400 MHz,CDCl3)δ:7.33(m,5H,Ar-H), 5.23(t,1H,H-12),5.12(d,1H,J=12.5 Hz,Bn-H1), 4.99(d,1H,J=12.5 Hz,Bn-H2),3.01(s,3H,CH3S), 2.28(d,1H,J=11.3 Hz,H-18),0.94(d,3H,J=6.8 Hz,CH3),0.84(d,3H,J=5.4 Hz,CH3),1.06~0.63(s, 15 H,5×CH3);ESI-MS m/z:625.4[M+H]+。
化合物4,白色无定形固体,收率:88.2%,mp:104~106℃;IR(KBr)σ:2928,2868,1726,1458, 1373,1227,1143,889,743,696 cm-1;1H-NMR (400 MHz,CDCl3)δ:7.34(m,5H,Ar-H),5.28(t, 1H,H-12),5.12(d,1H,J=12.5 Hz,Bn-H1),4.99(d, 1H,J=12.5 Hz,Bn-H2),2.29(d,1H,J=11.2 Hz, H-18),0.94(d,3H,J=6.0 Hz,CH3),0.87(d,3H,J= 6.4 Hz,CH3),1.08~0.68(s,15H,5×CH3);ESIMS m/z:529.4[M+H]+。
1.2.2 化合物5的合成 于圆底烧瓶中加入3.20 g(6.06 mmol)化合物4,1.34 g(12.12 mmol)SeO2,73 mL AcOH,加热回流反应2 h。完毕后,冷却至室温,加入饱和氯化钠溶液,用乙酸乙酯萃取,有机层用碳酸氢钠溶液洗至中性,无水Na2SO4干燥,浓缩于圆底烧瓶中,加入0.68 g(12.12 mmol)KOH,73 mL EtOH,7.3mL H2O,搅拌溶解,回流反应1 h,冷却,加入饱和氯化钠溶液,用乙酸乙酯萃取,有机层水洗至中性,无水Na2SO4干燥,浓缩。快速硅胶柱层析(环己烷-乙酸乙酯,28∶1)得到化合物5,白色粉末状固体1.45 g,产率0.239,CHCl3);1H-NMR (400 MHz,CDCl3)δ:7.34 (m,5H,Ar-H),5.75(dd,1H,H-2),5.53(d,1H,J= 9.9 Hz,H-3),5.27(t,1H,H-12),5.12(d,1H,J= 12.5 Hz,Bn-H1),5.00(d,1H,J=12.5 Hz,Bn-H2), 3.56(d,1H,J=5.7 Hz,H-1),2.30(d,1H,J=11.2 Hz,H-18),0.94(d,3H,J=6.0 Hz,CH3),0.87(d, 3H,J=6.6 Hz,CH3),1.13~0.70(s,15 H,5×CH3); ESI-MS m/z:545.4[M+H]+。
1.2.3 化合物6的合成 于圆底烧瓶中加入1.20 g(2.20 mmol)化合物5,22 mL CH2Cl2,搅拌溶解,分批逐渐加入0.57 g(3.30 mmol)MCPBA,反应12 h,滤过,浓缩,加入丙酮110 mL,搅拌溶解,在0℃条件下,滴加1.03 mL(2.75 mmol)琼斯试剂,反应4 h(TLC监测反应终点)。完毕后,用1 mol/L NaOH水溶液调节pH至中性,减压除去溶剂,用乙酸乙酯萃取,有机层用饱和氯化钠洗涤,无水Na2SO4干燥,浓缩。快速硅胶柱层析(环己烷-乙酸乙酯,55∶2)得到化合物6,白色粉末状固体640 mg,产率52.3%,mp:(400 MHz,CDCl3)δ:7.33(m,5H,Ar-H),5.27(t, 1H,H-12),5.12(d,1H,J=12.4 Hz,Bn-H1),4.99(d, 1H,J=12.4 Hz,Bn-H2),3.25(d,1H,J=3.2 Hz,H-2),3.12(d,1H,J=3.2 Hz,H-3),2.29(d,1H,J=11.4 Hz,H-18),0.94(d,3H,J=5.8 Hz,CH3),0.88(d, 3H,J=6.4 Hz,CH3),1.16~0.66(s,15 H,5×CH3); ESI-MS m/z:559.3[M+H]+。
1.2.4 化合物7的合成 于圆底烧瓶中加入500 mg(0.90 mmol)化合物6,22 mL THF,100 mg的10% Pd-C,搅拌下通入氢气,反应24 h,过滤,减压除去溶剂,快速硅胶柱层析(环己烷-乙酸乙酯,23-2)得到化合物7,白色粉末状固体407 mg,产率96.7%,mp:970,2 927,2 866,1 722,1 693,1 458,1 381, 1 280,1 033 cm-1;1H-NMR(400 MHz,CDCl3)δ:5.25(br,1H,H-12),3.24(d,1H,J=3.2 Hz,H-2), 3.11(d,1H,J=3.2 Hz,H-3),2.19(d,1H,J=12.3 Hz,H-18),0.93(d,3H,J=6.0 Hz,CH3),0.87(d, 3H,J=6.3 Hz,CH3),1.15~0.79(s,15 H,5×CH3); ESI-MS m/z:469.3[M+H]+。
1.2.5 化合物8和9的合成 于圆底烧瓶中加入350 mg(0.75 mmol)化合物7,75 mL THF,7.5 mL的30%H2SO4,加热回流24 h(TLC监测反应终点)。完毕后,用1 mol/L NaOH水溶液调节pH至中性,减压除去溶剂,用乙酸乙酯萃取,有机层用饱和氯化钠洗涤,无水Na2SO4干燥,浓缩。快速硅胶柱层析(环己烷-乙酸乙酯,8∶1)得到化合物8,白色粉末状固体0.202,MeOH);1H-NMR (600 MHz,methanol-d4)δ:5.26(br,1H,H-12),4.61(d,1H,J=10.2 Hz,H-2), 2.97(d,1H,J=10.2 Hz,H-3),2.25(d,1H,J=11.0 Hz,H-18),1.38~0.94(s,21 H,7×CH3);ESI-MS m/z: 485.3[M-H]-。化合物9,白色粉末状固体21.8 mg,产率MeOH);1H-NMR(600 MHz,methanol-d4)δ:5.24(t, 1H,H-12),4.94(d,1H,J=3.5 Hz,H-2),3.71(d, 1H,J=3.5 Hz,H-3),2.24(d,1H,J=11.3 Hz,H-18),0.95(d,3H,J=6.5 Hz,CH3),1.37~0.93(s,21 H,7×CH3);ESI-MS m/z:485.3[M-H]-。
1.2.6 化合物 10的合成 于圆底烧瓶中加入5.00 g(10.96 mmol)UA,548 mL丙酮,搅拌溶解,0℃条件下,分批缓慢滴加5.13 mL(10.70 mmol)琼斯试剂,搅拌反应6 h(TLC监测反应终点),完毕后,用1 mol/L NaOH水溶液调节pH至中性,减压除去溶剂,用乙酸乙酯萃取,有机层用饱和氯化钠洗涤,无水Na2SO4干燥,浓缩。快速硅胶柱层析(环己烷-乙酸乙酯,14∶1)得到化合物10,白色粉末状固体4.73 g,产率95.0%,mp:249~251℃;1H-NMR (400 MHz,CDCl3)δ:5.26(t,1H,H-12),2.21(d, 1H,J=11.4 Hz,H-18),0.95(d,3H,J=5.9 Hz, CH3),0.87(d,3H,J=6.4 Hz,CH3),1.08~0.82(s,15 H,5×CH3);ESI-MS m/z:455.3[M+H]+。
1.2.7 化合物 11的合成 于圆底烧瓶中加入4.50 g(9.90 mmol)化合物10,100 mL醋酐,1.32 g(11.88 mmol)二氧化硒,加热回流1.5 h(TLC监测反应终点),冷却,用1 mol/L NaOH水溶液调节pH至中性,用乙酸乙酯萃取,有机层用饱和氯化钠洗涤,无水Na2SO4干燥,浓缩。快速硅胶柱层析(环己烷-乙酸乙酯,13∶1)得到化合物11,白色粉末状固体1.80 g,产率40.2%,mp:225~226℃;1H-NMR (400 MHz,CDCl3)δ:7.06(d,1H,J=10.1 Hz,H-2), 5.82(d,1H,J=10.1 Hz,H-1),5.30(t,1H,H-12), 2.23(d,1H,J=11.2 Hz,H-18),0.95(d,3H,J=6.2 Hz,CH3),0.87(d,3H,J=5.4 Hz,CH3),1.16~0.86(s, 15 H,5×CH3);ESI-MS m/z:453.3[M+H]+。
1.2.8 化合物 12的合成 于圆底烧瓶中加入1.50 g(3.32 mmol)化合物11,220 mL甲醇,搅拌溶解,在0℃条件下,缓慢滴加6 mL的10%NaOH。搅拌30 min,加入154 mL的30%H2O2,在室温下搅拌反应(TLC监测反应终点),完毕后,用1 mol/L的HCl调节pH至中性,减压除去溶解,用乙酸乙酯萃取,有机层用饱和氯化钠洗涤,无水Na2SO4干燥,浓缩。快速硅胶柱层析(环己烷-乙酸乙酯,12∶1)得到化合物12,白色粉末状固体1.25 g,产率80.4%,mp:(400 MHz,CDCl3)δ:5.30(t,1H,H-12),3.52(d,1H, J=4.6 Hz,H-2),3.38(d,1H,J=4.6 Hz,H-1),2.24 (d,1H,J=11.3 Hz,H-18),0.96(d,3H,J=6.7 Hz, CH3),0.88(d,3H,J=6.4 Hz,CH3),1.15~0.83(s,15 H,5×CH3);ESI-MS m/z:469.3[M+H]+。
1.2.9 化合物 13的合成 于圆底烧瓶中加入900 mg(1.92 mmol)化合物12,按照合成化合物8和9的方法制备化合物13,得到白色粉末状固体482 mg,产率50.0%,mp:264~266℃(文献值[9]:mp:(600 MHz,methanol-d4)δ:5.27(t,1H,H-12),2.59 (d,1H,J=17.7 Hz,H1b),2.42(d,1H,J=17.7 Hz, H1a),2.23(d,1H,J=11.2 Hz,H-18),0.88(d,3H, J=5.8 Hz,CH3),1.27~0.87(s,18 H,6×CH3);ESIMS m/z:503.3[M+H]+。
1.3 熊果酸衍生物的抗菌活性评价[7]
用比浊法对化合物的抗菌活性进行初筛,选取六种细菌为测定对象。将含有浓度为100 μM药物的细菌培养基加入96孔板中(100 μL/孔),每孔接种相应的细菌使最终细菌数为1×105CFU/mL,以环丙沙星[10]和头孢拉定[11]为阳性对照,同时设置阴性对照(细菌培养基和细菌)和正常对照(细菌培养基)。每个样品每种细菌设置6个复孔。用酶标仪测定620 nm吸光度值。在37℃的细菌培养箱中培养 48 h。完毕后,观察并记录菌落情况,震摇5 min,再次用酶标仪测定620 nm吸光度值。
MIC值测定:选取初筛抑制率大于90.0%的化合物进行 MIC测定。测定时将样品换成不同浓度,其他步骤和初筛一样,直接观察是否有菌落和培养基是否浑浊,并结合平板接种法判定最小抑菌浓度。
2 结果与讨论
UA衍生物的结构由IR,1H NMR,13C NMR和MS图谱确证,环氧基和羟基的构象由二维图谱确证。UA及其衍生物的抗菌活性初筛结果如图2显示,从总体来看,化合物对革兰氏阳性菌(金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和枯草杆菌)的抗菌活性大于革兰氏阴性菌 (大肠杆菌和铜绿假单胞菌)。化合物7、8、9、11和12对六个菌种都显示很强的抗菌活性。其中对UA及其衍生物的抗菌活性机理,有研究认为是革兰氏阴性菌对化合物有选择性渗透阻碍作用[12]。从化合物结构上面分析,C-28位游离羧基的抗菌活性较好,当C-28位上连接苄基时,抗菌活性都会不同程度的下降。化合物10由UA为原料,经过C-3上羟基氧化为羰基而得到,其抑制铜绿假单胞菌和藤黄微球菌的活性明显降低。化合物13由化合物12的A环开环而得到,但A环开环后对六种细菌的抑制活性明显下降,说明UA衍生物结构中的A环的存在对化合物的抗菌活性起到关键作用。
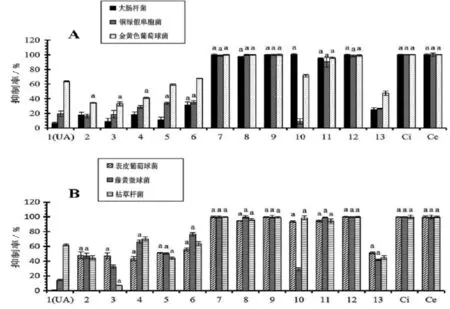
图2 UA及其衍生物对六种细菌的抑制作用(浓度为100 μmol/L)
初筛结果显示化合物7-12具有较好的抗菌活性。因此,对化合物7-12进行了MIC值测定,结果如表1显示。以环丙沙星和头孢拉定为阳性对照,化合物12(1,2-环氧-3-羰基化合物)对大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌和表皮葡萄球菌的MIC值均为3.1 μmol/L,同时对藤黄微球菌和枯草杆菌的MIC值均为6.3 μmol/L。相比之下,化合物7 (2,3-环氧-1-羰基化合物)对大肠杆菌、铜绿假单胞菌、表皮葡萄球菌、藤黄微球菌和枯草杆菌的MIC为12.5μmol/L,同时对金黄色葡萄球菌的MIC为6.3 μmol/L。说明拥有1,2-环氧-3-羰基部分的衍生物比拥有2,3-环氧-1-羰基部分的衍生物抗菌作用更强。拥有2,3-二羟基-1-羰基的化合物8和化合物9相比UA抗菌活性有明显的增强,如化合物8和化合物9对大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌、表皮葡萄球菌和枯草杆菌的MIC均为25 μmol/L,对藤黄微球菌的抗菌活性分别是 12.5 μmol/L和6.3μmol/L。化合物10对大肠杆菌和枯草杆菌的抗菌活性相比较弱,其MIC均为50 μmol/L。化合物11对六个菌种的抗菌活性最好,均为3.1 μmol/L,说明UA的A环上引入α,β-不饱和酮时能明显增加抗菌活性,可能由于α,β-不饱和酮部分对化合物渗透入细菌的贡献较大,但是其具体抗菌机制还需要进一步研究[13]。
本次实验结果显示,UA的A环引入羰基、多羟基、环氧部分或不饱和部分时,将明显提高抑制大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌、表皮葡萄球菌、藤黄微球菌和枯草杆菌生长的活性。尤其是A环引入α,β-不饱和酮的抗菌活性更强。并且,多数UA衍生物对革兰氏阳性菌的抗菌活性强于革兰氏阴性菌。这些工作可为以熊果酸为先导化合物进行抗菌药物的研发提供前期基础。

表1 UA及其衍生物对六种菌株的MIC值 (μmol/L)
[1]Walsh TR,Efthimiou J,Dréno B.Systematic review of antibiotic resistance in acne:an increasing topical and oral threat [J].Lancet Infectious Diseases,2016,16(3):23-33.
[2]Johnzon CF,Rönnberg E,Pejler G.The role of mast cells in bacterial infection[J].The American Journal of Pathology,2016, 186(1):4-14.
[3]Jyoti MA,Nam KW,Jang WS,et al.Antimycobacterial activity of methanolic plant extract of Artemisia capillaris containing ursolic acid and hydroquinone against Mycobacterium tuberculosis [J].Journal of Infection and Chemotherapy,2016,22(4):200-208.
[4]Wang RQ,Tu PF,Hattori M,et al.The cytotoxic activity of ursolic acid derivatives[J].European Journal of Medicinal Chemistry,2005,40(6):582-589.
[5]Dar BA,Lone AM,Shah WA,et al.Synthesis and screening of ursolic acid-benzylidine derivatives as potential anti-cancer agents[J].European Journal of Medicinal Chemistry,2016,111: 26-32.
[6]Gu W,Hao Y,Zhang G,et al.Synthesis,in vitro antimicrobial and cytotoxic activities of new carbazole derivatives of ursolic acid[J].Bioorganic&Medicinal Chemistry Letters,2015,25(3): 554-557.
[7]Huang L,Luo H,Li Q,et al.Pentacyclic triterpene derivatives possessing polyhydroxyl ring A inhibit Gram-positive bacteria growth by regulating metabolism and virulence genes expression [J].European Journal of Medicinal Chemistry,2015,95:64-75.
[8]Wang SS,Luo LJ,Gao ZG,et al.A convenient synthesis of 2β, 3α-dihydroxyurs-12-en-28-oic acid as a natural diastereoisomer of corosolic acid[J].Chinese Chemical Letters,2013,24:617-618.
[9]Wei Y,Ma CM,Hattori M.Synthesis and evaluation of A-seco type triterpenoids for anti-HIV-1protease activity [J].European Journal of Medicinal Chemistry,2009,44:4112-4120.
[10]Masadeh Mm,Alzoubi Kh,Khabour Of,et al.Ciprofloxacininduced antibacterial activity is attenuated by phosphodiesterase inhibitors[J].Current Therapeutic Research,2015,77:14-17.
[11]Lu C,Zhang N,Li J,et al.Colorimetric detection of cephradine in pharmaceutical formulations via fluorosurfactant-capped gold nanoparticles[J].Talanta,2010,81:698-702.
[12]Kurek A,Grudniak Am,Szwed M,et al.Oleanolic acid and ursolic acid affect peptidoglycan metabolism in Listeria monocytogenes[J].Antonie van Leeuwenhoek,2010,97:61-68.
[13]Nikaido H,Vaara M.Molecular basis of bacterial outer membrane permeability[J].Microbiological Reviews,1985,49:51.
(本文编辑 苏 维)
Synthesis and Antibacterial Evaluation of Ursolic Acid Derivatives
MENG Yingcai,ZHAN Jihua,XIAO Shuiping,TAN Yang,LIAO Meifang,ZHANG Yulin,LI Ling*,PEI Gang* (Pharmacy School,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
Objective To synthesize ursolic acid (UA)derivatives and investigate its antibacterial activities.Methods UA(1) as the starting material,UA derivatives (2-13)were modified by functional groups in ring A and its antibacterial activities were evaluated by Escherichia coli (E.coli),Pseudomonas aeruginosa (P.aeruginosa),Staphylococcus aureus (S.aureus), Staphylococcus epidermidis(S.epidermidis),Micrococcus luteus(M.luteus)and Bacillus subtilis(B.subtilis).Results Most of UA derivatives displayed potent antibacterial activity,such as compound 7 against S.aureus with MIC of 6.3 μM,compound 8 and 9 against M.luteus with MICs of 12.5 μM and 6.3 μM,respectively,compound 11 against six bacteria strains with a same MIC of 3.1 μM,and compound 12 against E.coli,P.aeruginosa,S.aureus and S.epidermidis,with a same MIC of 3.1 μM.Conclusion All of the derivatives showed stronger antibacteral activities than UA in vitro,especially,when an epoxy or unsaturated moiety was introduced in ring A.It may be used for the future research on antibacterial agents from UA derivatives.
ursolic acid;derivatives;antibacterials;synthesis;inhibition
R284.3;R914.5
A
10.3969/j.issn.1674-070X.2017.05.008
2016-06-28
2015年湖南省研究生科研创新项目(CX2015B335);湖南省教育厅项目(15C1037);湖南省“十二五”重点学科中药学资助;湖南省高层次卫生人才“225”工程项目资助。
孟英才,男,硕士,研究方向:新药研究与开发。
*裴 刚,男,教授,博士研究生导师,E-mail:peigang@hotmail.com;*李 玲,女,副教授,硕士研究生导师,E-mail:zyll319@163.com。
本文引用:孟英才,詹济华,肖水平,谭 洋,廖美芳,张雨林,李 玲,裴 刚.熊果酸衍生物的合成及其抗菌活性评价[J].湖南中医药大学学报,2017,37(5):493-498.
