黄芩苷通过上调miR-126诱导乳腺癌细胞凋亡的机制研究
2017-06-01肖玉洁黄立中周思春
肖玉洁,王 婷,黄立中*,杨 珊,周思春
(1.湖南中医药大学中西医结合学院,湖南 长沙 410208;2.株洲市中心医院,湖南 株洲 412007)
黄芩苷通过上调miR-126诱导乳腺癌细胞凋亡的机制研究
肖玉洁1,王 婷2,黄立中1*,杨 珊1,周思春1
(1.湖南中医药大学中西医结合学院,湖南 长沙 410208;2.株洲市中心医院,湖南 株洲 412007)
目的 用黄芩苷干预人乳腺癌细胞株MDA-MB-231,观察黄芩苷对乳腺癌细胞增殖、凋亡的影响及作用机制。方法 用qRT-PCR检测miR-126的表达变化,Western-blot检测Bcl-2、Caspase-9、Caspase-3、p-p38和p53的表达,MTT法检测细胞增殖,流式细胞术检测细胞凋亡。结果 miR-126在乳腺癌MDA-MB-231细胞中的表达比正常乳腺细胞低,黄芩苷干预乳腺癌细胞后miR-126上调最为明显(P<0.05)。用miR-126 mimics、miR-126 inhibitors转染乳腺癌细胞,Western-blot显示黄芩苷及miR-126 mimics作用于人乳腺癌细胞后Bcl-2表达水平下降,Caspase-9和Caspase-3的裂解产物、p-p38、p53表达增加,差异有统计学意义 (P<0.05)。MTT法显示黄芩苷和miR-126均可抑制乳腺癌细胞的增殖,流式细胞术显示黄芩苷与miR-126 mimics促进癌细胞凋亡。结论 黄芩苷可以抑制乳腺癌细胞的增殖,促进其凋亡,其机制可能与通过上调miR-126调节凋亡相关基因有关。
乳腺癌;黄芩苷;miR-126;细胞凋亡
乳腺癌是最常见的女性恶性肿瘤,且发病率逐渐上升,其治疗除了传统的手术、放化疗、内分泌治疗及中医药治疗等手段外,基因治疗为新的发展方向[1-2]。microRNA正逐渐成为肿瘤诊断的指标,治疗的新靶点,它可以通过调控下游通路影响肿瘤的增殖、侵袭与转移[3-6],其中miRNA-126是抑瘤性兼转移抑制性的microRNA[7],但目前没有临床靶向药。导师黄立中教授为中西医结合肿瘤学专家,临床擅用黄芩治疗乳腺癌,疗效颇佳。黄芩苷(Baicalin,BAI)是黄芩的有效成分,抗肿瘤作用得到很多体内外试验的证实[8-10],但从microRNA角度进行探讨的研究很少。在前期试验中已经用miRNA芯片筛选出黄芩苷对乳腺癌细胞上调的4种miRNA:miR-126、miR-145、miR-100、let-7c[11]。本课题拟在前期试验基础上,通过转染miR-126 mimics、miR-126 inhibitors,体外观察黄芩苷对miR-126的调节作用,及促进乳腺癌细胞凋亡的机制,为乳腺癌的传统中医药与基因治疗的契合提供新思路及实验依据。
1 材料和方法
1.1 材料与试剂
人乳腺癌细胞株MDA-MB-231购自中南大学湘雅医学院中心实验室细胞库,正常乳腺细胞株Hs 578Bst购自上海拜力生物科技有限公司(均由美国标准生物制品收藏中心ATCC制备)。黄芩苷购自中国药品生物制品检定所,质量分数98.5%,产品批号:120608-201113。pMIR-REPORTTM质粒购于美国Ambion公司。兔抗人Caspase-9、Caspase-3、Bcl-2、p53、p-p38单克隆抗体,山羊抗兔二抗,上海研晶生化试剂有限公司。
1.2 主要仪器
二氧化碳培养箱(Heracell):德国Heraeus公司。倒置显微镜(XDS-1B):重庆光电仪器总公司。流式细胞仪(BD FACS Canto II):美国BD公司。凝胶成像分体系统(GBOX-HR):英国SYNGENE公司。PCR仪(2400 PCR system):Perkin Elmer公司。荧光定量PCR仪(CFX96TOUCH)美国BIO-RAD公司。
1.3 方法
1.3.1 细胞培养 乳腺癌细胞株MDA-MB-231及正常乳腺细胞株Hs 578Bst培养于DMEM培养基中(含10%小牛血清、青霉素100 U/mL和链霉素100 U/mL),37℃,100%湿度、5%CO2培养箱中培养,贴壁生长,每间隔3天更换培养液,0.25%胰蛋白酶消化传代。取对数生长期的细胞用于进一步的实验。
1.3.2 药物制备 将黄芩苷干粉充分溶解于二甲基亚砜(dimethyl sulfoxide,DMSO)中,配制成浓度为5 000 μmol/L的贮存液,避光,4℃保存备用。使用时用细胞培养液稀释成所需的浓度,DMSO的终浓度≤0.2%。
1.3.3 转染 MDA-MB-231细胞转染按说明书操作。分组:空白对照组(空白对照组中加入同浓度的二甲基亚砜溶液),黄芩苷组(根据前期试验结果加入 50 μmol/L的黄芩苷,miR-126组 (miR-126 mimics转染目的细胞),LNA组 (将锁核酸(Locked nucleic acid,LNA) 修 饰 乳 腺 癌 细胞),LNA-126组(LNA修饰miR-126 inhibitors,用于转染后干扰细胞内miR-126的表达)。
1.3.4 实时荧光定量PCR(qRT-PCR)检测miRNA(1)总RNA的提取:转染60 h后,按试剂盒说明提取各组细胞的总RNA。(2)逆转录:RNasin(40 U/μL)0.25 μL,MMLV逆转录酶(200 U/μL)0.5 μL,5× RT Buffer 4 μL,dNTP (10 mM)0.75 μL,DTT(1 mmol/L)2 μL,miR-RT primers(1 μmol/L)1.2 μL,总RNA1 μg,无酶水至20 μL。(3)PCR的引物的设计和合成:U6(内参)上下游引物序列:U6-FTGCGGGTG CTCGCTTCGGCAGC,U6-R GGTG TCGTGGAGTCGA CATTTG;miR-126引物序列:TCAAGAGCAATAAC GAAAAATGT;pre-miR-126上下游引物序列:pre-miR-126-FAACGTACTATGTGTCCGATCGC,pre-miR-126-RTCAACAGTATCACGATAGCTTA;miR-126 in hibitors引物序列:ACATTTTTCGTTATTGCTCTTGA;pre-miR-126 inhibitors上下游引物序列:pre-miR-126 inhibitors-FCAGCGCGTACCAAAAGTAATA,pre-miR-126 inhibitors-RGTACCGTGAGTAATAATGCGC。(4)PCR扩增:2×SYBR Mix10 μL,Taq DNA polymerase(5 U/μL)0.2 μL,MiR-PCR primers(5μmol/L)0.4 μL,miRNA RT产物 2.0 μL,灭菌蒸馏水7.4 μL。上机95°C,3 min;95°C,12 s;62°C,35 s,共35个循环。
1.3.5 Western blot法检测蛋白表达 (1)转染72 h后用细胞裂解液提取细胞蛋白质液。BCA法测蛋白浓度。(2)以SDS-PAGE电泳分离蛋白后,将蛋白转至硝酸纤维膜上。将硝酸纤维素膜与相应一抗反应 (除p53用1∶200稀释外,均1∶1 000稀释),4℃过夜,PBS洗膜,与二抗反应,室温孵育2 h,避光显色。分析p53、caspase-3、caspase-9、bcl-2、bax、p-p38,以GAPDH作为内参。凝胶图像分析:将胶片进行扫描或拍照,用FluorChenm Q蛋白印迹成像和定量分析系统(美国Alpha)分析目标条带和内参条带灰度值,目的蛋白相对表达量=目的蛋白的灰度值/内参GAPDH的灰度值。
1.3.6 MTT法检测细胞生长情况 MDA-MB-231细胞(1×104个/mL)接种于96孔培养板过夜培养;50 μmol/L黄芩苷作用于 MDA-MB-231细胞 72 h;加入20 μL MTT液37℃培养4 h;离心,弃去培养液,每孔加入 150 μL DMSO,将培养板低速振荡10 min;测定细胞生长情况;酶联免疫检测仪检测OD 490 nm处各孔的吸光值。细胞生存率(%)=OD药物组/ OD空白对照组×100%
1.3.7 流式细胞分析 Annexin V-FITC/PI双染色法检测乳腺癌细胞凋亡和细胞周期,具体操作步骤如下:MDA-MB-231细胞培养在6孔板直到70%–80%的融合,收集悬浮细胞 (1~5)×106/mL,1 500 r/min离心5 min,弃上清;4℃预冷的PBS洗细胞两次,1 500 r/min离心5 min,弃上清;加入400 μL 1× Binding Buffer重悬细胞;1 500 r/min离心5 min,弃上清,1 mL PBS液清洗细胞2次;加入5 μL Annexin V FITC,混匀后室温避光孵育15 min;加10 μL PI染色液 (50 μg/mL),混匀,室温避光30 min;流式细胞仪检测分析,并用ModFit LT 3.0软件确定细胞周期。
2 结果
2.1 黄芩苷对正常乳腺细胞和乳腺癌细胞中miRNA表达的影响
以正常乳腺Hs 578Bst细胞为对照,用Realtime PCR检测,发现miR-126、miR-145、miR-100、let-7c在乳腺癌MDA-MB-231细胞中的表达比正常乳腺细胞的低(P<0.05)(见表1),黄芩苷干预乳腺癌细胞后miR-126、miR-145、miR-100、let-7c的表达均上调,而以miR-126上调最为明显(见图1),提示miR-126可能作为抑癌miRNA参与乳腺癌的发生发展过程,黄芩苷可能通过上调miR-126起到抗乳腺癌作用。
表1 黄芩苷上调的miRNA在正常乳腺和乳腺癌细胞中的表达情况 (±s,n=3)
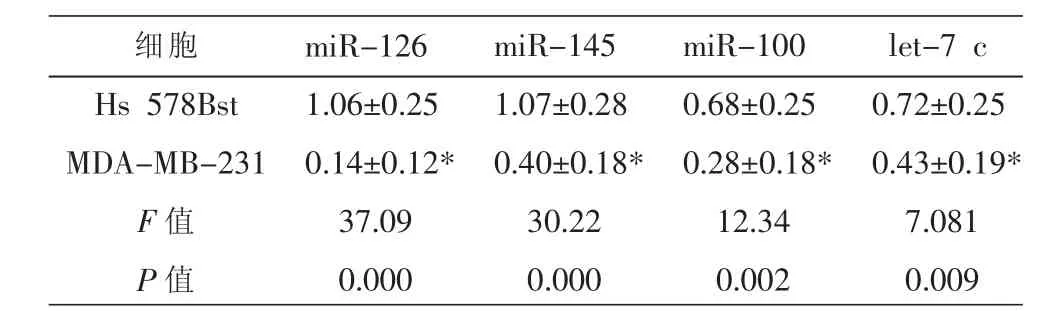
表1 黄芩苷上调的miRNA在正常乳腺和乳腺癌细胞中的表达情况 (±s,n=3)
注:与Hs 578Bst细胞比较*P<0.05。
细胞Hs 578Bst MDA-MB-231 F值P值miR-126 1.06±0.25 0.14±0.12* 37.09 0.000 miR-145 1.07±0.28 0.40±0.18* 30.22 0.000 miR-100 0.68±0.25 0.28±0.18* 12.34 0.002 let-7 c 0.72±0.25 0.43±0.19* 7.081 0.009
2.2 Western-blot反应结果
Western-blot反应显示黄芩苷及miR-126mimics作用于乳腺癌细胞72 h后观察到p-p38、p53、Caspase-9和Caspase-3的裂解产物表达增加,Bcl-2表达水平下降(见图1),均有统计学意义(见表2)。
表2 黄芩苷及miR-126对蛋白表达的影响 (±s,n=3)

表2 黄芩苷及miR-126对蛋白表达的影响 (±s,n=3)
注:与空白对照组比较*P<0.05。
组别空白对照组miR-126组黄芩苷组F值P值p53 0.99±0.17 1.19±0.21* 1.15±0.14* 4.162 0.038 Caspase-3 0.01±0.01 0.14±0.17* 0.11±0.14* 3.864 0.037 Caspase-9 0.00±0.01 0.18±0.25* 0.16±0.18* 3.345 0.022 Bcl-2 0.99±0.15 0.82±0.18* 0.87±0.11* 3.542 0.045 p-p38 1.01±0.16 1.35±0.24* 1.23±0.27* 7.146 0.041
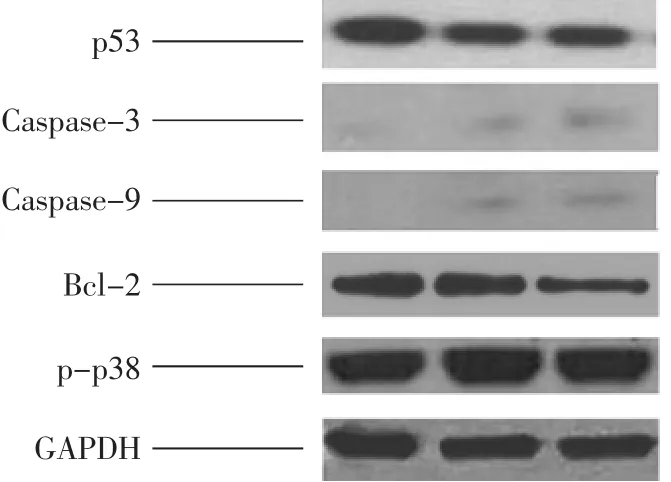
图1 MDA-MB-231细胞p53、Caspase-3、Caspase-9、Bcl-2和p-p38的蛋白表达
2.3 黄芩苷对乳腺癌细胞生存率及凋亡的的影响
MTT法显示,对于乳腺癌细胞MDA-MB-231,转染miR-126 mimics 72 h后细胞存活率较空白对照组显著下降,差异有统计学意义(P<0.05);黄芩苷作用后癌细胞的生存率较空白对照组明显下降,差异有统计学意义(P<0.05),见表3。
流式细胞仪检测结果显示,黄芩苷与miR-126mimics均可促进 MDA-MB-231细胞凋亡,miR-126组效果更明显,见表3。
表3 黄芩苷对乳腺癌细胞生存率及凋亡的影响 (±s,n=3)

表3 黄芩苷对乳腺癌细胞生存率及凋亡的影响 (±s,n=3)
注:与空白对照组比较*P<0.05。
组别空白对照组黄芩苷组miR-126组F值P值细胞生存率(%)95.91±15.93 78.61±12.70* 75.87±10.81* 3.836 0.015细胞凋亡率(% 0.04±0.02 1.98±1.58* 4.41±2.03* 4.526 0.008
3 讨论
乳腺癌是最常见的女性恶性肿瘤,侵袭转移导致肿瘤复发转移是患者的主要死因。其中三阴性乳腺癌(triplenegativebreastcancer,TNBC)没有内分泌及靶向治疗药物,侵袭力强,预后差,目前无标准治疗方案,需要寻找新的治疗策略。
miRNA-126可以通过网络式调控改变肿瘤微环境抑制肿瘤的转移,其下调促进乳腺癌的转移,导致不良预后[12]。miRNA-126,miR-17,miR-21等多个miRNA在乳腺癌中的表达及作用已经得到确定,对乳腺癌骨转移有诊断和治疗意义[13]。miR-126是对乳腺癌的诊断及治疗有重要意义的新靶点,但目前尚无针对miR-126的靶向药应用于临床。
黄芩苷的体内外试验显示有抗乳腺癌作用,但具体机制有待进一步研究。本实验选择高侵袭力的人三阴性乳腺癌细胞株MDA-MB-231,从miRNA-126途径探讨黄芩苷对乳腺癌细胞凋亡的影响。在前期体外实验通过不同浓度黄芩苷作用于乳腺癌细胞MDA-MB-231,免疫组化分析筛选出药物最低有效作用浓度50 μmol/L,运用miRNA芯片筛选受药物调控的差异miRNA。在本实验中用qRT-PCR验证,发现miR-126在乳腺癌MDA-MB-231细胞中的表达比正常乳腺细胞的低,黄芩苷干预乳腺癌细胞后miR-126明显上调。用miR-126 mimics转染乳腺癌 细 胞 ,Western-blot显 示 黄 芩 苷 及 miR-126 mimics作用于人乳腺癌细胞后引起凋亡相关的基因表达发生改变:抑制凋亡的Bcl-2表达水平下降;激活p38途径,进而激活Caspase-9,Caspase-9和Caspase-3的裂解产物表达水平上升;抑癌基因p53表达水平明显提高。MTT法显示 miR-126 mimics和黄芩苷均可抑制乳腺癌细胞的生长。流式细胞术检测提示黄芩苷与miR-126 mimics作用于乳腺癌细胞后,均可促进细胞凋亡,miR-126 mimics的作用更明显。
本研究提示miR-126可能作为抑癌miRNA参与乳腺癌的发生发展过程,黄芩苷可能通过上调miR-126诱导了促细胞凋亡相关蛋白的表达,并抑制抗凋亡相关蛋白的表达,促进癌细胞凋亡,阐释和丰富了黄芩苷的功效内涵,为黄芩苷治疗乳腺癌提供实验依据和科学参考,为中医药防治乳腺癌提供新靶点、新方法、新思路。但是microRNA与细胞凋亡的信号通路非常复杂,具体机制还有待进一步的体内、外试验进行深入探讨。
[1]Kim YS,Hwang KA,Go RE,et al.Gene therapy strategies using engineered stem cells fortreating gynecologic andbreast cancer patients(Review)[J].Oncol Rep,2015,33(5):2107-2112.
[2]Anaya-Ruiz M,Perez-Santos M.Innovation status of gene therapy for breast cancer[J].Asian Pac J Cancer Prev,2015,16(9): 4133-4136.
[3]Hou Y,Wang J,Wang X,et al.Appraising MicroRNA-155 as a Noninvasive Diagnostic Biomarker for Cancer Detection:A Meta-Analysis[J].Medicine(Baltimore),2016,95(2):e2450.
[4]He Y,Lin J,Ding Y,et al.A systematic study on dysregul at ed microRNAs in cervical cancer development[J].Int J Cancer, 2016,138(6):1312-1327.
[5]Hu L,Ai J,Long H,et al.Integrative microRNA and gene profiling data analysis reveals novel biomarkersand mechanisms for lung cancer[J].Oncotarget,2016,7(8):8441-8454.
[6]Yin Y,Shen C,Xie P,et al.Construction of an initial microRNA regulation network in breast invasive carcinoma by bioinformatics analysis[J].Breast,2016,26:1-10.
[7]Lu YY,Sweredoski MJ,Huss D,et al.Prometastatic GPCR CD97 is a direct target of tumor suppressor microRNA-126[J]. ACS Chem Biol,2014,9(2):334-338.
[8]Wang XF,Zhou QM,Du J,et al.Baicalin suppresses migration, invasion and metastasis of breast cancer via p38MAPK signaling pathway[J].Anticancer Agents Med Chem.,2013,13(6):923-931.
[9]Chung H,Choi HS,Seo EK,et al.Baicalin and baicalein inhibit transforming growth factor-beta1-mediated epithelial-mesenchymal transition in human breast epithelial cells[J].Biochem Biophys Res Commun,2015,458(3):707-713.
[10]王 婷,黄立中,肖玉洁,等.黄芩苷联合黄芩素诱导乳腺癌细胞凋亡的机制研究[J].湖南中医药大学学报,2014,34(5):23-27.
[11]王 婷.黄芩苷通过miR-126途径抑制乳腺癌机制的研究[D].长沙:湖南中医药大学,2014.
[12]Png KJ,Halberg N,Yoshida M,et al.A microRNA regulon that mediates endothelial recruitment and metastasis by cancer cells[J].Nature,2012,481(7380):190-194.
[13]Vimalraj S,Miranda PJ,Ramyakrishna B,et al.Regulation of breast cancer and bone metastasis by microRNAs[J].Dis Markers,2013,35(5):369-387.
(本文编辑 杨 瑛)
Mechanism of Baicalin on the Apoptosis of Breast Cancer Cells by Up-Regulating miR-126
XIAO Yujie1,WANG Ting2,HUANG Lizhong1*,YANG Shan1,ZHUO Sichun1
(1.College of Integrated Traditional Chinese and Western Medicine,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;2.Central Hospital of Zhuzhou,Zhuzhou,Hunan 412007,China)
Objective To observe the effect and mechanisim of baicalin on proliferation and apoptosis of breast cancer cell line MDA-MB-231.Methods The expression of miR-126 was detected by qRT-PCR,and the expression of Bcl-2,Caspase-9,Caspase-3,p-p38,p53 was deternined by Western-blot.The cell proliferation was determined by using MTT method and cell apoptosis was detected by flow cytometry.Results The expression of miR-126 in breast cancer MDA-MB-231 cells was lower than that in normal breast cells,and the most obvious increase in miR-126 regulation was the intervention of baicalin in breast cancer cells.MiR-126 mimics,miR-126 inhibitors were transfected into human breast cancer cell.The Western-blot showed that baicalin and the miR-126 mimics increased Bcl-2 expression,reduced Caspase-9 and Caspase-3, p-p38,p53 expressions in human breast cancer cells (P<0.05).The result of MTT method showed that baicalin and miR-126 mimics could inhibit the proliferation of breast cancer cells,flow cytometry showed that baicalin and miR-126 mimics could promote the apoptosis of cancer cells.Conclusion The baicalin could inhibit the proliferation of breast cancer cells,and promote the apoptosis of breast cancer cells.The mechanism may be associated with the regulation of apoptosis related genes by up-regulating miR-126.
breast cancer;baicalin;miR-126;apoptosis
R285.5;R737.9
A
10.3969/j.issn.1674-070X.2017.05.005
2016-11-29
湖南省自然科学基金(2015JJ6080);湖南省教育厅重点项目(15A139);湖南中医药大学青年教师科研基金课题(22)。
肖玉洁,女,讲师,研究方向:中西医结合肿瘤学研究。
*黄立中,男,教授,博士研究生导师,E-mail:hlz992002@163.com。
本文引用:肖玉洁,王 婷,黄立中,杨 珊,周思春.黄芩苷通过上调miR-126诱导乳腺癌细胞凋亡的机制研究[J].湖南中医药大学学报,2017,37(5): 481-484.
