杏鲍菇多糖的酶法提取及其保湿和抗氧化活性评价
2017-06-01吴龙月陈瑶向福付自建王普健何峰
吴龙月,陈瑶,向福,2*,付自建,王普健,何峰,2
(1.黄冈师范学院生命科学学院,湖北黄冈438000;2.大别山特色资源开发湖北省协同创新中心,湖北黄冈438000)
杏鲍菇多糖的酶法提取及其保湿和抗氧化活性评价
吴龙月1,陈瑶1,向福1,2*,付自建1,王普健1,何峰1,2
(1.黄冈师范学院生命科学学院,湖北黄冈438000;2.大别山特色资源开发湖北省协同创新中心,湖北黄冈438000)
利用纤维素酶提取杏鲍菇中多糖,基于单因素和正交试验优化提取工艺条件,并探讨了多糖提取物的保湿性和抗氧化活性。结果表明,酶法提取的最佳工艺条件为纤维素酶用量0.7%,料液比1∶15(g∶mL),酶解温度50℃,酶解时间120 min。在此条件下,杏鲍菇多糖的提取率为2.42%。同时,1%杏鲍菇多糖的保湿性在2 h内优于5%甘油,总抗氧化能力相当于VC的90.8%~96.7%,对羟基自由基清除能力可达到VC的82.2%,表明所提取的杏鲍菇多糖具有良好的保湿性和抗氧化活性。
杏鲍菇多糖;酶法提取;保湿性;抗氧化活性;羟基自由基清除能力

WU Longyue1,CHEN Yao1,XIANG Fu1,2*,FU Zijian1,WANG Pujian1,HE Feng1,2
(1.College of Life Sciences,Huanggang Normal University,Huanggang 438000,China; 2.Hubei Collaborative Innovation Center for the Characteristic Resources Exploitation of Dabie Mountains,Huanggang 438000,China)
杏鲍菇(Pleurotus eryngii)为侧耳科侧耳属食用菌,也叫刺芹侧耳,集食用、食疗、药用于一体,营养丰富,具有鲍鱼和杏仁香味,被誉为“平菇王”、“草原上的美味牛肝菌”[1]。杏鲍菇含有丰富的真菌多糖,是其主要活性成分[2]。现代研究表明,杏鲍菇多糖及其衍生物不仅具有抑菌、抗病毒、抗肿瘤、抗氧化、清除自由基等活性[2-7],同时还能增强免疫、调理肠胃以及防止动脉硬化[8-10],甚至还具有保湿功效[11],在医药食品、化妆美容等领域利用价值高,开发前景广。
常用多糖提取方法(如水提、碱提、酸提、醇提等)存在提取率低、耗时长或者易引起多糖降解、影响生物活性等问题[2,11]。酶能温和高效地降解生物大分子,酶法提取有利于杏鲍菇多糖活性成分的溶出,不破坏生物活性,且副产物少,实用安全。
近年来,从天然物质资源中获取兼具保湿和营养双重功能的天然保湿剂已逐渐引起人们的关注[11]。天然真菌多糖作为重要的保湿材料,研究其高效安全的提取工艺和抗氧化、保湿等功效活性,对科学利用杏鲍菇资源、深入开发高附加值产品具有现实意义和应用前景。
本研究采用酶法提取杏鲍菇多糖,通过单因素和正交设计试验优化提取工艺条件,并以维生素C(vitaminC,VC)为对照[12],评价其总抗氧化活性和羟基自由基清除能力;以甘油为对照[11],评价杏鲍菇多糖的保湿性能,以期为杏鲍菇在化妆美容领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
杏鲍菇子实体:市售,烘干,粉碎备用;葡萄糖标准品(分析纯):上海金橞生物科技有限公司;维生素C标准品(纯度≥99.99%):上海麦克林生化科技有限公司;苯酚(分析纯):国药集团化学试剂有限公司;甘油(分析纯):天津市天力化学试剂有限公司;乙醇(分析纯):上海山浦化工有限公司;氯仿(分析纯):天津市凯通化学试剂有限公司;正丁醇(分析纯):天津市大茂化学试剂厂;酸性纤维素酶(20 000 U/g):湖北帝鑫化工制造有限公司;总抗氧化试剂盒(批号20161117)、羟基自由基试剂盒(批号20161121):南京建成生物工程研究所。
1.2 仪器与设备
Varian Cary 100 Scan型紫外可见分光光度计:美国Varian公司;Ax-205METTLERTOLEDO型电子天平:瑞士梅特勒-托利多集团;DZKW-D-2型电热恒温水浴锅:北京西城区医疗器械厂;GL-21M型医用离心机:湖南平凡科技有限公司;GZX-9240MBE恒温干燥箱:上海博讯实业有限公司医疗设备厂;THZ-C型恒温振荡器:太仓市实验设备厂。
1.3 实验方法
1.3.1 葡萄糖标准曲线制备
根据参考文献[13-14]所述方法,精密称取10.00 mg葡萄糖标准品,加超纯水定容至100 mL,配制成0.1 mg/mL的葡萄糖标准品母液。精密吸取标准品母液0、0.5mL、1.0mL、1.5mL、2.0mL、2.5mL、3.0mL、3.5mL、4.0mL、4.5mL、5.0mL分别置于10 mL容量瓶,加超纯水定容,配制成质量浓度为0、5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL、25 μg/mL、30 μg/mL、35 μg/mL、40 μg/mL、45 μg/mL、50 μg/mL的葡萄糖标准溶液。准确吸取标准溶液2.0 mL于试管,先后加入5%苯酚溶液1 mL和浓硫酸5 mL,静置10 min后于常温下振荡10~20 min,静置2~3 h,以不加标准品溶液的试剂为空白,在波长490 nm处测定吸光度值。以葡萄糖质量浓度(C)为横坐标,吸光度值(A)为纵坐标,绘制葡萄糖标准曲线,得到标准回归方程为:A=0.015 6C+0.000 8,R2=0.999 5,表明葡萄糖质量浓度在5~50 μg/mL范围内与吸光度值线性关系良好。
1.3.2 单因素试验
平行称取3份杏鲍菇粉末10 g分别置于锥形瓶中,加入适量的纤维素酶,按照一定的料液比(g∶mL)加入不同体积的水,搅拌均匀,置于恒温振荡箱中酶解一段时间后放入沸水水浴锅中灭酶15 min,然后冷却到50~60℃左右抽滤,制得粗多糖溶液。采用Sevage法[15]对制得粗多糖溶液进行脱蛋白,取100 mL粗多糖溶液加入离心管中,并加入等体积的4∶1(V∶V)的氯仿和正丁醇,充分摇匀后以10 000 r/min转速离心10 min,取上清,去脂去蛋白两次,合并上清液。在上清液中加入4倍体积的无水乙醇沉淀,常温醇沉20 min,10 000 r/min离心10 min,取沉淀得多糖样品[11]。考察纤维素酶用量(0.5%、0.6%、0.7%、0.8%)、酶解时间(100 min、110 min、120 min、130 min)、料液比(1∶10、1∶15、1∶20、1∶25(g∶mL))、酶解温度(40℃、50℃、60℃、70℃)对杏鲍菇多糖提取率的影响。
1.3.3 杏鲍菇多糖换算因子测定及提取率的计算
根据文献方法[15],多糖样品在60℃干燥至质量恒定,准确称取10 mg,加适量水溶解后转移至100 mL容量瓶中定容,制得多糖储备液。精确吸取多糖储备液2.0 mL,按1.3.1方法处理后在波长490 nm处测吸光度值,由葡萄糖标准曲线回归方程计算多糖储备液中葡萄糖的质量浓度(ρ0),换算因子计算公式如下:

式中:f为换算因子;m0为多糖质量,μg;ρ0为多糖储备液中葡萄糖的质量浓度,μg/mL;V0为多糖储备液体积,mL;D0为多糖的稀释倍数。试验测得换算因子f=3.36。
将多糖样品用20 mL去离子水溶解,稀释250倍后再吸取2.0 mL,按1.3.1方法处理后在波长490 nm处测吸光度值,根据葡萄糖标准曲线回归方程计算其葡萄糖的质量浓度,多糖提取率计算公式如下:

式中:Y为多糖提取率,%;ρ为多糖样品液中葡萄糖的质量浓度,μg/mL;V为多糖样品液体积,mL;D为样品液的稀释倍数;f为换算因子,3.36;m为杏鲍菇样品的质量,μg。
1.3.4 正交设计试验
基于单因素试验结果,选取对杏鲍菇多糖提取率影响较显著的酶解时间、料液比和酶解温度3因素,进行正交试验设计优化多糖提取工艺条件,正交试验因素与水平如表1所示。

表1 多糖提取工艺优化正交试验优化因素与水平Table 1 Factors and levels of orthogonal experiments for polysaccharides extraction process optimization
1.3.5 保湿性能评价[11]
以甘油和去离子水为参照,采用体外法评价杏鲍菇多糖粗提物的保湿性能。将杏鲍菇多糖提取物和甘油分别配成1%和5%的水溶液,选用76 mm×26 mm相同规格的载玻片3片,分别在载玻片表面贴一层医用透气胶带,准确吸取杏鲍菇多糖溶液、甘油溶液、去离子水各200 μL,分别点样在透气胶带上,称取初始质量,然后在室温下放置一定时间(30 min、60 min、90 min、120 min)后称质量,失水率越低,则保湿性能越好。失水率计算公式如下:
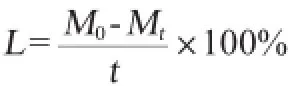
式中:L为失水率,%;M0为初始质量,g;Mt为一定时间后的载玻片质量,g;t为放置时间,min。
1.3.6 总抗氧化能力评价
分别配制质量浓度为10 g/L、20 g/L、30 g/L、40 g/L的杏鲍菇多糖溶液,并以相同质量浓度的VC作为阳性对照,根据总抗氧化试剂盒说明书操作后,将测试管、对照管样液在波长520 nm处测定吸光度值。在37℃条件下,每毫升样品每分钟使反应体系的吸光度值每增加0.01时,定义为一个总抗氧化能力单位(U),则总抗氧化能力计算公式如下:

式中:T为总抗氧能力,U/mL;As为测定管吸光度值;Ac为对照管吸光度值;Vt为反应液总体积,mL;Vs为取样量,mL;n为样品测试前稀释倍数。
1.3.7 羟基自由基清除能力评价
分别配制质量浓度为10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L的杏鲍菇多糖溶液,并以相同质量浓度的VC作为阳性对照,根据羟基自由基试剂盒说明书操作后,将测定管、空白管、对照管样液在波长536 nm处测定吸光度值。羟基自由基清除率计算公式如下:
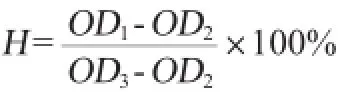
式中:H为羟基自由基清除率,%;OD1为测定管吸光度值;OD2为对照管吸光度值;OD3为空白管吸光度值。
1.3.8 统计分析
利用正交设计助手II v3.1和EXCEL 2003软件进行试验设计和数据分析,通过F值分析显著性。
2 结果与分析
2.1 单因素结果
2.1.1 纤维素酶用量对多糖提取率的影响
考察纤维素酶用量对杏鲍菇多糖提取率的影响,结果如图1所示。

图1 纤维素酶用量对杏鲍菇多糖提取率的影响Fig.1 Effect of cellulase addition on the extraction rate of P.eryngiipolysaccharide
由图1可知,随着纤维素酶量的增加,杏鲍菇多糖的提取率逐渐增大,当纤维素酶用量为0.7%时,杏鲍菇多糖提取率达到最高,为1.44%;继续增加酶用量至0.8%,杏鲍菇多糖提取率稍有下降,为1.41%,与1.44%无显著差异(P=0.54>0.05),即继续增加纤维素酶量,多糖提取率趋于稳定。这是由于酶量过多,酶分子已达饱和,与底物接触过剩,降低了反应速率,减少了多糖溶出[16]。因此,纤维素酶用量宜选择0.7%。
2.1.2 酶解时间对多糖提取率的影响
考察酶解时间对杏鲍菇多糖提取率的影响,结果如图2所示。
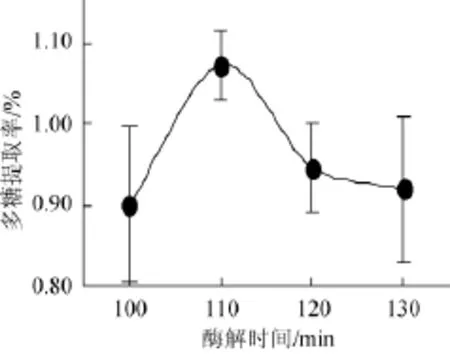
图2 酶解时间对杏鲍菇多糖提取率的影响Fig.2 Effect of hydrolysis time on the extraction rate of P.eryngiipolysaccharide
由图2可知,当酶解时间从100 min增加到110 min,杏鲍菇多糖提取率显著增加(P=0.04<0.05),且当酶解时间为110 min时,杏鲍菇多糖提取率达到峰值,为1.07%;继续延长酶解时间至120 min,提取率显著降低(P=0.03<0.05),延长至130 min时,提取率无显著变化(P=0.68>0.05),基本趋于稳定。酶解时间对杏鲍菇多糖的提取率影响显著,因此,选择酶解时间110 min为宜。
2.1.3 料液比对绿原酸提取率的影响
考察料液比对杏鲍菇多糖提取率的影响,结果如图3所示。
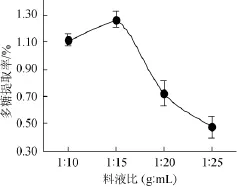
图3 料液比对杏鲍菇多糖提取率的影响Fig.3 Effect of the solid-liquid ratio on the extraction rate of P.eryngiipolysaccharide
由图3可知,料液比对杏鲍菇多糖提取率影响显著。料液比从1∶10(g∶mL)增加到1∶15(g∶mL)时,杏鲍菇多糖提取率增加到峰值,为1.27%,差异性显著(P=0.02<0.05);随着料液比增加至1∶20(g∶mL)时,多糖提取率下降至0.73%,差异极显著(P=0.001<0.01),下降趋势明显。因此,选择料液比1∶15(g∶mL)为宜。
2.1.4 酶解温度对杏鲍菇多糖提取率的影响
考察酶解温度对杏鲍菇多糖提取率的影响,结果如图4所示。
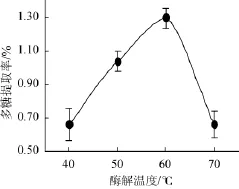
图4 酶解温度对杏鲍菇多糖提取率的影响Fig.4 Effect of hydrolysis temperature on the extraction rate of P.eryngiipolysaccharide
由图4可知,酶解温度<60℃时,多糖提取率随着温度升高逐渐增加,当温度升高到60℃时,杏鲍菇多糖提取率达到峰值,为1.30%,差异显著(P=0.006<0.01);继续升高酶解温度到70℃,多糖提取率则显著下降(P<0.001)。这是由于纤维素酶在60℃达到最适酶解温度,酶解活性最强,高于和低于该温度其酶解活性降低,从而导致多糖提取率下降。因此,选择酶解温度60℃为宜。
2.2 正交试验结果
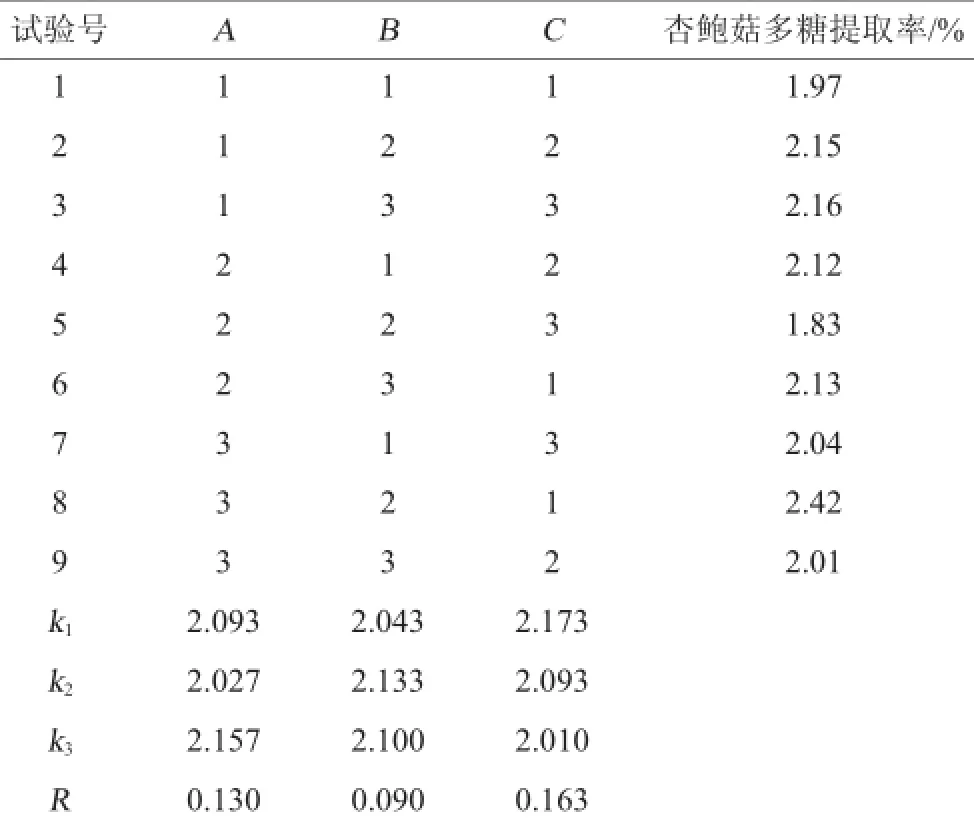
表2 杏鲍菇多糖提取工艺优化正交试验设计及结果Table 2 Design and results of orthogonal experiments for extraction process optimization ofP.eryngii polysaccharide
根据单因素试验结果,固定纤维素酶用量为0.7%,以杏鲍菇多糖提取率(Y)为评价指标,选取酶解时间(A)、料液比(B)和酶解温度(C)3个对杏鲍菇多糖提取率影响较显著的因素为变量值,设计L9(33)正交优化试验,试验设计及结果见表2,方差分析结果见表3。
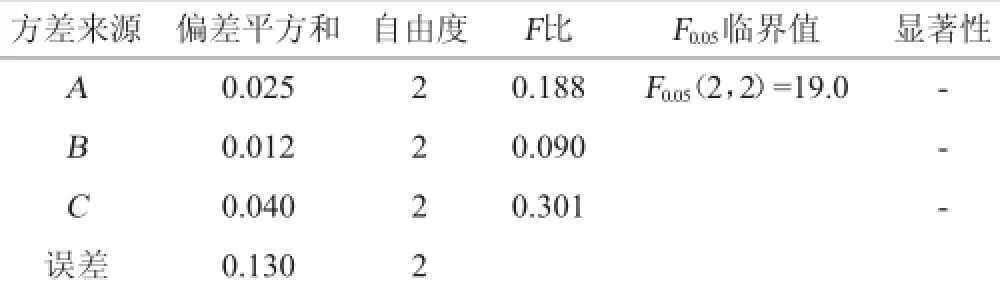
表3 正交试验结果方差分析Table 3 Variance analysis for orthogonal experiments results
由表2和表3结果可知,各因素对杏鲍菇多糖提取率的影响次序为:C>A>B,即酶解温度>酶解时间>料液比,但各因素的影响均不显著。获得最佳工艺条件为A3B2C1,即酶解时间120 min,料液比1∶15(g∶mL),酶解温度50℃。该组合在表2的正交设计试验中,多糖提取率最高,为2.42%。
2.3 保湿性评价
去离子水、1%杏鲍菇多糖溶液、5%甘油溶液在一定时间内的失水率变化情况如图5所示。由图5可知,随着放置时间延长,3种样品的失水率均呈总体下降趋势。从30min到120 min,去离子水的失水率由24%降至9.6%,各时间段失水率降低极显著(P<0.001);5%甘油溶液从30 min到90 min,失水率明显降低(P<0.05),从90 min到120 min则降低极显著(P<0.001);1%杏鲍菇多糖溶液从30 min到90 min,失水率降低不明显(P>0.05),从90 min到120 min则显著降低(P<0.01)。在120 min内,尽管3种样品的失水率曲线下降趋势基本,但失水率最高的一直是去离子水样品,其次是5%甘油溶液,1%杏鲍菇多糖溶液的失水率在每个检测时间点均最低,表明在120 min内1%杏鲍菇多糖的保湿性优于5%甘油。这与张志军等[11]的研究结果一致。

图5 三种样品的失水率Fig.5 Rate of water loss of three samples
2.4 抗氧化能力评价
以VC为阳性对照,测定质量浓度为10g/L、20g/L、30g/L、40 g/L杏鲍菇多糖样品的总抗氧化能力,结果如图6所示。
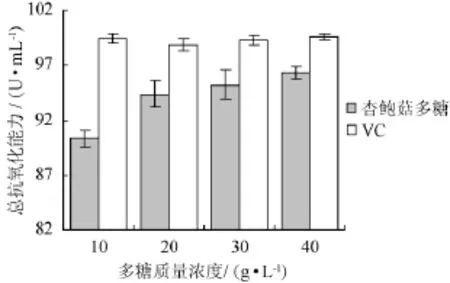
图6 杏鲍菇多糖和VC的总抗氧化能力的比较Fig.6 Comparison of total antioxidant activity ofP.eryngii polysaccharide and VC
在图6中的试验浓度范围内,不同质量浓度VC的总抗氧化能力无明显差异(P>0.05),基本稳定在99 U/mL左右;杏鲍菇多糖的总抗氧化能力则呈上升趋势:在10 g/L质量浓度时最低,为VC的90.8%,40 g/L时总抗氧化能力最强,达到96.35U/mL,相当于VC的96.7%。表明杏鲍菇多糖具有一定的抗氧化能力,为相同质量浓度VC的90.8%~96.7%。
2.5 杏鲍菇多糖清除羟基自由基能力评价
羟基自由基是在新陈代谢过程中产生的活泼自由基,毒性很大,作用于体内酯类、核酸、蛋白质等生物大分子,损伤细胞结构和功能,导致体内代谢紊乱而引发各种疾病[17]。检测质量浓度为10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L的杏鲍菇多糖和VC对羟基自由基清除能力,结果如图7所示。

图7 杏鲍菇多糖和和VC对羟基自由基清除能力的比较Fig.7 Comparison of hydroxyl radical scavenging activities of P.eryngiipolysaccharide and VC
由图7可知,各质量浓度下,杏鲍菇多糖的羟基自由基清除率均低于VC,且羟基自由基清除率均随着质量浓度的增加而升高,当质量浓度从30 g/L增加至40 g/L时,二者清除羟基自由基能力大幅增强;当质量浓度为60 g/L时,VC的羟基自由基清除率达到99.23%,杏鲍菇多糖则达到81.58%。表明杏鲍菇多糖具有一定的羟基自由基清除能力,可达到相同质量浓度VC的82.2%。
3 结论
本研究基于单因素和正交试验,建立了酶法提取杏鲍菇中多糖的工艺。获得杏鲍菇多糖提取的最佳工艺条件为:纤维素酶用量0.7%、酶解时间120 min、料液比1∶15(g∶mL)、酶解温度50℃。在此条件下,多糖提取率为2.42%。在120min内,1%杏鲍菇多糖的保湿性优于5%的甘油;总抗氧化能力为相同质量浓度VC的90.8%~96.7%,表明所提取杏鲍菇多糖具有良好的保湿性和抗氧化能力;羟基自由基清除率达到相同质量浓度VC的82.2%,具有良好的羟基自由基清除能力。因此,杏鲍菇多糖可作为一种兼具保湿和抗氧化双重功能的天然保湿剂,具有较好的应用前景。
[1]杜敏华,田龙.杏鲍菇碱溶性多糖的酶法提取及其结构的初步分析[J].食品工业科技,2007,28(6):113-116.
[2]马静,胡蔚蓝.杏鲍菇多糖提取及其抗氧化活性[J].农业工程,2012,2(10):25-28.
[3]迟桂荣,徐琳,吴继卫,等.杏鲍菇多糖的抗病毒、抗肿瘤研究[J].青岛农业大学学报:自然科学版,2006,23(3):174-176.
[4]LIU X,ZHOU B,LIN R,et al.Extraction and antioxidant activities of intracellular polysaccharide fromPleurotussp.mycelium[J].Int J Biol Macromol,2010,47(2):116-119.
[5]张俊会,王谦.杏鲍菇多糖的抗氧化活性研究[J].中国食用菌,2003,22(2):38-39.
[6]苗敬芝,董玉玮,唐仕荣.酶法提取杏鲍菇多糖及抗氧化活性研究[J].食品工业,2015(5):27-30.
[7]张丽,彭小列,张建锋,等.杏鲍菇多糖的提取及其抑菌作用[J].贵州农业科学,2010,38(9):90-92.
[8]张化朋,张静,刘阿娟,等.杏鲍菇营养成分及生物活性物质分析[J].营养学报,2013,35(3):307-309.
[9]荣瑞芬,李鸿玉,叶磊,等.杏鲍菇营养及功能成分分析测定[J].亚太传统医药,2007(5):85-87.
[10]车星星,许晶,李素玲,等.杏鲍菇多糖提取及其生物活性研究现状[J].山西农业科学,2014,42(5):533-535.
[11]张志军,李淑芳,薛照辉,等.杏鲍菇粗多糖的提取及其保湿性能研究[J].食用菌学报,2010,17(2):76-79.
[12]张俊生,陈莉华,朱士龙,等.节节草多糖的体外抗氧化活性[J].食品科学,2013,34(5):86-89.
[13]杨梅,王丽雅,庄跃飞,等.杏鲍菇多糖的提取及其分离的研究[J].中国食用菌,2005,24(4):38-39.
[14]郭金龙,陈有君,孙国琴,等.苯酚-硫酸法测定杏鲍菇多糖方法的研究[J].食品科学,2008,29(12):555-558.
[15]范文秀,王振河.杏鲍菇多糖的提取及含量测定[J].广东微量元素科学,2006,13(7):53-56.
[16]凡军民,谢春芹,贾君,等.纤维素酶法提取杏鲍菇多糖工艺优化[J].食品科技,2013,38(3):192-196.
[17]VECCHIA C,DECARLI A,SERAFINI M,et al.Dietary total antioxidant capacity and colorectal cancer:A large case-control study in Italy [J].Int J Cancer,2013,133(6):1447-1451.
R284.2
0254-5071(2017)05-0161-05
10.11882/j.issn.0254-5071.2017.05.034
2017-02-18
大学生创新培育项目(sgpx201601)
吴龙月(1995-),女,本科生,研究方向为天然产物提取。
*通讯作者:向福(1977-),男,教授,博士,研究方向为天然植物资源利用。
