俄罗斯野生蓝莓引种前后营养成分含量及抗氧化活性的比较分析
2017-06-01包怡红梁敏赵行常晨徐福成
包怡红,梁敏,赵行,常晨,徐福成
(1.东北林业大学林学院,黑龙江哈尔滨150040;2.黑河市中俄林业科技合作园区,黑龙江黑河164300)
俄罗斯野生蓝莓引种前后营养成分含量及抗氧化活性的比较分析
包怡红1,梁敏1,赵行1,常晨1,徐福成2
(1.东北林业大学林学院,黑龙江哈尔滨150040;2.黑河市中俄林业科技合作园区,黑龙江黑河164300)
为了研究引种栽培对于野生蓝莓营养成分及抗氧化活性的影响,选取俄罗斯阿穆尔州腾达市的野生蓝莓(蓝莓RU)和将该种野生蓝莓经引种栽培让其自然生长于中国黑河市二站乡的野生蓝莓(蓝莓HH)为原料,采用福林酚法、pH示差法、亚硝酸钠-硝酸银比色法和电感耦合等离子体-质谱法(ICP-MS)等方法分析比较了两种蓝莓的活性成分(多酚、花色苷、黄酮)、矿物质元素和糖酸含量,并对水提物和醇提物的抗氧化能力进行了比较。结果表明,蓝莓RU的可溶性固形物、还原糖、多酚含量高于蓝莓HH,但总酸、花色苷、黄酮含量低于蓝莓HH。二者的Ca、Mn、P、Zn、Cr元素含量存在显著差异(P<0.05),其他的矿物质元素差异不显著(P>0.05)。蓝莓RU水提物与醇提物的DPPH自由基清除率和Fe3+还原力高于蓝莓HH,但蓝莓HH的羟基自由基的清除率高于蓝莓RU。
野生蓝莓;引种前后;主要成分;抗氧化活性

BAO Yihong1,LIANG Min1,ZHAO Hang1,CHANG Chen1,XU Fucheng2
(1.School of Forestry,Northeast Forestry University,Harbin 150040,China;2.Forestry Science and Technology Cooperation Park Between China and Russia in Heihe City,Heihe 164300,China)
蓝莓又称蓝浆果、越橘,杜鹃花科越橘属植物,为多年生落叶或常绿灌木。蓝莓果实形状近似圆形,颜色呈蓝色,外被一层白色果粉[1-2]。蓝莓分布于北半球的亚热带和温带,全世界约有400种[3]。其不仅含有有机酸、糖类、多种矿物质元素、维生素,还含有多种活性成分(如多酚、花青素、黄酮等),因此蓝莓除了可以鲜食外,还可应用于制药和化妆品行业[1,4]。研究表明,蓝莓具有抗氧化[5]、抑菌[6]、减轻辐射诱发的肺伤害[7]、抑制癌细胞的生长和繁殖、改变酶活、调节基因的表达[8-9]、抗衰老[10]、增强人体免疫力[11]、保护视力[12]等作用。
目前,研究者对蓝莓活性成分的提取及功能活性进行了较多的研究。如孟宪军等[13]提取蓝莓多糖,发现其具有较强的抗氧化性。CHORFAN等[14]采用硅胶和C-18和DSC-SCX阳离子交换树脂对野生蓝莓的花青素进行固相萃取得到高纯度花青素,并进行自由基清除能力的研究。美国塔夫茨大学的研究人员[15]曾对60种不同果蔬的抗氧化能力进行了比较分析,结果表明,蓝莓的抗氧化能力位列前茅。
有医学研究表明[16],一些重大疾病(如肿瘤、癌症、动脉粥样硬化、糖尿病以及衰老等)均是由自由基氧化损伤所致,因此抗氧化活性具有很重要的研究意义。虽然近年来,广大研究者对蓝莓及其抗氧化性进行了大量研究,但是,同种蓝莓引种栽培前后于不同生长条件下的蓝莓之间成分及抗氧化活性的差异鲜有研究。本试验选取俄罗斯阿穆尔州腾达市的野生蓝莓(蓝莓RU)和将该野生蓝莓引种栽培于中国黑河二站乡的蓝莓(蓝莓HH)为原料,分析比较了二者的主要成分,水提物和醇提物的抗氧化活性,为蓝莓的引种栽培以及产品开发和利用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
俄罗斯野生蓝莓(蓝莓RU)产于俄罗斯阿穆尔州腾达市(东经124°43′,北纬55°09′);中国黑河二站乡蓝莓(蓝莓HH)引种栽培于黑河市二站乡(东经126°58′,北纬49°40′)并自然生长;福林酚、苯酚、芦丁、没食子酸(纯度≥98%)、铁氰化钾、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、三氯化铁、硫酸亚铁、硝酸银等均为国产分析纯。
1.2 仪器与设备
NexION 300X电感耦合等离子体-质谱仪(Inductively coupledplasma-massspectrometry,ICP-MS):铂金埃尔默企业管理有限公司;722型可见分光光度计:上海光谱仪器有限公司;VBR20手持式折光仪:上海医联控温仪器厂;EL20实验室pH计:梅特勒-托利多仪器(上海)有限公司;KQ-500DE数控超声波清洗器:昆山市超声仪器有限公司;天量系列LT1002E电子天平:常熟市天量仪器有限责任公司。
1.3 方法
1.3.1 蓝莓的预处理
挑选成熟度一致且无机械损伤和病虫害的蓝莓,冻存于-20℃的冰箱内,备用。
1.3.2 活性成分的提取
(1)花色苷提取液的制备
将蓝莓用研钵研磨破碎,按料液比1∶15(g∶mL)加入提取剂(体积分数70%乙醇溶液+0.1%浓盐酸),于60℃条件下水浴避光提取90 min,抽滤、浓缩得到花色苷提取液。
(2)黄酮提取液的制备
磨碎的蓝莓按料液比1∶15(g∶mL)加入体积分数65%乙醇溶液,60℃水浴提取2 h,抽滤,浓缩得到黄酮提取液。
(3)多酚提取液的制备
磨碎的蓝莓按料液比1∶25(g∶mL)加体积分数50%乙醇溶液,于40℃、超声功率为500W的条件下超声提取90min。经抽滤、浓缩得到多酚提取液。
1.3.3 测定方法
(1)糖酸指标
可溶性固形物:手持式折光仪[17];pH值:pH计[17];还原糖含量:参照GB/T 5009.7—2008《食品中还原糖的测定》的方法;总酸含量:参照GB/T 12456—2008《食品中总酸的测定》的方法;
(2)矿物质元素含量
参照陆美斌等[18]的方法采用电感耦合等离子体-质谱法,并在其基础上进行适当调整。具体方法:精确定量称取蓝莓果汁0.5g(精确到0.0001g)左右,置于聚四氟乙烯微波消解管中,加8 mL硝酸浸泡过夜,再加3 mL过氧化氢按微波程序消解,待消解完全后,冷却,在赶酸仪120℃条件下挥酸3 h,用超纯水转移定容至25 mL,同时进行空白试验。
(3)活性成分
花色苷含量:参照DENEV P等[19]采用pH示差法。
黄酮含量:采用亚硝酸钠-硝酸银比色法[20]。以芦丁为标准品,将不同质量浓度的芦丁在波长510 nm处测定吸光度值。以芦丁的质量浓度(x)为横坐标,以吸光度值(y)为纵坐标,绘制的标准曲线:y=1.479 1x+0.013 05,R2=0.999 1。利用标准曲线计算样品中黄酮含量。
多酚含量:采用福林酚法[21]。以没食子酸为标准品,以蒸馏水为空白,于波长765 nm处测定吸光度值。以没食子酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制没食子酸标准曲线:y=2.065 9x+0.031 37,R2=0.999 1。根据标准曲线回归方程计算样品中多酚的含量。
1.3.4 蓝莓水提物和醇提物抗氧化测定
(1)蓝莓水提物的制备
磨碎的蓝莓按料液比1∶20(g∶mL)加蒸馏水,80℃水浴提取2 h。抽滤得到滤液,为蓝莓水提物。
(2)蓝莓醇提物的制备
磨碎的蓝莓按料液比1∶20(g∶mL)加入体积分数60%乙醇溶液,50℃水浴提取2h。抽滤得到滤液,为蓝莓醇提物。
(3)DPPH自由基清除率的测定
取2mL不同质量浓度的蓝莓溶液加入2mL0.2mmol/L DPPH溶液,以溶剂为对照,立即摇匀,在室温条件下置于暗处30 min,在波长517 nm处测定吸光度值。取不同质量浓度的蓝莓提取液2 mL,与2 mL溶剂混合在波长517 nm处测吸光度值。取2 mL DPPH与2 mL溶剂混合在波长517nm处测吸光度值[22]。每个样品做3个平行,取平均值。根据下列公式进行DPPH自由基清除率计算:
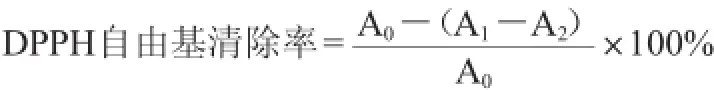
式中:A0为2mL DPPH与2 mL溶剂的吸光度值;A1为2 mL不同浓度蓝莓溶液与2 mL DPPH混合溶液的吸光度值;A2为2mL不同浓度的蓝莓溶液与2mL溶剂的吸光度值。
(4)羟基自由基清除率的测定
参照孟阿会[23]的方法并作一些调整。在试管内分别加入1 mL水杨酸乙醇溶液、1 mL FeSO4溶液、不同样品质量浓度的蓝莓提取液7 mL,加入1 mL H2O2启动反应。振荡摇匀,于37℃水浴锅中反应30 min,在波长510nm处测吸光度值,以蒸馏水代替双氧水作对照,以溶剂代替蓝莓提取液作空白组。每个样品做3个平行,取平均值。根据下列公式进行羟基自由基清除率计算:
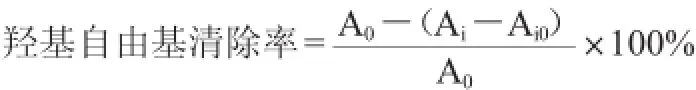
式中:A0为溶剂替代蓝莓提取液的吸光度值;Ai0为蒸馏水替代双氧水的吸光度值;Ai为不同浓度蓝莓提取液的吸光度值。
(5)铁离子还原力的测定
取2.5 mL不同样品质量浓度的蓝莓提取液,加2.0 mL磷酸缓冲液(pH6.6)和2.5 mL1%的铁氰化钾,50℃水浴30 min,反应结束迅速冷却,加入2.5 mL 10%的三氯乙酸溶液,离心,取上清液2.5 mL,加入2.5 mL水和0.5 mL 0.1%的FeCl3溶液,混匀,静置10 min,于波长700 nm处测定吸光度值。重复3次,取平均值[24]。
2 结果与分析
2.1 两地野生蓝莓营养成分比较
生长于不同环境的两种自然生长的蓝莓:蓝莓RU和蓝莓HH,尽管外观没有明显区别,但成分含量却有所差别,具体结果见表1和表2。

表1 两种蓝莓中糖酸指标Table 1 Sugar and acid indexes of two kinds of blueberry
由表1可知,蓝莓RU的pH值、还原糖含量和可溶性固形物高于蓝莓HH,而总酸含量低于蓝莓HH。经统计分析可知,两种蓝莓的4种成分含量差异性显著(P<0.05),尤其是还原糖含量,二者相差较多,这可能是由于阿穆尔州腾达市的纬度高于黑河,使得蓝莓RU所接受的日照时间要长于蓝莓HH,从而导致蓝莓RU进行的光合作用时间长,而呼吸作用时间较短,积累了更多的糖类化合物。

表2 两种蓝莓中矿物质元素的含量比较Table 2 Comparison of mineral elements content in two kinds of blueberrymg/kg
由表2可知,两种蓝莓均含有丰富的矿物质元素,其中K含量最高,其次是Ca、Mg、P,此外,还含有Fe、Zn等人体所需的矿物质元素。经统计分析表明两种蓝莓中矿物质元素Ca、P、Zn、Mn、Cr的含量存在显著性差异,而K、Mg、Fe、Cu、Co无显著性差异。这可能由于两个地方的土壤条件对蓝莓中矿物元素的形成起到了主导因素。
2.2 活性成分的含量
研究表明蓝莓中存在着多种活性成分。本试验的不同产地的两种蓝莓中活性成分(多酚、黄酮、花色苷)的含量如图1所示。
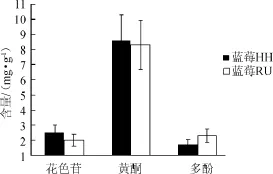
图1 两种蓝莓中活性成分含量比较Fig.1 Comparison of active components contents of two kinds of blueberry
由图1可以看出,两种蓝莓的三种活性成分存在一定程度的差异。其中,蓝莓HH的花色苷和黄酮含量高于蓝莓RU,而多酚含量低于蓝莓RU,通过显著性分析,结果显示这三种活性成分含量存在显著性差异(P<0.05)。这可能是由于这两种野生蓝莓的生长环境,如光照、湿度等均会影响野生蓝莓成熟期间花色苷、黄酮和多酚在果内的累积。
2.3 水提物抗氧化活性
2.3.1 清除DPPH自由基能力
以蒸馏水为溶剂代替水提蓝莓溶液作空白对照,采用1.3.4中DPPH自由基清除率的测定方法对两种蓝莓水提物的DPPH自由基清除能力进行测定,结果见图2。
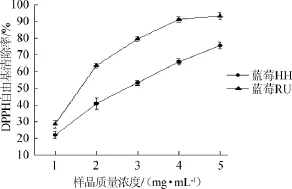
图2 两种蓝莓水提物对DPPH自由基的清除作用Fig.2 Scavenging effect of aqueous extracts from two kinds of blueberry on DPPH free radicals
由图2可知,蓝莓RU的DPPH自由基清除率要高于蓝莓HH。在样品浓度增加的过程中,两种果的清除能力都在逐渐上升,但蓝莓RU清除能力上升的速度更快。在样品质量浓度为5 mg/mL时,蓝莓RU和蓝莓HH的DPPH自由基清除率分别为93.22%、75.48%,二者相差较多。这可能是因为蓝莓RU中的多糖含量高于蓝莓HH。大量研究已经表明,植物多糖具有一定的抗氧化活性。
2.3.2 清除羟基自由基能力
以蒸馏水为溶剂代替蓝莓提取液作空白对照。两种蓝莓水提物对羟基自由基的清除率见图3。
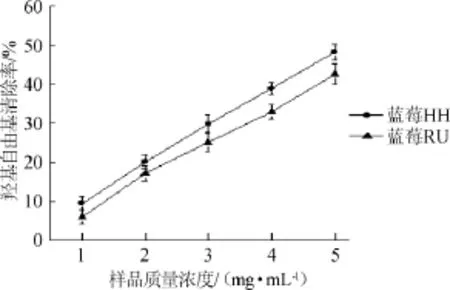
图3 两种蓝莓水提物对·OH的清除作用Fig.3 Scavenging effect of aqueous extracts from two kinds of blueberry on·OH
由图3可知,蓝莓HH的羟基自由基清除率要高于蓝莓RU。在样品浓度增加的过程中,两种果的清除能力都在逐渐上升,且二者上升速度基本保持平行。在样品质量浓度为5 mg/mL时,蓝莓RU和蓝莓HH的羟基自由基清除率分别为42.62%和48.24%,相对于DPPH自由基而言,两种蓝莓的羟基自由基清除能力偏低。
2.3.3 Fe3+还原力的测定
两种蓝莓水提物对Fe3+还原力见图4。
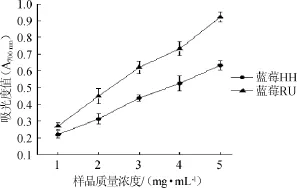
图4 两种蓝莓水提物对Fe3+还原能力Fig.4 Reducing capacity effect of aqueous extracts from two kinds of blueberry on Fe3+
由图4可知,蓝莓RU对Fe3+还原力高于蓝莓HH,在1~5 mg/mL范围内,随样品浓度的增加,吸光度值随着增加,但蓝莓RU增加速度较快,且在样品质量浓度由4mg/mL变为5 mg/mL时,吸光度值明显增加。
2.4 醇提物抗氧化活性
2.4.1 DPPH自由基清除能力
以乙醇为溶剂代替醇提蓝莓溶液作为空白对照,采用1.3.4中DPPH自由基清除率的方法,测定与水提物同浓度的蓝莓醇提物浓度的清除能力进行测定,结果见图5。

图5 两种蓝莓醇提物对DPPH自由基的清除作用Fig.5 Scavenging effect of alcohol extracts from two kinds of blueberry on DPPH free radicals
由图5可知,蓝莓RU的DPPH自由基清除率要高于蓝莓HH,二者的清除率随样品浓度的增加而增大,且增加程度基本保持平行,在样品质量浓度为5 mg/mL时,二者的清除率分别为91.44%和87.07%。出现这种现象的原因可能是由于蓝莓RU中多酚含量较高。
2.4.2 羟基自由基清除能力
以乙醇为溶剂代替蓝莓醇提液作空白对照,两种蓝莓醇提物对羟基自由基的清除能力见图6。
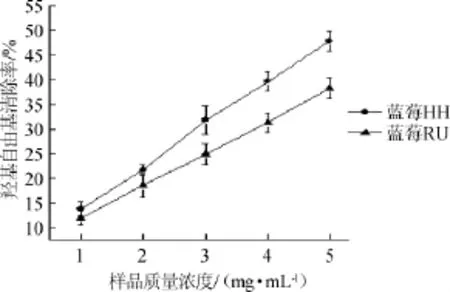
图6 两种蓝莓醇提物对·OH的清除作用Fig.6 Scavenging effect of alcohol extracts from two kinds of blueberry on·OH
由图6可知,蓝莓HH的羟基自由基清除率要高于蓝莓RU,在样品质量浓度为1~5 mg/mL的范围内,样品对羟基自由基的清除率逐渐增大,在样品质量浓度为5 mg/mL时,分别为47.80%和38.26%。相对于醇提物对DPPH自由基清除率,醇提物对羟基自由基的清除率偏低。
2.4.3 Fe3+还原能力的测定
两种蓝莓醇提物对Fe3+的还原力见图7。
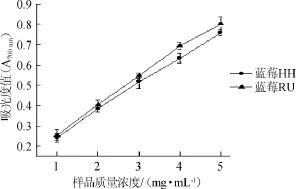
图7 两种蓝莓醇提物对Fe3+还原能力Fig.7 Reducing effect of alcohol extract from two kinds of blueberry on Fe3+
由图7可知,蓝莓RU的Fe3+还原力的要高于蓝莓HH,在样品质量浓度为1~5 mg/mL的范围内,样品的Fe3+还原力逐渐升高,两种蓝莓醇提物对Fe3+的还原力相差较小。
野生蓝莓水提物中的主要成分是蓝莓多糖,醇提物中主要是酚类化合物。通过比较同种蓝莓引种前后的两种野生蓝莓水提物和醇提物的抗氧化性发现二者均具有一定的抗氧化活性,在样品质量浓度为5 mg/mL时,蓝莓RU水提物和醇提物DPPH自由基清除率分别为93.22%和91.44%,蓝莓HH分别为75.48%和87.07%。此外,水提物和醇提物还具有较强的铁离子还原力,但是对羟基自由基的清除能力较低。
3 结论
本试验对蓝莓HH与蓝莓RU中主要活性成分、矿物质元素和糖酸指标的含量、水提物与醇提物的抗氧化活性进行了分析。结果表明,蓝莓RU的可溶性固形物、还原糖、多酚含量高于蓝莓HH,但是总酸、花色苷、黄酮含量低于蓝莓HH。酸、还原糖及活性成分的差异可能是由于所处地方日照时间、年积温等不同造成的。对于矿物质元素,显著性分析表明:两种蓝莓中矿物质元素Ca、P、Zn、Mn、Cr、的含量存在显著性差异,而K、Mg、Fe、Cu、Co无显著性差异,这可能是因为两地的土壤条件及周边环境的不同。抗氧化研究表明,蓝莓RU水提物与醇提物的DPPH自由基清除率和Fe3+还原力要强于蓝莓HH,而蓝莓HH的羟基自由基的清除率要强于蓝莓RU。通过比较发现引种前后两种自然生长的蓝莓在营养成分方面各有千秋,且二者都具有较强的抗氧化性,这表明不同的经纬度和自然环境条件会对蓝莓的成分产生一定的影响。
[1]李金星,胡志和.蓝莓花青素的研究进展[J].核农学报,2013,27(6):817-822.
[2]陈燕,孙晓红,曹奕,等.蓝莓抑菌活性研究进展[J].天然产物研究与开发,2013,25(5):716-721.
[3]方仲相,胡君艳,江波,等.蓝莓研究进展[J].浙江农林大学学报,2013,30(4):599-606.
[4]BIZABANI C,FONTENLA S,DAMES J F.Ericoid fungal inoculation of blueberry under commercial production in South Africa[J].Sci Hortic, 2016,209:173-177.
[5]PERTUZATTI P B,BARCIA M T,RODRIGUES D,et al.Antioxidant activity of hydrophilic and lipophilic extracts of Brazilian blueberries[J]. Food Chem,2014,164:81-88.
[6]CHATTERJEE A,YASMIN T,BAGCHI D,et al.Inhibition of Helicobacter pyloriin vitroby various berry extracts,with enhanced susceptibilityto clari&thromycin[J].Mol Cell Biochem,2004,265(1-2):19-26. [7]LIU Y N,TAN D,TONG C C,et al.Blueberry anthocyanins ameliorate radiation-induced lung injury through the protein kinase RNA-activated pathway[J].Chem-Biol Interact,2015,242:363-371.
[8]LINK A,BALAQUER F,GOEL A.Cancer chemoprevention by dietary polyphenols:promising role for epigenetics[J].Biochem Pharmacol, 2010,80(12):1771-1792.
[9]SPAGNUOLO C,RUSSO M,BILOTTO,et al.Dietary polyphenols in cancer prevention:the example of the flavonoid quercetin in leukemia[J]. Ann New York Acad Sci,2012,1259:95-103.
[10]邵盈盈.蓝莓总黄酮的提取纯化及紫心甘薯总黄酮的抗衰老作用评价[D].杭州:浙江大学,2013.
[11]严婷,李世芬,赵岩.蓝莓对小鼠免疫功能的调节作用[J].南京医科大学学报,2008,28(11):45-48.
[12]李森,莫依灿.蓝莓饮料研究概况[J].中国酿造,2016,35(7):11-14.
[13]孟宪军,孙希云,朱金艳,等.蓝莓多糖的优化提取及抗氧化性研究[J].食品与生物技术学报,2010,29(1):56-60.
[14]CHORFA N,SAVARD S,BELKACEMI K.An efficient method for high-purity anthocyanin isomers isolation from wild blueberries and their radical scavenging activity[J].Food Chem,2016,197:1226-1234.
[15]KALT W,DUFOUR D.Health functionality of blueberries[J].Hort Technol,1997,7(3):216-221.
[16]姜文洁.不同栽培蓝莓品种抗氧化与抑菌功能的研究[D].上海:上海海洋大学,2015.
[17]王芳.蓝霉果酒酿造工芝及对其品质影响的硏究[D].哈尔滨:东北林业大学,2015.
[18]陆美斌,王步军,李静梅,等.电感耦合等离子体质谱法测定谷物中重金属含量的方法研究[J].光谱学与光谱分析,2012,32(8):2234-2237.
[19]DENEV P,KRATCHANOVA M,CIZ M,et al.Biological activities of selected polyphenol-rich fruits related to immunity and gastrointestinal health[J]. Food Chem,2014,157:37-44.
[20]侯学敏,李林霞,张直峰,等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学,2013,34(6):124-128.
[21]WANG Y H,ZHU J Y,MENG X J,et al.Comparison of polyphenol, anthocyanin and antioxidant capacity in four varieties ofLonicera caeruleaberry extracts[J].Food Chem,2016,197:522-529.
[22]杨玲.蓝靛果提取物抗氧化及抗癌作用的研究[D].哈尔滨:东北林业大学,2009.
[23]孟阿会.核桃油成分及抗氧化性质研究[D].北京:北京林业大学,2012.
[24]胡卫成,王新风,沈婷,等.响应面试验优化莲蓬壳总黄酮超声提取条件及其抗氧化活性[J].食品科学,2015,36(24):51-56.
TS255.1
0254-5071(2017)05-0156-05
10.11882/j.issn.0254-5071.2017.05.033
2017-01-09
中央高校项目专项基金(2572014EA02);哈尔滨市科技创新人才项目(2015RAXXJ010)
包怡红(1970-),女,教授,博士,研究方向为林下资源精深加工,功能性食品。
