益生菌发酵乳模拟胃肠液环境下抗氧化活性
2017-06-01谢海军马玲赵玉明
谢海军,马玲,赵玉明*
(1.山西省生物研究所,山西太原030006;2.山西农业大学食品科学与工程学院,山西太谷030801)
益生菌发酵乳模拟胃肠液环境下抗氧化活性
谢海军1,马玲2,赵玉明1*
(1.山西省生物研究所,山西太原030006;2.山西农业大学食品科学与工程学院,山西太谷030801)
为间接评价益生菌发酵乳在人体内的抗氧化活性,分别采用嗜热链球菌(Streptococcus thermophilus)、德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.bulgaricus)、动物双歧杆菌(Bifidobacterium)BB12及嗜酸乳杆菌(Lactobacillus acidophilus)制备SL、SL+BB12、SL+LA三种发酵乳,并对其冷藏过程中模拟胃肠液环境下对ABTS、DPPH自由基的清除能力进行了测定。结果表明,三种发酵乳随冷藏时间的延长其抗氧化活性都逐渐降低,添加菌种BB12和LA的发酵乳抗氧化活性下降的幅度小于SL发酵乳,在相同的冷藏时间下模拟胃肠液环境后抗氧化活性都较原发酵乳降低,但添加益生菌BB12和LA发酵乳在模拟胃肠液环境下抗氧化活性高于SL发酵乳,其中BB12高于LA。SL、SL+BB、SL+LA发酵乳冷藏7 d时对ABTS自由基最大清除率分别为46.21%、58.54%、51.99%,对DPPH自由基最大清除率分别为42.17%、53.34%、49.48%。
发酵乳;益生菌;模拟胃肠液;抗氧化活性
XIE Haijun1,MA Ling2,ZHAO Yuming1*
(1.Biology Institute of Shanxi,Taiyuan 030006,China;2.College of Food Science and Technology,Shanxi Agricultural University, Taigu 030801,China)
In order to indirectly evaluate the antioxidant activity of fermented milk with probioticsin vivo,three kinds of fermented milk(SL, SL+BB12,SL+LA)were prepared byStreptococcus thermophilus,Lactobacillus delbrueckiisubsp.bulgaricus,BifidobacteriumBB12,Lactobacillus acidophilus.And the scavenging capacity of the three fermented milk on ABTS and DPPH free radicals in simulated gastrointestinal fluid during cold storage was detected.Results showed that the antioxidant capacity of the three fermented milk was gradually decreased with the extension of cold storage time.The decrease ranges of antioxidant activity of fermented milk with strain BB12 and LA were less than that of fermented milk with SL. In the same cold storage time,the antioxidant activity of fermented milk in the simulated gastrointestinal fluid was lower than that of the original fermented milk,but the antioxidant activity of fermented milk with strain BB12 and LA in the simulated gastrointestinal fluid was higher than that of fermented milk with SL,and the antioxidant activity of BB12 was higher than that of LA.The maximum scavenging rate of fermented milk with SL, SL+BB and SL+LA on ABTS free radicals were up to 46.21%,58.54%and 51.99%,respectively,and the maximum scavenging rate on DPPH free radicals were up to 42.17%,53.34%and 49.48%,respectively.
发酵乳具有调整肠道菌群、提高免疫力等重要的功能特性,而这些特性的发挥主要与发酵乳的抗氧化活性紧密相关。大量的文献报道发酵乳具有抗氧化作用,其中张江巍等[1]研究得出乳酸菌L4发酵乳的还原活性和螯合Fe2+作用均明显高于未发酵乳,SABEENA F K H S等[2]报道酸奶发酵过程中形成的<1 000 u的小肽提高了其抗氧化活性,RAHMAWATI I S等[3]发现牛奶、水牛奶和羊奶酸奶在21 d的冷藏过程中水溶性提取液的抗氧化活性基本不变。而已有的研究报道也发现乳酸菌发酵液的无细胞提取物及细胞本身都具有不同程度的抗氧化作用[4],嗜酸乳杆菌(Lactobacillus acidophilus)LA和动物双歧杆菌(Bifidobacterium)BB-12属于益生菌,已被证实对人体具有一定的抗氧化、调整肠道菌群等保健功能[5-6],但是对这些菌种发酵乳在模拟胃肠液下的抗氧化活性鲜见报道。本研究在结合前人研究的基础上,对几种不同的乳酸菌(嗜热链球菌、保加利亚乳杆菌、动物双岐杆菌BB12、嗜酸乳杆菌LA)发酵乳在21 d冷藏放置过程中及在模拟胃肠液环境下对2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2′-azino-bis(3-ethylbenzo-thiazoline-6-sulfonic acid)diammonium salt,ABTS)、1,1-二苯基-2-苦肼基(1,1-dipheny1-2-picryhydrazyl,DPPH)自由基的清除率进行测定,从而间接评价不同菌种发酵乳体内抗氧化活性,为评价益生菌发酵乳对人体的抗氧化作用及益生菌发酵乳的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
生鲜牛乳:山西农业大学牧站;保加利亚乳杆菌(Lactobacillus delbrueckiisubsp.bulgaricus)、嗜热链球菌(Streptococcus thermophilus)、动物双歧杆菌(Bifidobacterium)BB12、嗜酸乳杆菌(Lactobacillus acidophilus)LA:山西农业大学畜产品实验室保存;蔗糖:市售;ABTS自由基:北京Solarbio公司;DPPH自由基:日本东京化成工业株式会社;其余试剂均为国产分析纯。
1.2 仪器与设备
SW-CJ-2FD超净工作台:苏州净化设备有限公司;HPP-9272电热恒温培养箱:北京东联哈尔仪器制造有限公司;ST2100 pH计:奥豪斯仪器(常州)有限公司;FA2004电子分析天平:上海华岩仪器设备有限公司;LD5-2B低速离心机:北京雷勃尔医疗器械有限公司;7200型分光光度计:龙尼柯上海仪器有限公司;XH-C漩涡振荡器:金坛三和仪器有限公司;HH-4数显恒温水浴锅:江苏省金坛市友联仪器研究所。
1.3 实验方法
1.3.1 菌种活化
将生鲜牛乳分装至灭菌后的试管中灭菌,冷却至室温后分别接种保加利亚乳杆菌、嗜热链球菌、动物双歧杆菌BB-12、嗜酸乳杆菌LA-14冻干粉,置于恒温培养箱中进行培养,反复传代,直到符合生产发酵剂要求。
1.3.2 发酵乳的加工工艺流程
原料乳→杀菌(90℃、5~10 min)→加入白砂糖(7%)→冷却到36℃→加入菌种(3%)→摇匀→放入恒温培养箱培养→发酵(约4 h,直至凝乳形成)→冷却后熟(4℃,12 h)→发酵乳
接种3%由保加利亚乳杆菌、嗜热链球菌按1∶1组成的混合发酵剂制作的酸奶记为SL,接种1%保加利亚乳杆菌、嗜热链球菌按1∶1组成的混合发酵剂和2%动物双歧杆菌BB-12发酵剂制作的酸奶记为SL+BB12,接种1%保加利亚乳杆菌、嗜热链球菌按1∶1组成的混合发酵剂和2%嗜酸乳杆菌LA-14发酵剂制作的酸奶记为SL+LA。
1.3.3 模拟胃肠液的制备[7-8]
模拟胃液:稀盐酸16.4mL,加水800mL、胃蛋白酶10g,摇匀后加水至1 000 mL。
模拟肠液:取磷酸二氢钾6.8 g,加水500 mL溶解,用0.1 mol/L NaOH溶液调节pH至6.8,另取胰蛋白酶10 g加适量水使之溶解,将两液混合并加水至1 000 mL。
将待测发酵乳与蒸馏水以体积比1∶2的比例混匀配制为样品溶液然后进行抗氧化活性测定,将待测发酵乳与模拟胃液按照体积比1∶1的比例混匀在37℃条件下反应2 h,然后一份在冰水中终止反应,4 000 r/min离心10 min,取上清液测定抗氧化活性。另一份取出再与模拟肠液按照体积比1∶1的比例混匀在37℃条件下反应2 h,4 000 r/min离心10 min,取上清液测定抗氧化活性。
1.3.4 DPPH自由基清除能力的测定[9-10]
在试管中分别加入1 mL的样液和2 mL DPPH溶液充分振摇后放于暗处在室温下反应30min,然后于波长517nm处测定吸光度值。并测0.5mL样液加1.5mL甲醇的吸光值作对照,用1mLDPPH溶液加等体积的甲醇作空白,测定时用无水甲醇调零。DPPH自由基的清除能力计算公式如下:
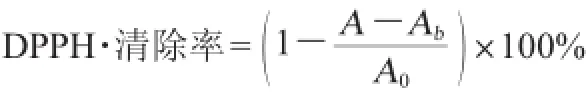
式中:A为样液与DPPH试剂混合液的吸光度值;Ab为样液与空白溶剂混合液的吸光度值;A0为DPPH试剂与空白溶剂混合液的吸光度值。
1.3.5 ABTS自由基清除能力
参考LIANG L H等[11]的方法并略作改动:将7 mmol/L ABTS与2.45 mmol/L过硫酸钾混匀在室温避光条件下放置12~16 h,形成ABTS储备液。ABTS储备液用磷酸盐缓冲溶液(phosphate buffered solution,PBS)(pH 7.4)稀释使其在波长734 nm处吸光度值为0.70±0.02。吸取0.3 mL待测样品于反应试管中,然后加入3 mL ABTS稀释液,用漩涡振荡器充分混匀,暗处反应6 min,于波长734 nm处测反应液吸光度值。ABTS自由基的清除能力计算公式如下:
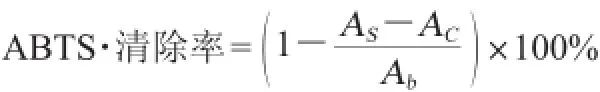
式中:AS为样品吸光度值,AC为对照组吸光度值,即用同体积PBS代替ABTS稀释液;Ab为样品空白组吸光度值。
1.3.6 发酵乳冷藏过程中菌株BB12、LA活菌数的测定
[12-13]进行发酵乳中益生菌嗜酸乳杆菌LA和动物双歧杆菌BB-12的活菌数测定。
2 结果与分析
2.1 发酵乳冷藏过程中对ABTS自由基的清除率
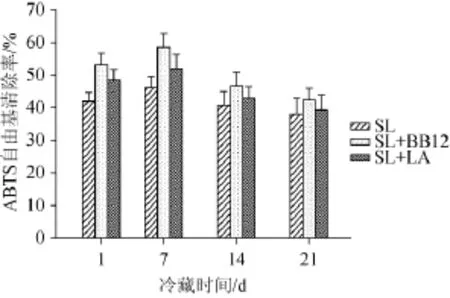
图1 发酵乳冷藏过程中对ABTS自由基的清除率Fig.1 Scavenging rate of fermented milk on ABTS free radical during cold storage
由图1分析可知,3种不同的发酵乳在冷藏过程中对ABTS自由基的清除率随时间的延长而呈波动性下降的趋势,在冷藏第7天时SL、SL+BB12、SL+LA3种发酵对ABTS自由基的清除率分别达到最大值46.21%、58.54%、51.99%,SL+BB12、SL+LA发酵乳在整个冷藏过程中清除率高于SL,而SL+BB12发酵乳又高于SL+LA,冷藏第1天和第7天,SL+BB12发酵乳显著高于SL(P<0.05)。发酵乳的抗氧化活性主要是乳酸菌菌体本身及其代谢产物综合作用的结果,不同的菌株耐受冷藏过程中不良环境的能力及代谢形成的超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)以及胞外多糖不同,因而抗氧化活性表现出差异。发酵乳在冷藏前体抗氧化活性主要取决于菌体细胞,而在后期由于大量细胞的死亡其抗氧化活性主要取决于其代谢产物。BB12和LA相对SL菌体更能在厌氧的不良环境下存活,因而在冷藏过程中BB12和LA发酵乳抗氧化活性高于SL。乳酸菌抗氧化活性与菌体本身有很大关系,另外对同一菌体其菌体本身和菌体发酵液抗氧化活性也有很大差异[14],在冷藏的不同阶段,活菌数和菌体发酵液的成分在不断变化,因而抗氧化活性也在变化。
2.2 发酵乳冷藏过程中模拟胃液环境下对ABTS自由基的清除率

图2 发酵乳冷藏过程中模拟胃液环境下对ABTS自由基的清除率Fig.2 Scavenging rate of fermented milk on ABTS free radical in simulated gastric fluid during cold storage
由图2分析可知,3种发酵乳在冷藏过程中模拟胃液环境下对ABTS自由基的清除率较原发酵乳都有一定程度下降,可能与胃液环境下较低的pH和胃蛋白酶作用下菌体细胞有部分死亡有关,MARTONI C等[15]报道植物乳杆菌(L.plantarum)在pH2.5和3.0的模拟胃液环境下放置4 h后其活菌数对数值分别下降1.09和0.6。而SL+BB12和SL+LA发酵乳在模拟胃液环境下对ABTS自由基的清除率高于SL,SL+BB12发酵乳又高于SL+LA,在冷藏21 d时SL+BB12发酵乳在模拟胃液环境下对ABTS自由基的清除率显著高于SL+LA和SL(P<0.05),这与BB12、LA等益生菌与嗜热链球菌和保加利亚乳杆菌相比更能够耐受胃液不良环境的能力有关,同时BB12和LA发酵乳在贮藏过程中的pH降低较SL发酵乳小,较小的pH变化有利于发酵剂菌数的存活。
2.3 发酵乳冷藏过程中模拟胃液、肠液环境下对ABTS自由基的清除率

图3 发酵乳冷藏过程中模拟胃肠液环境下对ABTS自由基的清除率Fig.3 Scavenging rate of fermented milk on ABTS free radical in simulated gastrointestinal fluid during cold storage
由图3分析可知,发酵乳在模拟胃肠液环境下对ABTS自由基的清除率随冷藏时间的延长而下降,其中SL+BB12发酵乳的清除活性高于SL+LA和SL,且与SL差异显著(P<0.05),在冷藏7 d和14 d时与LA也有显著差异(P<0.05)。这与BB12和LA耐受胃肠道不良环境的能力有关,MARTEAU P等[16]研究发现,嗜酸乳杆菌(L.acidophilus)和两歧双歧杆菌(Bifidobacterium bifidum)在动态穿过胃肠液环境时存活率高于嗜热链球菌(S.thermophilusand)和保加利亚乳杆菌补充拉丁文(L.bulgaricus)。MICHIDA H等[17]研究发现,植物乳杆菌(L.plantarum)的细胞对模拟肠道的环境具有抵抗力。
对比图1、图2和图3可知,发酵乳在模拟胃液、肠液环境下其抗氧化活性相对于模拟胃液和原发酵乳大大降低,充分说明乳酸菌在经过胃液和肠液的不良环境时活性大大降低,也可能发酵乳中代谢形成的抗氧化物质在胃肠液环境下被分解,特别是一些具有抗氧化活性的肽类。
2.4 发酵乳冷藏过程中对DPPH自由基的清除率
由图4分析可知,3种发酵乳冷藏过程中对DPPH自由基的清除率变化与对ABTS自由基清除率的变化规律相似,都随贮藏时间的延长而呈下降的趋势,但SL+BB12和SL+LA发酵乳下降的幅度较小,SL+BB12发酵乳对DPPH自由基的清除率显著高于SL(P<0.05),而SL+LA发酵乳在冷藏第7天和第21天时显著高于SL(P<0.05),SL+BB12与SL+LA发酵乳之间差异不显著(P>0.05)。不同乳酸菌的抗氧化能力不同,一般益生菌的抗氧化活性强于普通菌种,这与不同菌体细胞代谢形成具有抗氧化能力的活性物质种类和浓度有关。另外,同一种乳酸菌的完整细胞液和无细胞提取物的抗氧化能力也不同。FARVIN S等[2]研究发现,添加鱼油的酸奶粗提液及>30 ku和10~30 ku成分对DPPH自由基的清除率分别达到94.5%、99.3%和97.7%,抗氧化效果接近二丁基羟基甲苯(dibutyl hydroxy toluene,BHT),酸奶中的氨基酸及<1 000 u分子质量的小肽具有很强的抗氧化活性。
2.5 发酵乳冷藏过程中模拟胃液环境下对DPPH自由基的清除率

图5 发酵乳冷藏过程中模拟胃液环境下对DPPH自由基的清除率Fig.5 Scavenging rate of fermented milk on DPPH free radical in simulated gastric fluid during cold storage
由图5分析可知,3种发酵乳在模拟胃液环境下对DPPH自由基的清除率随冷藏时间的延长而下降,其中SL+BB12、SL+LA发酵乳在模拟胃液环境下对DPPH自由基清除率显著高于SL(P<0.05),这与SL+BB12和SL+LA发酵乳厌氧机制及冷藏过程中菌体细胞较高的存活率有关,尽管SL+BB12发酵乳清除率高于SL+LA,但二者差异不显著(P>0.05)。刘少敏等[4]研究发现3株乳酸菌的活菌均能不同程度缓解受到氧化损伤的Caco-2细胞胞内SOD活性降低和GPx活性升高的情况,但灭活菌体的效果并不明显,充分说明活菌在抗氧化中的作用。同时研究发现3株乳酸菌的菌体细胞对羟自由基的清除率高于发酵液,但对DPPH自由基的清除率与之相反,进一步说明不同的抗氧化评价方法反映的抗氧化成分及原理是不同的。有报道乳酸乳球菌能够形成具有抗氧化活性的SOD酶[18]。
2.6 发酵乳冷藏过程中模拟胃液、肠液环境下对DPPH自由基的清除率

图6 发酵乳冷藏过程中模拟肠液环境下对DPPH自由基的清除率Fig.6 Scavenging rate of fermented milk on DPPH free radical in simulate intestinal liquid during cold storage
由图6分析可知,3种发酵乳在模拟胃液、肠液环境下抗氧化活性大大降低,SL+BB12的发酵乳在冷藏第1天和第7天时的抗氧化活性显著高于SL和SL+LA(P<0.05),在冷藏14 d和21 d时尽管SL+BB12和SL+LA发酵乳在模拟胃肠液环境下对DPPH自由基清除率高于SL,但差异不显著(P>0.05),充分说明添加有益生菌BB12的发酵乳可以明显提高其产品冷藏过程中的生物活性(P<0.05),尤其是在人体食用后其抗氧化活性高于其他发酵乳。目前为止对乳酸菌的抗氧化机理还没有统一的认识。据文献报道[2],在乳酸菌体内有一些抗氧化酶类物质使得其具有抗氧化活性,也有研究发现乳酸菌代谢形成的胞外多糖也具有抗氧化活性。此外,体内天然的抗氧化剂,如阿魏酸、半胱氨酸、谷胱甘肽等也使乳酸菌产生抗氧化活性。张凤敏等[5]研究发现两株乳酸菌的活细胞和无细胞提取物对DPPH自由基的清除率接近,而张天博等[6]研究发现菌株无细胞提取物对DPPH自由基的清除能力均高于菌体细胞本身,具体的原因有待进一步研究,不管是菌体细胞本身还是菌体无细胞提取物都是复合的多种成分,因而给具体的研究带来了困难。
2.7 SL+BB12、SL+LA发酵乳冷藏过程中的BB12和LA活菌数变化
添加BB12和LA发酵乳冷藏过程中原发酵乳和模拟胃肠液环境下的抗氧化活性都较强,进一步结合抗氧化活性与菌体细胞本身之间的关联,对SL+BB12、SL+LA发酵乳冷藏过程中及模拟胃肠液环境下的活菌数进行测定,结果见表1。
从表1可知,两种发酵乳在21 d的冷藏过程中活菌数都大大降低,但最终还保持在106CFU/mL,而在模拟胃液后活菌数都较原发酵乳降低,尤其是在冷藏14d和21 d时模拟胃液反应后活菌数都降低到106CFU/mL和105CFU/mL,可能是发酵乳在模拟胃液环境下抗氧化活性较原发酵乳降低的主要原因。而在胃肠液环境下活菌数下降幅度更大,14d贮藏的发酵乳经过胃肠液的环境后都下降到104CFU/mL,与发酵乳在模拟胃肠液环境下的抗氧化活性降低有关。KHALIDA S等[19]研究发现,嗜酸乳杆菌(L.acidophilus)和双歧杆菌(Bifidobacteriumspp.)对数值在酸奶冷藏9周后下降1,TALWALKARA等[20]报道,双歧杆菌(Bifidobacterium)有抗过氧化氢的能力,并发现Bifidobacterium的无细胞提取物有超氧化物歧化酶(superoxide dismutase,SOD)、还原型辅酶(nicotinamideadeninedinucleotidehydrogen,NADH)和NADH氧化酶活性。所以添加益生菌类发酵乳在冷藏过程中益生菌能够较好保持活性,从而为益生菌发酵乳发挥生理活性提供了保证。

表1SL+BB12、SL+LA发酵乳冷藏过程中活菌数Table 1 Viable counts in fermented milk with SL+BB12 and SL+LA during cold storageCFU/mL
3 结论
发酵乳在冷藏过程中其抗氧化活性逐渐降低,在模拟胃液环境下,发酵乳抗氧化活性较原发酵乳降低,模拟胃液、肠液环境后抗氧化活性进一步降低,但添加益生菌BB12和LA发酵乳冷藏过程中抗氧化活性都高于SL发酵乳,而BB12发酵乳又优于LA。添加益生菌BB12发酵乳能很好发挥其对人体的抗氧化作用。
参考文献:
[1]张江巍,曹郁生,刘晓华,等.抗氧化乳酸菌L4的SOD活性及其发酵乳的抗氧化作用[J].中国乳品工业,2006,34(11):12-15.
[2]SABEENA F K H S,BARON C P,NIELSEN N S,et al.Antioxidant activity of yoghurt peptides:part I-in vitro assays and evaluation in w-3 enriched milk[J].Food Chem,2010,123(4):1081-1089.
[3]RAHMAWATIIS,SUNTOMSUKW.Effectsoffermentation and storage on bioactive activities in milks and yoghurts[J].Procedia Chem,2016, 18(6):53-62.
[4]刘少敏,周文琦,李婷,等.不同乳酸菌抗氧化能力的比较与分析[J].中国乳品工业,2015,43(8):8-12.
[5]张凤敏,田丰伟,陈卫,等.具抗氧化活性乳酸菌的筛选[J].中国乳品工业,2007,35(2):4-7.
[6]张天博,宁喜斌.乳酸菌对自由基清除能力的研究[J].中国乳品工业,2007,35(4):10-12.
[7]RANADHEERA C,SENAKA C A,EVANS MC,et al.In vitroanalysis of gastrointestinal tolerance and intestinal cell adhesion of probiotics in goat's milk ice cream and yogurt[J].Food Res Int,2012,49(2):619-625.
[8]BOUAYED J,HOFFMANN L,BOHN T.Total phenolics,flavonoids, anthocyanins and antioxidant activity following simulated gastro-intestinal digestion and dialysis of apple varieties:bioaccessibility and potential uptake[J].Food Chem,2011,128(1):14-21.
[9]王辉.绞股蓝乙酸乙酯提取物有效成分的分离及生物活性研究[D].晋中:山西农业大学,2010.
[10]YAMAGUCHI T,TAKAMURA H,MATOBA T A,et al.HPLC method for evaluation of the free radical-scavenging activity of foods by using 1,1-diphenyl-2-picrylhydrazyl[J].Biosci Biotechnol Biochem,1998,62 (6):1201-1204.
[11]LIANG L H,WU X Y,ZHAO T,et al.In vitrobioaccessibility and antioxidant activity of anthocyanins from mulberry(Morus atropurpurea Roxb.)following simulated gastro-intestinal digestion[J].Food Res Int, 2012,46(1):76-82.
[12]BEDANI R,VIEIRA A D S,ROSSIA E A,et al.Tropical fruit pulps decreased probiotic survival toin vitrogastrointestinal stress in synbiotic soy yoghurt with okara during storage[J].LWT-Food Sci Tech,2014, 55(2):436-443.
[13]RANADHEERA C S,EVANS C A,ADAMS M C,et al.In vitroanalysis of gastrointestinal tolerance and intestinal cell adhesion of probiotics in goat's milk ice cream and yogurt[J].Food Res Int,2012,49(2):619-625.
[14]顾品品,邢家溧,王刚,等.几种体外评价乳酸菌无细胞提取物抗氧化活性方法的比较研究[J].食品工业科技,2015,36(23):84-88.
[15]MARTONI C,BHATHENA J,JONES M L,et al.Investigation of microencapsulated BSH activeLactobacillusin the simulated human GI tract[J].J Biomed Biotechnol,2007,136(84):1-9.
[16]MARTEAU P,MINEKUS M,HAVENAAR R,et al.Survival of lactic acid bacteria in a dynamic model of the stomach and small intestine: Validation and the effects of bile[J].J Dairy Sci,1997,80(6):1031-1037.
[17]MICHIDA H,TAMALAMPUDI S,PANDIELLA S,et al.Effect of cereal extracts and cereal fiber on viability ofLactobacillus plantarumunder gastrointestinal tract conditions[J].Biochem Eng J,2006,28(1): 73-78.
[18]胡晓丽,孙进,乐国伟,等.抗氧化乳酸菌在体外结肠环境清除羟自由基的研究[J].中国微生态学杂志,2009,21(6):488-496.
[19]KHALIDA S,GODWARD G,REYNOLDS N,et al.Encapsulation of probiotic bacteria with alginate-starch and evaluation of survival in simulated gastrointestinal conditions and in yoghurt[J].Int J Food Microbiol,2001,62(1-2):47-55.
[20]TALWALKAR A,KAILASAPATHY K.Metabolic and biochemical responses of probiotic bacteria to oxygen[J].J Dairy Sci,2003,86(8): 2537-2546.
TS252.1
0254-5071(2017)05-0090-05
10.11882/j.issn.0254-5071.2017.05.019
2017-03-06
山西省重点研发计划重点项目(201603D21108);山西省火炬计划项目(2007061058)
谢海军(1962-),男,副研究员,硕士,研究方向为食品加工。
*通讯作者:赵玉明(1965-),男,副研究员,本科,研究方向为生物技术、食品加工。
