新血府逐瘀汤对动脉粥样硬化模型大鼠主动脉形态及免疫调节因子HMGB-1、 Foxp3表达的影响❋
2017-06-01纪文岩隋永妮刘妮娜吉中强
姜 婷,纪文岩△,隋永妮,刘妮娜,吉中强
(1.青岛市海慈医疗集团(青岛市中医医院),山东 青岛 266033;2.青岛市中心医院,山东 青岛 266042)
【实验研究】
新血府逐瘀汤对动脉粥样硬化模型大鼠主动脉形态及免疫调节因子HMGB-1、 Foxp3表达的影响❋
姜 婷1,纪文岩1△,隋永妮2,刘妮娜1,吉中强1
(1.青岛市海慈医疗集团(青岛市中医医院),山东 青岛 266033;2.青岛市中心医院,山东 青岛 266042)
目的: 观察新血府逐瘀汤对动脉粥样硬化模型大鼠主动脉HMGB-1、Foxp3表达及病理形态学影响,探讨其调节免疫因子抗动脉粥样硬化的作用机制。方法: 雄性SPF级Wistar大鼠48只,按随机数字表法分为空白对照组、模型组、立普妥组、新血府逐瘀汤(NXFZY)低剂量组、NXFZY高剂量组及NXFZY+立普妥组。除空白组外,其余各组复制动脉粥样硬化模型,NXFZY低剂量组新血府逐瘀汤9 g/(kg·d)、NXFZY高剂量组新血府逐瘀汤18g/(kg·d)灌胃,立普妥组给予阿托伐他汀钙2 mg/(kg·d)水溶液灌胃,对照组及模型组灌服等容积生理盐水,8周后HE染色后镜下观察胸主动脉病理学改变,免疫组织化学法检测胸主动脉HMGB-1、Foxp3表达并进行相关性分析。结果: 与模型组比较,新血府逐瘀汤可显著降低HMGB-1表达,升高Foxp3表达,两者存在显著负相关性。结论:新血府逐瘀汤可通过下调促炎因子HMGB-1、上调抗炎因子Foxp3表达,调节AS过程中促炎与抗炎因子之间的平衡,发挥抗AS的作用。
新血府逐瘀汤;动脉粥样硬化;免疫调节因子;高迁移率族蛋白B1;叉头翼状螺旋转录因子P3
免疫与炎症是目前防治动脉粥样硬化(atherosclerosis, AS)的公认靶点[1],抗炎因素与致炎因素的相互作用决定AS发生发展的进程[2]。他汀类调脂药物虽然也有抑制免疫炎症的作用,但因肝肾功能及肌肉损害等问题一定程度上限制了此类药物的应用范围[3],因此如何发挥中药复方在抗AS中的多靶点协同作用优势,值得深入研究。本实验观察新血府逐瘀汤(NXFZY)对AS大鼠主动脉免疫调节因子高迁移率族蛋白B1(high mobility group protein,HMGB-1)、叉头翼状螺旋转录因子P3(Foxp3)表达影响及病理形态学改变,探讨其抗AS的可能机制。
1 材料与方法
1.1 动物
SPF级雄性Wistar大鼠,体质量(200±10)g,符合一级实验动物质量标准(动物合格证号SCXK(鲁)20130004)。
1.2 实验药物
1.2.1 中药 新血府逐瘀汤组成:桃仁12 g,红花、生地、当归、泽泻、牛膝、首乌各9 g,枳实、赤芍、生山楂各6 g,川芎4.5 g。经浸泡、煎煮、过滤、浓缩制成煎剂,真空包装,其中高、低剂量每毫升含生药分别为2.0 g、1.0 g,低温冷藏备用。
1.2.2 西药 阿托伐他汀钙(立普妥,10 mg/片,美国辉瑞制药有限公司,生产批号1337119),丙硫氧嘧啶(上海朝晖,生产批号1307F02),注射用维生素 D3(上海通用制药股份有限公司,生产批号12115)。
1.3 主要试剂及仪器
Rb polyclonal to HMGB-1Antibody (abcam,批号GR93186-2),工作浓度1∶50;Ms polyclonal to Foxp3 Antibody (abcam,批号GR146107-3),工作浓度1∶50;羊抗兔二抗(abcam,批号GR101082-1),工作浓度为1∶500;羊抗鼠二抗(abcam,批号GR101081-1),工作浓度1∶500;兔抗羊二抗(abcam,批号GR101083-1),工作浓度1∶500。DAB显色试剂盒(北京中衫金桥生物技术有限公司)、光学显微镜(BX43型,OLYMPUS公司)、轮转式切片机(RM2235型,LEICA公司)、病理组织漂烘仪(tec 2500型,常州市郝思琳仪器设备有限公司)等。
2 方法
2.1 分组及造模
常规饲养1周后,采用随机数字表法将48只雄性Wistar大鼠分成对照组、模型组、立普妥组、NXFZY低剂量组、NXFZY高剂量组和NXFZY+立普妥组6组各8只。对照组进食基础饲料(53%碳水化合物,9%脂肪,21%蛋白质),其余各组喂食高脂饲料(1%胆固醇,5%猪油,0.5%胆酸钠,0.2%丙硫氧嘧啶,93.3%普通饲料)直至取材。建模采用文献[4]的方法,模型组及药物干预组大鼠从实验第1天开始即喂食高脂饲料,实验开始时腹腔注射维生素D3(每次注射17.5万IU/kg,隔2 d注射1次,共注射4次)。
2.2 给药
造模第3周后,NXFZY低、高剂量组分别以新血府逐瘀汤低剂量、高剂量煎剂10 ml/(kg·d)灌胃,qd;立普妥组给予阿托伐他汀钙2 mg/(kg·d)水溶液灌胃,qd;NXFZY+立普妥组上述2种方案相加给药;对照组及模型组则分别灌服等容积生理盐水;连续灌胃8周,每周称重1次,根据体质量调整用药量。
2.3 组织病理学观察
8周后麻醉大鼠,切开胸腹常规贴片、脱腊、HE染色,用ipp6.0专业图像分析软件测量胸主动脉内膜和中膜厚度。
2.4 免疫组化法检测HMGB-1、Foxp3表达
按试剂盒说明步骤进行免疫组化染色,每张免疫组化切片随机选择3个不同的视野(×200)微镜下观察,染色结果判定参照文献[5]中的方法,对每个视野均进行染色强度计分与阳性细胞百分比乘积评分,评价其阳性表达强度及阳性率。
2.5 统计学方法

3 结果
实验过程中3只大鼠死亡,因灌药不慎导致立普妥组和NXFZY高剂量组各有1只老鼠死亡,另有模型组1只老鼠死于腹泻。
3.1 6组大鼠胸主动脉病理形态学观察
图1显示,各组大鼠胸主动脉给予HE染色后进行镜下观察,大鼠主动脉粥样硬化模型组主动脉内膜显著增厚,中膜平滑肌细胞增殖,可见脂质斑块和泡沫细胞积聚及坏死深染物质,动脉壁三层结构紊乱,提示AS模型建立成功;各治疗组主动脉粥样硬化斑块病变程度较模型组不同程度减轻,尤其是NXFZY+立普妥组主动脉内膜结构完整,中膜平滑肌细胞排列较为规则,未见硬化斑块产生,各层结构尚清晰,提示新血府逐瘀汤与阿托伐他汀钙联用能有效抑制AS斑块的形成。
3.2 6组大鼠胸主动脉内膜、中膜厚度比较
表1显示,与模型组比较,立普妥组、NXFZY高剂量组、NXFZY+立普妥组内膜及中膜厚度不同程度降低,差异有统计学意义(P<0.05或P<0.01);其中NXFZY+立普妥组降低内膜及中膜厚度较单纯立普妥组更明显(P<0.05);NXFZY高剂量组内膜厚度低于NXFZY低剂量组,且差异有统计学意义(P<0.05)。
3.3 免疫组化法检测6组大鼠胸主动脉HMGB-1、Foxp3表达结果
表1图2、3显示,与空白组比较,模型组HMGB-1阳性表达明显增高,Foxp3显著降低,差异有统计学意义(P<0.01)。与模型组比较,各治疗组HMGB-1阳性表达水平不同程度降低(P<0.05或P<0.01),其中NXFZY高剂量组与NXFZY+立普妥组HMGB-1水平降低明显(P<0.01);NXFZY高剂量组、NXFZY+立普妥组Foxp3阳性表达升高差异有统计学意义(P<0.05或P<0.01)。组间比较,NXFZY+立普妥组降低HMGB-1,升高Foxp3阳性表达水平,与单纯立普妥组比较差异有统计学意义(P<0.05);NXFZY高剂量组HMGB-1阳性表达水平低于NXFZY低剂量组(P<0.05),Foxp3阳性表达均值较低剂量组升高,但差异无统计学意义(P>0.175)。

图1 各组大鼠胸主动脉病理形态学观察(×200)注:A.对照组;B.模型组;C.立普妥组;D.NXFZY低剂量组;E.NXFZY高剂量组;F.NXFZY+立普妥组

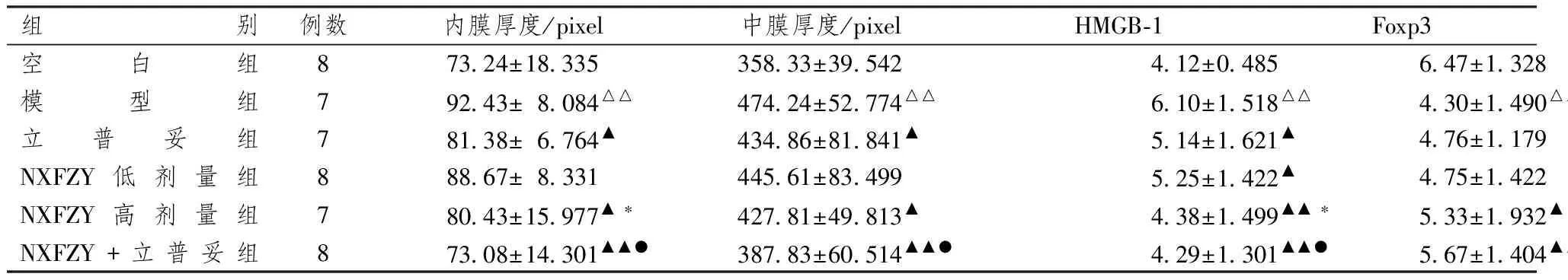
组 别例数内膜厚度/pixel中膜厚度/pixelHMGB⁃1Foxp3空白组873 24±18 335358 33±39 5424 12±0 4856 47±1 328模型组792 43±8 084△△474 24±52 774△△6 10±1 518△△4 30±1 490△△立普妥组781 38±6 764▲434 86±81 841▲5 14±1 621▲4 76±1 179NXFZY低剂量组888 67±8 331445 61±83 4995 25±1 422▲4 75±1 422NXFZY高剂量组780 43±15 977▲∗427 81±49 813▲4 38±1 499▲▲∗5 33±1 932▲NXFZY+立普妥组873 08±14 301▲▲●387 83±60 514▲▲●4 29±1 301▲▲●5 67±1 404▲▲●
注:与空白组比较:△△P<0.01;与模型组比较:▲P<0.05,▲▲P<0.01;与立普妥组比较:●P<0.05;与NXFZY低剂量组比较:*P<0.05

图2 各组大鼠胸主动脉HMGB-1表达(×200)注:A.对照组;B.模型组;C.立普妥组;D.NXFZY低剂量组;E.NXFZY高剂量组;F.NXFZY+立普妥组

图3 各组大鼠胸主动脉Foxp3表达(×200)注:A.对照组;B.模型组;C.立普妥组;D.NXFZY低剂量组;E.NXFZY高剂量组;F.NXFZY+立普妥组
3.4 动脉粥样硬化大鼠主动脉HMGB-1、Foxp3的相关性分析
分析45只AS大鼠主动脉HMGB-1、Foxp3阳性表达评分结果相关性,结果显示两者之间相关系数(r=-0.627)呈显著负相关(P<0.01)。
4 讨论
AS是一种多种免疫因素参与、复杂的慢性炎症性疾病[6],炎症贯穿于AS发生、发展、变化的全过程,决定着AS的进展及斑块稳定[7]。Kalinina等[8]首次发,现高迁移率族蛋白B1(high mobility group protein,HMGB-1)在AS病变中表达增高,是参与AS慢性炎症进程中重要的炎症介质之一。而在抑制AS形成过程中,调节性T细胞(regulatory T cell,Treg)及其分泌的细胞因子在负向调节免疫应答方面起了重要作用。叉头翼状螺旋转录因子P3(Foxp3)在CD4+CD25调节性T淋巴细胞的功能上发挥着重要作用,是Treg的一个相对特异性标记[9]。多项动物实验证实,Foxp3通过调控体内炎症而具有抗AS的作用[10]。
为在活血化瘀的基础上使调达气机之力更擅,且兼化痰降浊之功,在血府逐瘀汤的基础上,以枳实替代桔梗、枳壳、柴胡,并加入何首乌、泽泻、山楂化痰降浊之品组成新血府逐瘀汤。在前期研究中证实,新血府逐瘀汤在防治AS的进程中具有调节脂质代谢、抑制血管内皮炎症等作用,以降低心血管事件的发生[11]。本研究发现,AS模型大鼠在病理组织形态学改变的同时,HMGB-1阳性表达增高,考虑受损的血管内皮细胞和活化的炎性细胞可主动释放大量的HMGB-1,刺激临近的内皮细胞表达促炎细胞因子、趋化因子、黏附分子等[12],而这些炎症介质可反向促进HMGB1和其他炎性因子释放,造成AS血管的HMGB1水平明显高于正常血管[13]。而新血府逐瘀汤干预后,HMGB1阳性表达水平显著降低。
新血府逐瘀汤在降低HMGB1阳性表达的同时,Foxp3阳性表达水平升高,提示Treg细胞的功能发挥得到改善。相关性分析发现,两者呈显著负相关。考虑新血府逐瘀汤可直接作用于HMGB1,抑制相关炎症因子分泌发挥抗AS作用,同时HMGB1可通过影响Treg细胞功能干预AS的进程。一方面HMGB1与Treg细胞上的TLR2、4结合抑制其功能发挥,加速AS的形成和发展;另一方面HMGB1可能激活Th17细胞,降低Foxp3的表达以及抑制IL-10的分泌,从而降低Tregs细胞的活性,导致细胞免疫平衡破坏使炎症反应维持及放大[14]。
总之,新血府逐瘀汤通过对HMGB1表达的抑制及Foxp3表达的促进,调节促炎因子与抗炎因子之间的平衡,体现了中药复方制剂多靶点、双向调节作用的优势,值得进一步探索与应用。
[1] LU X, KAKKAR V. Inflammasome and atherogenesis[J]. Curr Pharm Des,2014,20(1):108-124.
[2] 郑娴,王凤荣. 大柴胡汤对动脉粥样硬化家兔血脂及炎性因子表达的影响[J].中医杂志,2013(19):1681-1685.
[3] STONE N J, ROBINSON J G, LICHTENSTEIN A H, et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].Circulation,2014,129(25 Suppl 2):S1-S45.
[4] 纪文岩,姜婷,聂颖颖,等. 新血府逐瘀汤对动脉粥样硬化模型大鼠免疫因子TGF-β、VCAM-1表达的影响[J].中医药信息,2015,(6):40-43.
[5] 姜婷,纪文岩,迟伟峰,等. 新血府逐瘀汤与血府逐瘀汤对动脉粥样硬化模型大鼠主动脉形态及免疫调节细胞因子的影响[J].中华中医药学刊,2015(8):1985-1987.
[6] ROSS R. Atherosclerosis—an inflammatory disease[J].N Engl J Med,1999,340(2):115-126.
[7] LIBBY P. Inflammation in atherosclerosis[J].Arterioscler Thromb Vasc Biol,2012,32(9):2045-2051.
[8] KALININA N, AGROTIS A, ANTROPOVA Y, et al. Increased expression of the DNA-binding cytokine HMGB1 in human atherosclerotic lesions: role of activated macrophages and cytokines[J]. Arterioscler Thromb Vasc Biol,2004,24(12):2320-2325.
[9] 王咏. 新血府逐瘀汤对动脉粥样硬化大鼠主动脉斑块形成及Th1/Th2失衡的影响[D]. 济南:山东中医药大学,2012.
[10] SASAKI N, YAMASHITA T, TAKEDA M, et al. Oral anti-CD3 antibody treatment induces regulatory T cells and inhibits the development of atherosclerosis in mice[J].Circulation,2009,120(20):1996-2005.
[11] 纪文岩,赵坤,迟伟峰,等. 新血府逐瘀软胶囊对冠心病患者血瘀征象及血管内皮炎症的影响[J].中医杂志,2012(22):1934-1936.
[12] HU X, CUI B, ZHOU X, et al. Ethyl pyruvate reduces myocardial ischemia and reperfusion injury by inhibiting high mobility group box 1 protein in rats[J].Mol Biol Rep,2012,39(1):227-231.
[13] GIALLAURIA F, CIRILLO P, D′AGOSTINO M, et al. Effects of exercise training on high-mobility group box-1 levels after acute myocardial infarction[J].J Card Fail,2011,17(2):108-114.
[14] SHI Y, SANDOGHCHIAN S S, SU Z, et al. Enhanced HMGB1 expression may contribute to Th17 cells activation in rheumatoid arthritis[J].Clin Dev Immunol,2012,2012:295081.
Effects of New Xuefu Zhuyu Decoction on the Expression of Immunomodulatory Factors HMGB-1 and Foxp3 in Atherosclerosis Model Rats
JIANG Ting1, JI Wen-yan1△, SUI Yong-ni2, LIU Ni-na1, JI Zhong-qiang1
(1.QingdaoHaiciMedicalGroup,Qingdao266033,China;2.QingdaoCentralHospital,Qingdao266042,China)
Objective: By observing the effect of New Xuefu Zhuyu Decoction on aorta pathologymorphology and HMGB-1, Foxp3 expression in atherosclerosis model rats, explore its anti atherosclerosis mechanism by the regulation of immune factors. Methods:48 healthy male Wistar rats were randomly divided into blank control group, model group, western medicine group, low dose Chinese medicine group, high dose Chinese medicine group, and the group of high dose Chinese medicine plus western medicine. Except the blank group, other groups were copied to atherosclerosis model, low dose group and high dose group of Chinese medicine gavaged with New Xuefu Zhuyu Decoction at a concentration of 9 g/ (kg·d) and 18g/ (kg·d) respectively; western medicine group with aqueous solution of atorvastatin calcium 2 mg/(kg·d); these two programs administered by adding for Integrative Medicine group; simultaneously, the control and the model group were fed with volume of normal saline. After 8 weeks, the thoracic aortic pathology change was observed under light microscope with HE staining; the HMGB-1, Foxp3 expression of thoracic aortic was detected by immunohistochemical method, and then their correlativity was analyzed. Results: Compared with the model group, the New Xuefu Zhuyu Decoction could decrease the expression of HMGB-1 and increase the expression of Foxp3, and the two have a significant negative correlation.Conclusion:New Xuefu Zhuyu Decoction could down regulate proinflammatory factor HMGB-1 and upregulation of anti-inflammatory factor Foxp3 expression, to play the role of anti atherosclerosis by regulating the balance of inflammatory factor.
New Xuefu Zhuyu Decoction; Atherosclerosis; Immune regulation factor; HMGB-1; Foxp3
山东省中医药科技发展计划重点专项(2013ZDZK-105)-新血府逐瘀软胶囊对血瘀型心绞痛 FOXP3基因甲基化的干预研究;青岛市医药科研指导计划(2014-WJZD061)-新血府逐瘀汤干预动脉粥样硬化模型大鼠免疫调节因子表达的研究
姜 婷(1984-),女,山东青岛人,主治医师,医学硕士,从事中医药心血管疾病的临床与研究。
△通讯作者:纪文岩,Tel:0532-83777551,E-mail:jiwenyan@sina.com。
R285.5
B
1006-3250(2017)04-0480-04
2016-12-22
