两株野鸟源H6N1和H6N8亚型禽流感病毒的遗传进化分析和对小鼠的感染性研究
2017-06-01蒋文明李金平王素春侯广宇陈继明
蒋文明,李金平,彭 程,王素春,侯广宇,陈继明
(中国动物卫生与流行病学中心,山东青岛 266032)
两株野鸟源H6N1和H6N8亚型禽流感病毒的遗传进化分析和对小鼠的感染性研究
蒋文明,李金平,彭 程,王素春,侯广宇,陈继明
(中国动物卫生与流行病学中心,山东青岛 266032)
为了解2016年在江西省鄱阳湖野鸟中分离的两株H6N8和H6N1亚型禽流感病毒(P419和P339)的生物学特性,本研究对其进行了全基因组序列测定、受体分析和对BALB/c小鼠的感染性试验。序列分析结果显示,这2个毒株属于不同的分支,并经历了不同亚型病毒间的广泛重组。2个分离株的HA裂解位点基序均为PQIETR/GLF,符合低致病性禽流感病毒的分子特征。HA蛋白受体结合位点处第138、226、228位氨基酸残基分别为丙氨酸(A)、谷氨酰胺(Q)、甘氨酸(G),具有结合禽样流感病毒受体的分子特征。受体结合试验表明,分离毒株仅能结合禽样受体。Balb/c小鼠的感染性试验结果显示,分离株只在小鼠的上呼吸道鼻甲中进行有限复制,使小鼠体重发生轻微变化,未表现明显临床症状,表明这2株分离株可感染小鼠,但致病力不强。
禽流感病毒;H6亚型;野鸟;感染性
野鸟,特别是水禽,是禽流感病毒(AIVs)的自然储存库[1-2],所有H1~H16和N1~N9亚型的A型AIVs都曾在野鸟中被发现过[3]。1965年,美国在火鸡中首次分离到H6亚型AIVs。随后该亚型AIVs在全世界范围内的野鸟和家禽中被发现。1997年,H6亚型病毒在我国华南地区的活禽市场中被检测到。本研究对2016年在鄱阳湖野鸟中分离的2株H6N1和H6N8亚型AIVs进行了全基因组测序和遗传进化分析,并对其进行了生物学特性研究,以期了解该亚型病毒在野鸟中的进化和生物学特性。
1 材料与方法
1.1 材料
1.1.1 病毒及实验动物。2株H6亚型AIVs,A/ wild bird/Jiangxi/P339/2016(H6N1)和A/wild bird/ Jiangxi/P419/2016(H6N8),由中国动物卫生与流行病学中心禽病监测室分离并鉴定;SPF鸡胚,购自济南斯帕法斯家禽有限公司;BALB/c小鼠,购自北京维通利华实验动物有限公司。
1.1.2 主要试剂。QIAamp Viral RNA Mini Kit,购 自 Qiagen公 司;HiScript II One Step RT-PCR Kit,购自Vazyme公司;DNA胶回收试剂盒、pMD19-T载体、质粒提取纯化试剂盒、α2,3-sialidase,购自Takara公司。
1.2 全基因组序列测定与分析
将病毒10倍比稀释后,接种9~11日龄SPF鸡胚,纯化3代后进行病毒增殖及保存。根据QIAamp Viral RNA Mini Kit操作说明,提取病毒RNA,置-70 ℃保存备用。根据已发表的文献[13]合成扩增基因组片段的引物。利用HiScript II One Step RT-PCR Kit扩增病毒的8个基因片段。按照DNA胶回收试剂盒说明纯化回收PCR产物,然后将其与pMD19-T载体连接,将阳性重组质粒送上海生工进行测序鉴定,对基因组序列通过Blast、MegAlian、Mega 6等软件进行分析。
1.3 受体结合试验
具体方法参考已发表的文献[14]。用PBS制备10%的鹅红细胞悬液(Goose red blood cell,GRBC),将每100 μL悬液用1.25 U α2,3-sialidase 37 ℃处理1 h,然后用PBS洗涤2次,配成浓度为0.5%的鹅红细胞悬液。同样制备未经处理的0.5%的鹅红细胞悬液。将病毒2倍比稀释后,分别与这2种等量鹅红细胞悬液混合作用,记录发生完全凝集的最大病毒稀释度。
1.4 小鼠感染性试验
将病毒经鼻腔接种10只6周龄的BALB/c小鼠,106EID50/0.05 mL/只,同时以等量的PBS接种5只小鼠作为阴性对照。感染后3 d,处死5只小鼠,剖检观察病变,并采集肺、鼻窦、脾、肝和脑组织,进行病毒滴定。对其余小鼠连续观察14 d,并每天记录小鼠的体重变化情况。
2 结果
2.1 基因组序列的遗传进化分析
以提取的P419和P339分离株RNA为模板,用RT-PCR分别扩增其8个基因片段,然后测序。将全基因组序列在NCBI上进行BLAST比对。结果显示,P419病毒的8个基因片段与来自韩国、日本、中国、越南、危地马拉等国家相关亚型禽流感病毒(野鸟、鸡、鸭、鹅)的同源性最高;P339病毒的8个基因片段与来自蒙古、中国、日本等国家相关亚型禽流感病毒(野鸟、鸭、鸽)的同源性最高(表1)。

表1 两株H6亚型分离株基因组与GenBank中病毒的同源性比较
2.2 HA基因序列及遗传进化分析
P419和P339的HA基因编码区均为1 701 nt,编码567个氨基酸残基。HA氨基酸序列分析表明,2株H6病毒的HA裂解位点基序为PQIETR/GLF,仅有1个碱性氨基酸,符合低致病性AIVs的分子特征。NetNGlyc 1.0 Server预测分析表明,P419在27、39、306、557位含有4个潜在的糖基化位点,P339在27、39、182、306、498、557位含有6个潜在的糖基化位点。P419和P339在第138、226、228位分别为丙氨酸(A)、谷氨酰胺(Q)、甘氨酸(G),倾向于结合禽样受体。
HA基因遗传进化分析显示,H6亚型AIVs可以分为欧亚谱系和北美谱系。欧亚谱系又可进一步分为HN573-like、ST2853-like、ST339-like、Korea545-like和AHL221-like 5个小分支。其中前3个分支为前期H6亚型AIVs的主要分支[15],此次研究中的P419和P339分离株HA基因分别属于后2个分支,两者核苷酸同源性为93.18%(图1)。
2.3 NA基因序列及遗传进化分析
P419和P339的NA基因编码区分别为1 413和1 410 nt,分别编码471和470个氨基酸残基。NetNGlyc 1.0 Server预测分析表明,P419在46、54、67、84、144、293、398位含有7个潜在的糖基化位点,P339在50、58、63、68、88、146、235位含有7个潜在的糖基化位点。P419与A/duck/Zhejiang/ D1-6/2013(H3N8)的NA基因核苷酸同源性为97.88%,P339与 A/wild bird/Wuhan/WHHN16/2014(H1N1)的NA基因核苷酸同源性为99.14%。
2.4 内部基因序列及遗传进化分析
P419和P339分离株间的PB2、PB1、PA、 NP、M、NS核苷酸同源性分别为95.77%、95.45%、93.96%、97.66%、93.59%、97.08%。2个分离株的内部基因与H7N7、H6N5、H1N1、H10N2、H3N8、H14N3、H11N3、H1N2、H12N8、H5N3、H4N6、H2N8等多种亚型的AIVs核苷酸同源性较高,表明内部基因来源复杂。
2.5 受体结合特性
2株病毒只能与未处理的鹅红细胞反应,不能与处理过的鹅红细胞反应(表2),说明这2株H6亚型AIVs仅能结合α2,3-唾液酸。

表2 P419和P339分别与经α2,3-唾液酸酶处理的鹅红细胞(GRBC)反应前后的HA滴度变化
2.6 对小鼠的感染性
将P419和P339鼻腔接种小鼠后,在剖检组织中均未发现肉眼病理变化。接种病毒3 d后,进行病毒分离滴定,仅在鼻甲中分离到病毒,在其他组织,如肺、脑、肝、脾组织中,均未分离到病毒(表3)。感染后小鼠体重变化轻微(图2)。

表3 P419和P339对小鼠的感染性
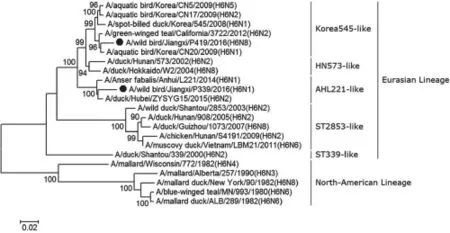
图1 两株H6病毒基因组遗传进化分析
3 讨论

图2 两株H6病毒感染后小鼠体重变化
野鸟是AIVs的自然储存库,病毒可随着宿主的迁徙传播给其他水禽和家禽。为进一步了解我国野鸟H6亚型AIVs的感染情况,2016年对鄱阳湖地区的野鸟进行了监测,共分离到2株病毒。序列分析表明,这2株病毒的HA裂解位点处仅有1个碱性氨基酸,属于低致病性病毒。HA受体结合位点分析表明,HA蛋白的第138、226、228位为倾向结合禽源受体的丙氨酸(A)、谷氨酰胺(Q)、甘氨酸(G)。受体结合试验也验证了这一点,它们仅能结合禽样受体。为进一步分析其生物学特性,对这2株病毒进行了小鼠感染性试验。结果表明:病毒可在BALB/c的鼻甲中限制性增殖,剖检组织中均无肉眼病理变化;小鼠体重变化轻微。这说明这2株病毒对BALB/c小鼠虽有一定的感染性,但致病性不强。
HA基因遗传进化分析结果显示,P419和P339分离株的HA基因分别属于Korea545-like和AHL221-like分支,不同于以前H6病毒常见的HN573-like、ST2853-like、ST339-like分支,说明H6病毒HA基因正经历着变异和进化。基因组分析表明,H6病毒经历了家禽和野鸟病毒间的广泛重组。该研究对于理解AIVs不同谱系之间基因交换、不同亚型AIVs之间的重组和进化具有重要的意义。
[1] YOON SW,WEBBY R J,WEBSTER R G. Evolution and ecology of influenza A viruses[J]. Curr Top Microbiol Immunol,2014,385:359-375.
[2] WEBSTER R G,BEAN W J,GORMAN O T,et al. Evolution and ecology of influenza A viruses[J]. Microbiol Rev,1992,56(1):152-179.
[3] FOUCHIER RA,MUNSTER V,WALLENSTEN A,et al. Characterization of a novel influenza a virus hemagglutinin subtype(H16)obtained from black-headed gulls[J]. J Virol,2005,79(5):2814-2822.
[4] JOURDAIN E,GUNNARSSON G,WAHLGREN J,et al. Influenza virus in a natural host,the mallard:experimental infection data[J]. PloS one,2010,5(1):e8935.
[5] WEBSTER R G,YAKHNO M,HINSHAW V S,et al. Intestinal influenza:replication and characterization of influenza viruses in ducks[J]. Virology,1978,84(2):268-278.
[6] SLEMONS R D,EASTERDAY B C. Virus replication in the digestive tract of ducks exposed by aerosol to type-A influenza[J]. Avian dis,1978,22(3):367-377.
[7] ROCHE B,LEBARBENCHON C,GAUTHIER-CLERC M,et al. Water-borne transmission drives avian influenza dynamics in wild birds:The case of the 2005–2006 epidemics in the Camargue area[J]. Infect Genet Evol,2009,9(5):800-805.
[8] WOROBEY M,HAN G Z,RAMBAUT A. A synchronized global sweep of the internal genes of modern avian influenza virus[J]. Nature,2014,508(7495):254-257.
[9] LIU D,SHI W,SHI Y,et al. Origin and diversity of novel avian influenza A H7N9 viruses causing human infection:phylogenetic,structural,and coalescent analyses[J]. Lancet,2013,381(9881):1926-1932.
[10] CHEN H,YUAN H,GAO R,et al. Clinical and epidemiological characteristics of a fatal case of avian influenza A H10N8 virus infection:a descriptive study[J]. Lancet,2014,383(9918):714-721.
[11] MA C,LAM T T,Chai Y,et al. Emergence and evolution of H10 subtype influenza viruses in poultry in China[J]. J Virol,2015,89(7):3534-3541.
[12] 蒋文明,宋建德,黄保续. 近期全球H5N8亚型禽流感疫情分析[J]. 中国动物检疫,2017,34(1):1-3.
[13] HOFFMANN E,STECH J,GUAN Y,et al. Universal primer set for the full-length amplification of all influenza A viruses[J].Arch Virol,2001,146(12):2275-2289.
[14] SUPTAWIWAT O,KONGCHANAGUL A,CHAN-IT W,et al. A simple screening assay for receptor switching of avian influenza viruses[J]. J Clin Virol,2008,42(2):186-189.
[15] 宋跃君,谭丹,邓国华,等. 湖南省洞庭湖区5株H6N6亚型禽流感毒株HA、NA基因的遗传进化分析[J]. 中国动物检疫,2016,33(1):9-12.
(责任编辑:朱迪国)
Phylogenetic Analysis on H6N1 and H6N8 Subtype Avian Influenza Virus Strains of Wild Bird-origin and Pathogenicity Study
Jiang Wenming,Li Jinping,Peng Cheng,Wang Suchun,Hou Guangyu,Chen Jiming
(China Animal Health and Epidemiology Center,Qingdao,Shandong 266032)
Objective to investigate the biological characteristics of two wild bird-origin H6 subtype(H6N1 and H6N8)avian influenza virus(AIV)strains,P419 and P339,which were isolated from wild bird feces in Poyang Lake of Jiangxi Province in 2016 the two isolated strains were sequenced,the receptor binding assay was conducted and the infectivity of the isolates were evaluated in BALB/c mice. Sequence analysis results showed that the two isolates belonged to different clades,and had experienced extensive recombination between different subtypes of AIV. Both of the isolates had a HA cleavage site of PQIETR/GLF,which was consistent with the characteristic of low pathogenic avian influenza virus. Both of the isolates had residues A138,Q226 and G228 at the HA receptor binding sites,suggesting these viruses have molecular characteristic of binding avian-like receptors. Receptor binding assay results showed that the two isolates could only bind avian-like receptors. The infectious experiments results in mice showed that the isolates were able to replicate only in the nasal turbinate of mice and mice had slight body weight change without apparent clinical symptoms,indicating that the two isolates could infect mice,but the pathogenicity could be relatively weak.
avian influenza virus;H6 subtype;wild birds;infectivity
S852.65
A
1005-944X(2017)04-0090-04
10.3969/j.issn.1005-944X.2017.04.026
科技部科技基础性工作专项(2012FY111000)
