外源抗坏血酸处理对人工脱涩柿果的保鲜作用
2017-05-30范灵姣孙宁静王坤张宇覃慧
范灵姣 孙宁静 王坤 张宇 覃慧

摘要: 該研究以广西中部地区的早熟品种‘牛心柿(Diospyros kaki cv. Niuxin)的果实为材料,研究果实萼片施用5%抗坏血酸溶液处理对CO2脱涩柿果采后贮藏期果实软化和细胞壁降解以及抗氧化体系等相关生理生化指标的影响。结果表明:抗坏血酸对人工脱涩后‘牛心柿果实的保鲜效果明显,与空白和去离子水对照相比,外源抗坏血酸处理更好地延缓柿果实硬度的降低和总色差的升高。抗坏血酸处理后7~15 d,原果胶的下降速率和可溶性果胶的上升速率得以延缓,细胞壁降解酶PG和Cx活性均低于空白和对照。同时,外源抗坏血酸阻滞了整个贮藏期果实内源抗坏血酸的减少,并抑制了POD的活性和MDA的积累,果实自身抗氧化体系功能受到保护。此外,抗坏血酸处理还在一定程度上提高了果实还原糖的含量。因此,采后外源施用抗坏血酸不仅可以延长脱涩后鲜食柿果的货架期,而且还有助于提高果实的商品品质。
关键词: 柿, 贮藏, 抗坏血酸, 保鲜, 品质
中图分类号: Q945.6
文献标识码: A
文章编号: 10003142(2017)05059908
Abstract: Most persimmon fruit are of the astringent type, due to their richness in soluble tannin at maturity. Astringent persimmons need an artificial deastringency treatment to become edible. Several of the common treatments, high CO2, alcohol, warm water, and ethylene all cause rapid fruit softening problems. Hence, keeping fruit freshness after deastringency is critical in the persimmon postharvest industry, and efficient fresh keeping methods are in urgent need for this area. The present study aimed to clarify the effect of exogenous ascorbic acid (AsA) treatment on persimmon fruit softening, cell wall degradation, and antioxidant system changes after CO2 deastringency, in order to develop the methods extending persimmon shelflife. Persimmon (Diospyros kaki cv. Niuxin) fruit harvested from middle part of Guangxi Zhuang Autonomous Region with routine CO2 astringency removal treatment was taken as experimental material, after treating fruit sepal with five percent AsA solution, changes of physiologic and biochemical indexes related to persimmon fruit softening, cell wall degradation, and antioxidant system were studied. The results showed that AsA treatment maximized ‘Niuxin Persimmon freshness. Exogenous AsA treatment produced higher firmness and lower total chromatism than either a blank or a control similarly treated with deionized water. From the seventh (7th) to the fifteenth (15th) days after treatment, AsA treatment delayed fruit protopectin decreasing rate and soluble pectin increasing rate, and treated fruit showed lower activity of cell wall degrading enzyme polygalacturonase (PG) and cellulase (Cx) than both of blank and control. During the whole storage period, the exogenous AsA treatment impeded the decrease of fruit endogenous AsA level, as well as better controlled peroxidase (POD) activity and malondialdehyde (MDA) accumulation, and the function of fruit antioxidant system was well protected. Additionally, the AsA treatment also enhanced reducing sugar content to a certain extent. Finally, the supplement postharvest AsA treatment extends persimmon shelflife after deastringency and improves fruit commodity quality. The present work proposes to explain the physiological mechanisms of the fruit softening regulation by exogenous AsA treatment, provides basal knowledge and evidence for development of new postharvest technologies, as well as offer guidelines to improving persimmon storability for the purpose of maintaining fruit quality in persimmon industry.
Key words: persimmon, storage, ascorbic acid, freshness, quality
涩柿果实中含有0.13%~1.54%的可溶性单宁,成熟采摘后涩不可食,需经过人工脱涩处理才能达到可食状态(董士远等,2002)。温水、乙醇、乙烯利、CO2等处理均为常用脱涩方法,其中CO2脱涩处理后果实果肉硬度相对较高(林菲,2013),因此目前生产上使用最为广泛。然而,脱涩后的柿果极易软化(Yin et al,2012),包括CO2处理后的果实,常温下一般5 d左右即软化至无法继续贮藏(Harima et al,2003;程青等,2015),导致鲜食柿果货架期缩短,商品价值下降,极大地限制了该果品的国内外运输、流通及销售。因此,开发简单易行且高效安全的保鲜技术对整个柿产业的发展具有重要意义。
抗坏血酸(Ascorbic acid,AsA)即维生素C(Vitamin C,Vc),是一种水溶性维生素,普遍存在于植物组织中,成熟柿鲜果中含量丰富,可达0.3 mg·g1(杨月欣等,2009)。同时,抗坏血酸也是植物体内重要的抗氧化剂,可清除·OH、O2-·、1O2以及H2O2等活性氧自由基(Reactive oxygen species,ROS),从而延缓组织衰老、减轻细胞膜损伤(Davey et al,2000;左玉等,2015)。近年来,研究发现外源抗坏血酸对采后杏(杜善保和邹养军,2007)、圣女果(刘锴栋等,2012)、龙眼(董乐,2012)、苹果(马春花等,2012)、李(Liu et al,2014)、猕猴桃(王静,2015)等果实有较好的保鲜作用,但在柿子上未见有相关报道。本研究以脱涩处理后的‘牛心柿为材料,通过向果实萼片(柿蒂)施用抗坏血酸,探讨外源抗坏血酸处理对柿果实的保鲜作用,为鲜食柿果的贮藏保鲜提供理论依据和技术参考。
1材料与方法
1.1 材料及处理
供试材料为早熟品种‘牛心柿,于2013年9月5日采自广西武宣县(平均果重168.43 g)。采收后即进行常规CO2脱涩处理(用金属密封脱涩罐:最大用果量3 000 kg,CO2气体浓度99.5%,罐内压强0.08 ~ 0.1 MPa,密封时间约20 h)。脱涩完成后,选取大小均匀、无病虫害、无机械伤果实样品运回广西大学园艺学院实验室。实验室温度为25 ℃(温度变幅控制在1 ℃以内),相对湿度为60%~70%。处理、观察和测定于2013年9月6-22日期间进行。
试验共设3个处理组,每组用果量为60个。第1组为外源抗坏血酸(AsA)处理,配制浓度为5%(质量体积百分比w/v)的AsA溶液,使用脱脂棉(长50~60 mm、宽50~60 mm、厚5~15 mm)蓄积配制的AsA溶液5 mL,将柿果实果顶朝上、萼片朝下放置于脱脂棉上,柿果萼片区域与脱脂棉完全接触充分贴合。在贮藏期每2天更换脱脂棉并补加等量新配制的AsA溶液。第2组为去离子水处理,采用上述同样方法进行的去离子水处理为对照。第3组为未做任何处理的空白。处理后对室温下贮藏果实进行观察测定,并对果实赤道部分的果肉组织取样,-80 ℃保存,用于果实生理指标分析。
1.2 测定指标及方法
果肉硬度测定采用FHM5硬度计(日本,TAKEMURA公司)进行,测定探头为圆锥形(基部直径12 mm,高10 mm),每种处理每次测定8个果,果实去皮后选取赤道部4个对称点进行单果测定。果实色差采用CR10色差计测定(日本,KONICA MINOLTA公司),每种处理每次固定10个果测定,选取果实赤道部相反方向的2个点进行单果测定,得到L、a、b值,计算总色差ΔE(ΔE值大表示果实后熟转色加剧),ΔE= [(ΔL)2+(Δa)2+(Δb)2]1/2(设起始第0天的L、a、b值为标准值,测定值与标准值之差即为ΔL、Δa、Δb值)。
果胶含量测定采用咔唑比色法, 抗坏血酸含量
测定采用2,6二氯靛酚钠滴定法,还原糖含量测定采用3,5二硝基水杨酸法,可滴定酸含量测定采用酸碱滴定法,多聚半乳糖醛酸酶(PG)、纤维素酶(Cx)、过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性以及丙二醛(MDA)含量测定采用比色法,以上方法均参照曹建康等(2007)的测定方法。可溶性固形物含量测定采用ATC32型手持糖量计(中国,上海淋誉公司)。可溶性单宁含量测定参照陈湘宁等(2004)的无水甲醇法,用无水甲醇提取柿果肉单宁,在270 nm波长下测定吸光度值,根据标准曲线回归方程计算可溶性单宁含量。以上生理指标,每种处理每次测定取样均为3次生物学重复,每次重复3个果。
所有数据用Microsoft Excel 2013软件处理,统计分析采用最小显著差异法(LSD,P<0.05)进行。
2结果与分析
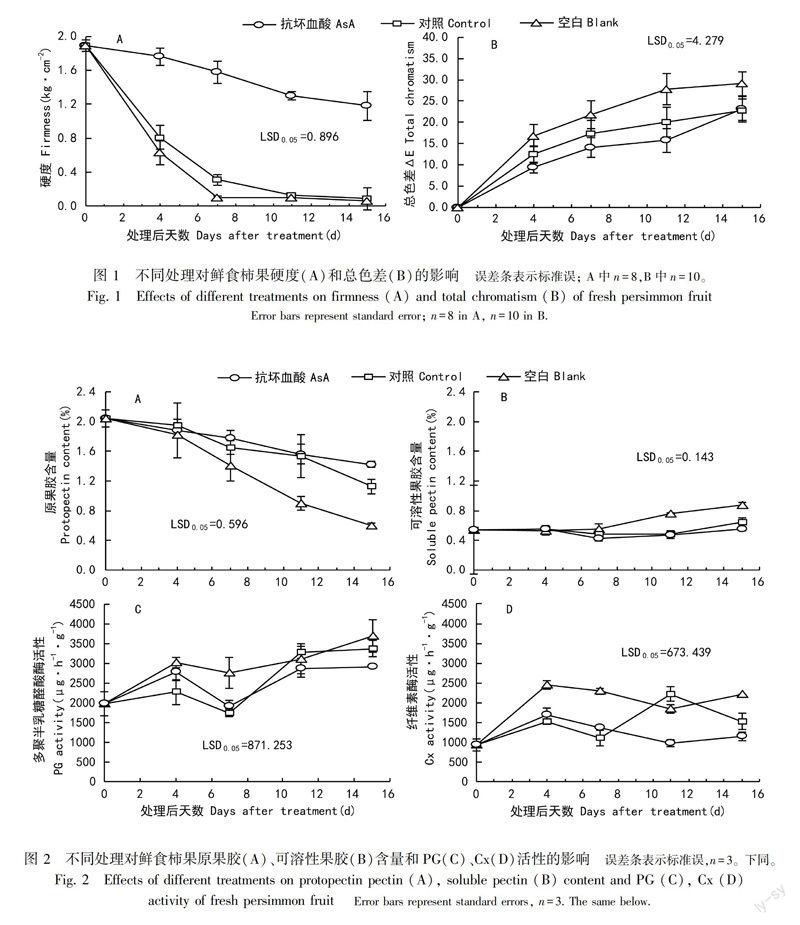
2.1 AsA处理对贮藏期果实硬度和颜色的影响
从图1:A可以看出,贮藏期对照和空白果实硬度急剧降低,处理后4 d分别降至0.81和0.63 kg·cm2,AsA处理的果实硬度下降缓慢,处理后4 d硬度值为1.76 kg·cm2 ,与贮藏起始硬度值1.89 kg·cm2差异不显著,处理后15 d硬度值仍保持为1.18 kg·cm2,高达对照(0.09 kg·cm2)的13倍。这表明AsA处理保持果实长时间的高硬度,显著地延緩了果实软化。
从图1:B可以看出,在以起始第0天的L、a、b值为标准的基础上,总色差ΔE值从0逐渐增大,表明果实果皮颜色加深。处理后11 d空白ΔE值快速增高至27.75,对照ΔE值增至20.04,AsA处理的果实ΔE值最低,为15.77,表明AsA处理抑制了果实的后熟转色。
2.2 AsA处理对贮藏期果实原果胶、可溶性果胶含量和PG、Cx活性的影响
从图2:A可以看出,贮藏期柿果实原果胶含量呈下降趋势。空白果实原果胶含量降幅最大,对照次之,AsA处理降幅最小,处理后15 d,AsA处理果实的原果胶含量为1.42%,为空白的2.4倍。图2:B显示,贮藏期柿果实可溶性果胶含量逐渐升高,处理后4 d空白果实的可溶性果胶含量继续升高,对照和AsA处理则先略降低后略升高。处理后15 d AsA处理果实的可溶性果胶含量(0.56%)与贮藏起始值基本一致(0.54%),空白则达到0.88%,为AsA处理的1.6倍。以上结果表明,AsA处理柿果实保持较高的原果胶含量和较低的可溶性果胶含量,抑制果实中原果胶降解为可溶性果胶,维持细胞壁结构完整,延缓果肉硬度降低。
从图2:C可以看出,贮藏期柿果实的PG活性先升高后降低再升高。处理后7 d对照和AsA处理的果实PG活性降至最低(1 750.29和1 913.84 μg·h1·g1),明显低于空白(2 765.07 μg·h1·g1),处理后15 d空白果实PG活性最高,AsA处理最低。图2:D显示,贮藏期柿果实Cx活性变化趋势与PG一致。贮藏起始柿果实的Cx活性为937.27 μg·h1·g1,处理后15 d AsA处理为1 147.32 μg·h1·g1,空白升高至2 212.52 μg·h1·g1,是AsA处理的1.9倍。二者结果表明,AsA处理在贮藏中后期明显抑制了PG和Cx的活性,同时对Cx活性的抑制作用强于对PG活性的抑制。
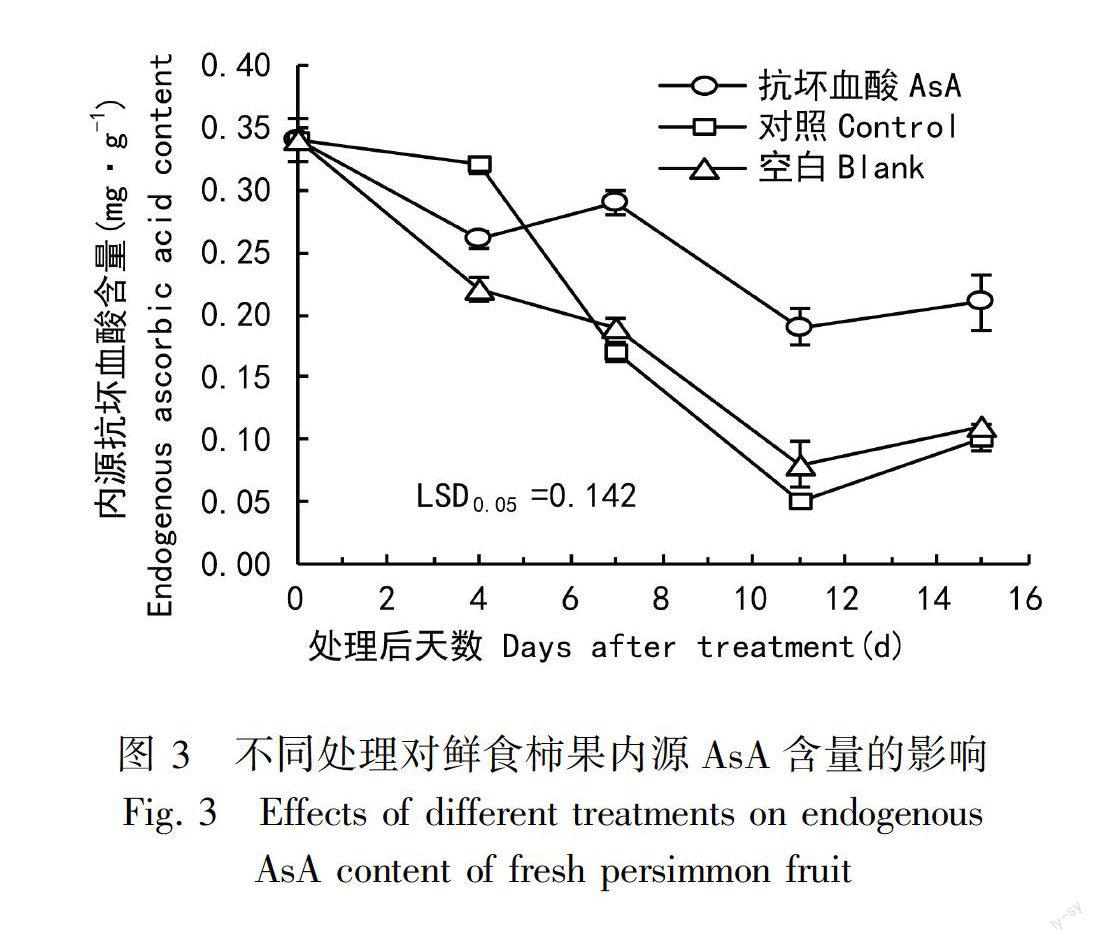
2.3 AsA处理对贮藏期果实内源AsA含量的影响
从图3可以看出,贮藏期柿果实的内源AsA含量呈下降趋势。贮藏起始值为0.34 mg·g1,处理后11 d各处理均降为最低,对照为0.05 mg·g1,空白为0.08 mg·g1,AsA处理为0.19 mg·g1(是对照和空白的3.5倍和2.4倍)。此外,AsA处理的果实内源AsA含量在处理后4~7 d期间升高后降低,贮藏后期一直保持较高水平。这说明外源AsA处理显著抑制果实内源AsA含量的降低。
2.4 AsA处理对贮藏期果实POD、CAT、SOD活性及MDA含量的影响
图4:A显示,贮藏期空白果实的POD活性持续升高,处理后15 d达最高值(84.86 ΔOD470·min1·g1),说明果实体内自由基积累加剧,导致果实快速衰老。对照果实POD活性处理后4 d上升到最高随后下降,15 d降至21.64 ΔOD470·min1·g1,表明水分对控制自由基积累有一定作用。AsA处理果实的POD活性,在贮藏期始终处于低水平,说明AsA处理有效抑制自由基积累,延缓果实衰老软化。
从图4:B,C可以看出,处理后7~15 d AsA处理果实的CAT活性和SOD活性高于空白,低于对
照。这表明与空白相比,AsA处理抑制了CAT和SOD活性的降低,但该抑制作用与对照的去离子水处理相比并不明显。
从图4:D可以看出,贮藏期柿果实MDA含量呈上升趋势。空白果实MDA含量上升幅度最大,处理后11 d达到峰值(2.69×103 μmol·g1)。AsA处理与对照果实的MDA积累不明显,且含量明显低于空白,处理后11 d对照MDA含量为0.96×103 μmol·g1,AsA处理MDA含量为0.69×103 μmol·g1。这表明AsA和去离子水处理均能抑制MDA的积累,减轻细胞膜脂的过氧化,延缓果实衰老。
2.5 AsA处理对贮藏期果实可溶性单宁、还原糖、可溶性固形物和可滴定酸含量的影响
贮藏期,AsA处理果实的可溶性单宁含量有所上升,贮藏起始值为0.34 mg·g1,处理后15 d为0.50 mg·g1,空白和对照果实的可溶性单宁含量无明显变化(图5:A)。AsA处理15 d果实的可溶性固形物和还原糖含量均高于空白和对照(图5:B,C)。AsA处理果实的可滴定酸含量先显著下降后明显回升,总体下降幅度小于对照,大于空白(图5:D)。
3讨论
3.1 外源AsA处理与柿果实软化的关系
鲜食柿果在采摘并经脱涩处理后极易软化,贮藏性下降,货架期缩短。本研究中,通过对果实萼片施用AsA,有效延缓了贮藏期柿果实硬度的降低和总色差的升高。处理后7~15 d,原果胶含量高于空白和对照,可溶性果胶含量低于空白和对照,并且细胞壁降解酶PG和Cx活性低于空白和对照。柿果实后熟过程中硬度的降低伴有果胶组分大量降低以及果胶降解,即胞间层组分原果胶逐渐降解为可溶性果胶(Dawson et al,1992),同時发生多聚半乳糖醛酸骨架水解和其他交联多糖的水解(CutillasIturralde et al,1993),说明软化期间存在着细胞壁降解酶的作用。田建文等(1991)认为柿果实软化可能是细胞壁水解酶的作用,其中主要是PG和Cx的作用,且PG的作用比Cx的作用大;赵博和饶景萍(2005)的研究表明,PG和Cx活性的增加与柿果肉硬度的下降呈负相关,认为PG和Cx都是引起柿果实软化的关键酶;姜妮娜等(2010)进一步表明PG基因DkPG1的表达受乙烯调控,进而调控柿果实的成熟衰老。本研究结果证实,AsA处理可显著抑制柿果实原果胶降解为可溶性果胶,并在贮藏中后期(处理后7~15 d)降低PG和Cx活性,从而保持果实长时间的高硬度,抑制其后熟软化。
3.2 外源AsA处理与果实内源AsA及自身抗氧化酶体系的关系
抗坏血酸(维生素C,Vc)是人体不可或缺的营养物质,也是植物体内重要的抗氧化剂,对果实贮藏期间的保鲜起重要作用(Smirnoff,1996)。但随着果实的成熟软化,其Vc含量会逐渐降低(马李一等,2004)。本研究结果显示,外源AsA处理明显阻滞了柿果实内源AsA含量的下降。这与杜善保和邹养军(2007)在杏果实、董乐(2012)在龙眼、刘锴栋等(2012)在圣女果、马春花等(2012)在苹果、Liu et al(2014)在李果实以及王静(2015)在猕猴桃的研究结果一致。
果实成熟软化过程中ROS会发生积累,可能是影响果实成熟软化的重要因素(Novillo et al,2014)。Duan et al(2011)研究发现在果实软化过程中活性氧会对细胞壁多糖进行攻击,可能是导致果实软化的另一因素。在利用CO2脱涩柿果实的过程中,因高浓度CO2造成低氧胁迫,导致ROS大量积累,诱使相关代谢酶活性升高(Novillo et al,2014;李莹等,2015)。本研究中,AsA处理的柿果实POD活性始终处于低水平,显著低于空白和对照。说明外源AsA可能通过调控果实内源AsA,利用强抗氧化性对抗果实内部ROS的积累,抑制逆境胁迫下POD的启动,延缓果实衰老。AsA处理果实的CAT和SOD活性在贮藏中后期高于空白,低于对照,说明控制失水胁迫对调节柿果实的抗氧化酶体系具有一定作用。另外,本研究中,MDA作为细胞膜脂过氧化作用的主要产物,在AsA处理后的柿果实中也呈现低水平状态,说明果实内多余的自由基得以被清除,细胞膜结构较为完整。
3.3 外源AsA处理与果实贮藏品质的关系
果实贮藏品质的好坏关系到商品价值的高低。本研究结果表明,AsA处理的果实可溶性固形物含量和还原糖含量高于空白和对照,还原糖含量在贮藏期明显升高,果品贮藏品质较好。此外,AsA处理柿果实可溶性单宁含量有所上升,但仍远低于涩味感知阈值1 mg·g1。因此,食用不会有涩感(Yamada et al,2002)。
综上所述,外源AsA处理对鲜食柿果具有良好的保鲜作用。一方面,外源AsA可抑制PG和Cx活性的升高,从而减缓原果胶转化为可溶性果胶,维持细胞壁结构完整,保持柿果肉长时间的高硬度;另一方面,外源AsA可能通过维持较高的内源AsA含量对抗果实内部积累的ROS,从而保护细胞膜和细胞壁,延缓果实后熟软化。
参考文献:
CHENG Q, LIANG PZ, LI Y, et al, 2015. Effects of 1MCP on fruit softening and cell wall component variation of persimmon variety treated with CO2 [J]. J Chin Agric Univ, 20(4):92-99. [程青,梁平卓,李莹,等,2015. 1-甲基环丙烯和CO2组合处理抑制柿果实脱涩软化的效应及其细胞壁成分的变化 [J]. 中国农业大学学报,20(4):92-99.]
CUTILLASITURRALDE A, ZARRA I, LORENCES EP, 1993. Metabolism of cell wall polysaccharides from persimmon fruit. Pectin solubilization during fruit ripening occurs in apparent absence of polygalacturonase activity [J]. Physiol Plant, 89:369-375.
CAO JK, JIANG WB, ZHAO YM, 2007. Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables [M]. Beijing: China Light Industry Press. [曹建康,姜微波,赵玉梅,2007. 果蔬采后生理生化实验指导 [M]. 北京:中国轻工业出版社.]
CHEN XN, HUANG MQ, QI JH, 2004. Study on the measurement of persimmon tannins content with sodium carbonatephenol solution [J]. Food Sci Technol, (5):62-66. [陈湘宁,黄漫青,綦菁华,2004. 碳酸钠-苯酚溶液测定柿子中单宁含量方法的研究 [J]. 食品科技,(5):62-66.]
DONG SY, ZHANG P, JI SJ, 2002. Effect of removing astringency with CO2 on storage and quality of persimmon fruit [J]. Food Sci, 23(10):105-109. [董士远,张平,纪淑娟,2002. CO2脱涩处理对柿果贮藏品质的影响 [J]. 食品科學,23(10):105-109.]
DUAN X, ZHANG H, ZHANG D, et al, 2011. Role of hydroxyl radical in modification of cell wall polysaccharides and aril breakdown during senescence of harvested longan fruit [J]. Food Chem, 128:203-207.
DONG L, 2012. Effect of exogenous ascorbic acid treatment on longan freshkeeping [J]. J Zhejiang Agric Sci, (11):1557-1562. [董乐,2012. 外源抗坏血酸对龙眼保鲜效果的影响 [J]. 浙江农业科学,(11):1557-1562.]
DU SB, ZOU YJ, 2007. Effect of exogenous ascorbic acid treatment on postharvest senescence of apricot fruit [J]. Shaanxi J Agric Sci, (5):37-151. [杜善保,邹养军,2007. 外源抗坏血酸对杏果实采后衰老的影响 [J]. 陕西农业科学,(5):37-151.]
DAWSON DW, MELTON LD, WATKINS CB, 1992. Cell wall changes in nectarines (Prunus persica): Solubilization and depolymerzation of pectic and neutral polymers during ripening and in mealy fruit [J]. Plant Physiol, 100:1203-1210.
HARIMA S, NAKANO R, YAMAUCHI S, et al, 2003. Extending shelflife of astringent persimmon (Diospyros kaki Thunb.) fruit by 1MCP [J]. Postharv Biol Technol, 29(3):319-324.
JIANG NN, RAO JP, FU RS, et al, 2010. Effects of propylene and 1Methylcyclopropene on PG activities and expression of DkPG1 gene during persimmon softening process [J]. Acta Hortic Sin, 37(9):1507-1512. [姜妮娜,饒景萍,付润山,等,2010. 柿果实采后软化中PG酶活性及其基因DkPG1的表达 [J]. 园艺学报,37(9):1507-1512.]
LI Y, CHENG Q, LI R, et al, 2015. Influence of 1MCP on reactive oxygen species content and scavenger enzyme activity in persimmon fruit treated with CO2 [J]. J Fruit Sci, 32(3):494-501. [李莹,程青,李冉,等,2015. 1-MCP对CO2处理‘磨盘柿果实活性氧含量及清除酶活性的影响 [J]. 果树学报,32(3):494-501.]
LIU KD, YUAN CC, CHEN Y, et al, 2014. Combined effects of ascorbic acid and chitosan on the quality maintenance and shelf life of plums [J]. Sci HortAmsterdam, 176:45-53.
LIN F, 2013. Studies on freshkeeping and postharvest deastringency handles of persimmon fruit [D]. Fuzhou: Fujian Agriculture and Forestry University. [林菲,2013. 柿子保鲜及脱涩技术研究 [D]. 福州:福建农林大学.]
LIU KD, JING GX, YUAN CC, et al, 2012. Effect of ascorbic acid treatment on physiology and antioxidants of cherry tomato fruits during storage [J]. Chin J Trop Crops, 33(10):1851-1855. [刘锴栋,敬国兴,袁长春,等,2012. 外源抗坏血酸对圣女果采后生理和抗氧化活性的影响 [J]. 热带作物学报,33(10):1851-1855.]
MA LY, GAN J, YING N, et al, 2004. Study on Prunus salicina L. storage and preservation with natural coating preservation agents [J]. Food Ferm Ind, 7(30):135-138. [马李一,甘瑾,殷宁,等,2004. 天然涂膜保鲜剂对青脆李的贮藏保鲜作用 [J]. 食品与发酵工业,7(30):135-138.]
MA CH, ZHANG M, LI MJ, et al, 2012. Influence of exogenous ascorbic acid on postharvest ripening and AsAGSH cycles in apple fruit [J]. J Yunnan Agric Univ, 27(3):384-390. [马春花,张敏,李明军,等,2012. 外源AsA对苹果果实采后衰老及AsAGSH循环的影响 [J]. 云南农业大学学报,27(3):384-390.]
NOVILLO P, SALVADOR A, MAGALHAES T, 2014. Deastringency treatment with CO2 induces oxidative stress in persimmon fruit [J]. Postharv Biol Technol, 92:16-22.
SMIRNOFF N, 1996. The function and metabolism of ascorbic acid in plants [J]. Ann Bot, (78):661-669.
TIAN JW, XU MX, HE PC, 1991. The physiological analysis on softness of postharvest persimmon (brief report) [J].Plant Physiol Comm, 2(12):109-111. [田建文,许明宪,贺普超,1991. 柿果实采收后软化生理分析(简报) [J]. 植物生理学通讯,2(12):109-111.]
WANG J, 2015. Influence of exogenous ascorbic acid on physiology and quality of postharvest kiwi fruit [J]. Shaanxi J Agric Sci, 61(9):37-41. [王靜,2015. 外源抗坏血酸(AsA)对采后猕猴桃果实生理和品质的影响 [J]. 陕西农业科学,61(9):37-41.]
YAMADA M, TAIRA S, OHTSUKI M, et al, 2002. Varietal differences in the ease of astringency removal by carbon dioxide gas and ethanol vapor treatments among oriental astringent persimmons of Japanese and Chinese origin [J]. Sci HortAmsterdam, 94:63-72.
YIN XR, SHI YN, MIN T, et al, 2012. Expression of ethylene response genes during persimmon fruit astringency removal [J]. Planta, 235:895-906.
YANG YX, WANG GY, PAN XC, 2009. China food composition: Book 1 [M]. Beijing: Peking University Medical Press, 2:71. [杨月欣,王光亚,潘兴昌,2009. 中国食物成分表:第1册 [M].北京:北京大学医学出版社,2:71.]
ZUO Y, FENG LX, JIA ZH, 2015. The direction of research and development of vitamins [J]. Cereals Oils, 28(9):1-5. [左玉,冯丽霞,贾泽慧,2015. 维生素类化合物的研究进展 [J]. 粮食与油脂,28(9):1-5.]
ZHAO B, RAO JP, 2005. Changes of cellwall polysaccharides and their catabolic enzyme activities of persimmon fruits during postharvest [J]. Acta Bot BorealOccident Sin, 25(6):1199-1202. [赵博,饶景萍,2005. 柿果实采后胞壁多糖代谢及其降解酶活性的变化 [J]. 西北植物学报,25(6):1199-1202.]
