丙酮丁醇梭菌复合诱变及发酵废弃物原料产生物丁醇的研究
2017-05-30毛碧飞,袁丽霞陈祥松孙立洁朱微微吴金勇刘伟伟
毛碧飞,袁丽霞 陈祥松 孙立洁 朱微微 吴金勇 刘伟伟


摘要[目的]通过废弃资源的再利用研究可替代的新型生物燃料——丁醇的发酵培养基。[方法]对菌株Clostridium acetobutylicum CGMCC 1.0134进行紫外诱变和磁场与Fe2+共同诱变,获得1株丁醇产量高和稳定性好的优良突变株Clostridium acetobutylicum UM-80,采用不同的废弃原料考察该突变菌株的发酵性能,并筛选出合适的性价比高的培养基。[结果]突变株UM-80发酵产丁醇和总溶剂(丙酮、丁醇、乙醇)分别为9.04、17.95 g/L,较原始菌株分别提高了5.12%、4.12%。单独的蕨根是较好的丁醇发酵原料,当蕨根醪质量分数为15%时发酵液中丁醇浓度最高为5.50 g/L。当高山被孢霉与蕨根共同发酵时发酵液中丁醇最高产量为6.50 g/L。[结论]蕨根与高山被孢霉的复合培养基是较好的生物丁醇发酵培养基。
关键词丙酮丁醇梭菌;复合诱变;废弃物原料;丁醇
中图分类号S216文献标识码A文章编号0517-6611(2017)05-0001-03
Abstract[Objective] The aim was to study better fermentation medium for new type biofuel butanol through recycling waster resources.[Method] Clostridium acetobutylicum UM80, a mutant with high butanol yield and good stability, was obtained by ultraviolet mutagenesis and comutagenesis with Fe2+ by Clostridium acetobutylicum CGMCC 1.0134.Then the different fermentation materials were used to study the fermentation performance of the mutant strains, and the suitable medium with high cost performance was found out. [Result] The yield of butanol and total solvent (acetone, butanol, ethanol) were 9.04 and 17.95 g/L, respectively, which were 5.12% and 4.12% higher than those of the original strain. The fern root was the best raw material for the fermentation of butanol; when the mass fraction of fern root was 15%, the concentration of butanol in fermentation broth was 5.50 g/L. When the cofermentation of Mortierella alpina and fern root, the highest yield was 6.50 g/L.[Conclusion] The cofermentation of Mortierella alpina and fern root is better fermentation medium for butanol.
Key wordsClostridium acetobutylicum;Compound mutagenesis;Waste raw material;Butanol
基金項目合肥物质科学技术中心方向项目培育基金(2014FXCX006);安徽省淮南市科技计划项目(2014A15);中国科学院合肥分院等离子体物理研究所科学基金(DSJJ-15-YY02)。
作者简介毛碧飞(1991—),女,安徽铜陵人,硕士研究生,研究方向:微生物育种及发酵工艺。
通讯作者:袁丽霞,工程师,博士,从事生物质能源与开发利用研究;刘伟伟,副教授,博士,从事生物质能源与开发利用研究。
收稿日期2016-12-28
随着化石燃料资源供给日益紧张以及人类环境保护意识的不断提高,生物质成为全球优先发展的战略[1]。乙醇被认为是一种可替代的燃料物质。除乙醇之外,丁醇被认为是另一种潜在的可替代的新型生物燃料,无论是燃烧值还是辛烷值,与汽油最为接近[2]。此外,丁醇还具备许多优于生物乙醇的特点,如亲水性弱、腐蚀性小、便于管道输送,且能与汽油任意比混合,无需对汽车发动机进行改造,将是替代汽油最理想的生物燃料。
近年来,由于人口增长、耕地减少、生物炼制行业迅速发展等因素的影响,粮食类原料的价格不断攀升,导致丁醇发酵的生产成本大幅提高[3]。研究者采用多种非粮作物或农业废弃物为原料进行丁醇发酵,包括木薯、玉米秸秆等[4]。笔者采用紫外和磁场与Fe2+共同诱变的复合诱变选育丙酮丁醇高产突变株,并探讨了使用蕨根、苹果渣、餐厨废弃物进行发酵,同时在蕨根中添加高山被孢霉干菌体进行了共同发酵,以期寻找较好的替代原料。
1材料与方法
1.1材料
1.1.1菌种。菌株Clostridium acetobutylicum CGMCC 1.0134购自中国微生物菌种保藏中心。
1.1.2培养基。
PYG培养基:多胨5.0 g,胰胨5.0 g,酵母提取物10.0 g,葡萄糖10.0 g,盐溶液40 mL(盐溶液配方:CaCl2 0.2 g,MgSO4·7H2O 0.4 g,K2HPO4 1.0 g,KH2PO4 10.0 g,NaHCO3 10.0 g,NaCl 2.0 g,蒸馏水1 L),蒸馏水960 mL,琼脂5.0 g,pH 6.5~7.0,121 ℃灭菌20 min。
筛选培养基 Ⅰ:TYA培养基添加少量刃天青(氧化还原指示剂)。筛选培养基 Ⅱ:PYG培养基中的葡萄糖用可溶性淀粉替换,添加少量2-脱氧-D-葡萄糖[5]。
种子培养基:5%的玉米醪。发酵培养基:15%的玉米醪[6]。
1.2方法
1.2.1紫外诱变。
将培养48 h平板上的菌全部刮下,置于铺满玻璃珠的50 mL 0.9%生理盐水中,得30 mL原始单孢子悬液。将单孢子悬液用0.9%生理盐水或无菌水调整浓度为1.5×108个/mL。加3 mL单孢子悬液于直径9 cm平皿中,开盖置于15 W紫外灯30 cm处照射,在暗室边搅拌边照射0、90、180、270、360 s,用黑布包裹,置于黑暗处至少2 h。诱变结束后,用无菌水稀释孢子悬液至浓度为1×10-5、1×10-6、1×10-7个/mL,混合均匀,每个浓度菌悬液各涂3块平板,37 ℃培养5 d,统计菌落数并计算致死率[6]。
1.2.2磁场诱变和Fe2+共同诱变。
将培养48 h平板上的菌全部刮下,置于铺满玻璃珠的50 mL 0.9%生理盐水中,得30 mL原始单孢子悬液。将单孢子悬液用0.9%生理盐水或无菌水调整浓度为1.5×108个/mL。单孢子菌悬液分别加入0.001%、0.010%、0.050%、0.100%、1.000%的Fe2+溶液,置于0.5 T磁场中37 ℃摇床培养进行诱变。诱变结束后,用无菌水稀释孢子悬液至浓度为1×10-5、1×10-6、1×10-7个/mL,每个浓度菌悬液各涂3块平板,37 ℃培养5 d,统计菌落数并计算致死率。CK:菌悬液直接在37 ℃下厌氧培养3 d;CK1:菌悬液置于0.5 T磁场中3 h,然后置于37 ℃下厌氧培养3 d;CK2:向菌悬液分别加入质量分数为0001%、0010%、0.050%、0.100%、1.000%的Fe2+溶液,再置于05 T磁场中3 h,然后置于37 ℃厌氧培养3 d。
1.2.3高产突变菌株的可视化筛选。
在筛选培养基 Ⅰ 上进行初筛,将涂布后的平板倒置于厌氧培养箱中,37 ℃培养72 h,挑取生长较好的单菌落继续培养,进行复筛。
1.2.4遗传稳定性试验。
将筛选得到的高产丁醇菌接到种子培养基中,37 ℃厌氧培养3 d作为F1代,然后连续继代6次,得到F2、F3、F4、F5、F6、F7代,并且在继代的同时将各代菌株接种到发酵培养基中,37 ℃厌氧培养72 h,采用气相色谱测定发酵液中丙酮、丁醇和乙醇含量,根据测定结果判断其稳定性。
1.2.5发酵液中溶剂及有机酸浓度测定方法。
采用气相色谱测定。气相色谱条件:色谱柱为安捷伦HP-INNOWAX,30 m×0.25 mm;检测器为FID;N2为载气,流速为35 mL/min,H2流速为30 mL/min,空气流速为400 mL/min;初始柱温为40 ℃,升至70 ℃,保留1 min,升至140 ℃,然后升至200 ℃;进样口温度为160 ℃;检测器温度为220 ℃;进样量为0.4 μL,内标法定量[7]。
1.2.6发酵液残糖测定。
采用SBA-40D生物传感分析仪测定葡萄糖浓度。
1.2.7生物量测定。
采用TCA反复冻溶法测定。
1.2.8致死率計算。
致死率=诱变前活菌数-诱变后活菌数〖〗诱变前活菌数×100%
2结果与分析
2.1诱变及突变株的筛选
2.1.1紫外诱变剂量的选择。
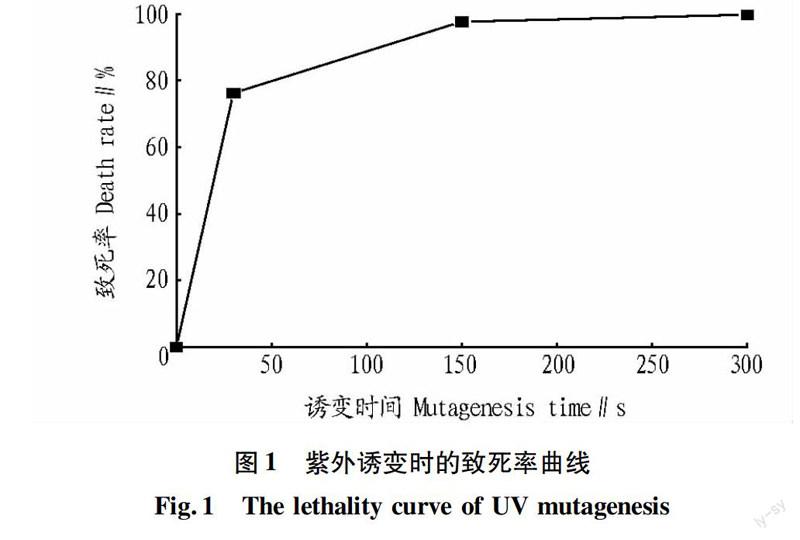
由图1可知,紫外照射时间增加,菌体的致死率也随之升高。在初期致死率升高较快,但在60 s之后,随着照射时间的增加菌体致死率变化幅度逐渐下降。60 s时,致死率已达85.0%;150 s时,致死率达976%。根据经验,致死率在80.0%~90.0%的处理效果较佳,所以选择致死率为85.0%时的60 s作为处理时间。
2.1.2磁场与Fe2+共同诱变的剂量选择。
由图2可知,单独的Fe2+对菌体生长有一定的抑制作用,但单独的磁场对菌体无抑制作用。当磁场和Fe2+共同作用菌体时,对菌体生长有严重的抑制作用。由图3可知,当Fe2+浓度达0050%时,致死率在850%以上。因此,以浓度0050%作为Fe2+诱变剂量。
2.1.3可视化筛选。
刃天青是氧化还原指示剂,通过刃天青的变色情况可以得到菌产还原力的情况,当菌产还原力强时刃天青呈无色,当菌产还原力弱时呈红色。因为丙酮丁醇梭菌在生产丁醇的代谢途径中需要还原力的参与,所以当菌产还原力的能力强时,可以间接判定菌的产丁醇能力强。同时刃天青培养基对菌株生长有抑制作用,试验结果表明,050 g/L刃天青的添加量为其对菌株的最小抑制浓度,所以采用0.50 g/L刃天青对培养基进行菌初筛。2-脱氧-D葡萄糖(DOG)是淀粉的分解代谢阻遏物,若菌能在有2-脱氧-D葡萄糖的培养基中生长,说明菌克服了分解代谢阻遏,过量表达淀粉酶。试验结果表明,2-脱氧-D葡萄糖010 g/L的添加量为其对菌株的最小抑制浓度,所以采用010 g/L 2-脱氧-D葡萄糖对培养基进行菌初筛。
2.1.4高产丁醇突变株的选育及突变株UM-80遗传稳定性检测。
出发菌株紫外诱变后经筛选培养基初筛和摇瓶发酵复筛后,获得1株性能优良的突变株,命名为Clostridium acetobutylicum UM-80。在玉米醪发酵培养基中发酵72 h,丁醇产量为9.04 g/L,总溶剂产量为17.95 g/L。丁醇和总溶剂的产量较原始菌株分别提高了5.12%和4.12%。突变株UM-80经6次传代获得的7代菌株(F1~F7)发酵特性无明显变化,说明该突变菌株遗传稳定性好,适合进一步研究。
2.2高产突变株UM-80发酵培养基的优化
2.2.1种龄对发酵的影响。
由图4可知,UM-80在24~42 h处于对数生长期,54 h菌体浓度达到最高,但在60 h时菌的浓度迅速下降,有可能是菌受到溶剂毒害,裂解死亡。接种时,选取36 h处于对数生长期的菌作为种液。
2.2.2蕨根醪初始浓度对发酵的影响。
调整蕨根醪初始浓度,其他成分不变,研究蕨根醪初始浓度对溶剂产量的影响。由图5可知,当蕨根醪质量分数为15%时,发酵液中丁醇浓度最高,为5.50 g/L;当蕨根醪浓度低于15%时,发酵液丁醇产量较低,可以推测此时发酵液中碳源、氮源及其他营养物质不充分,发酵溶剂产量不高;当蕨根醪浓度大于15%时,丁醇产量开始下降,此时很可能是蕨根醪黏稠度增大,影響发酵液传质过程。
2.2.3不同浓度高山被孢霉干菌体和蕨根醪对发酵的影响。
蕨根中含丰富的淀粉,但缺乏其他营养物质。高山被孢霉干菌体来自于中国科学院合肥物质科学研究院等离子体物理研究所实验室发酵废弃物,含有丰富的营养物质,包括蛋白质、油脂、其他生长因子等。该研究将高山被孢霉干菌
体添加到蕨根醪培养基中,考察其对发酵的影响。由图6可知,当高山被孢霉干菌体浓度为0.60 g/L时,发酵液中丁醇浓度为6.50 g/L。当高山被孢霉干菌体的浓度在0~0.60 g/L时,发酵液中丁醇产量呈上升趋势,可以发现高山被孢霉干菌体对于蕨根发酵丁醇的确有促进作用。当高山被孢霉干菌体的浓度高于0.60 g/L时,发酵液中丁醇浓度呈下降趋势,推测可能是高山被孢霉中营养物质如氮源类浓度过高而无法被利用,并出现轻微抑制现象。
3结论
采用紫外线和磁场与Fe2+共同诱变的复合诱变丙酮丁醇梭菌,同时结合有效的筛选,选育出有良好遗传稳定性的高产突变株UM-88。使用玉米醪作为发酵培养基时,丁醇和总溶剂产量分别为9.04和17.95 g/L。在使用不同浓度蕨根醪作为发酵培养基时,发现当蕨根醪质量分数为15%时,发酵液中丁醇浓度最高为5.50 g/L。当在质量分数为15%的蕨根醪中添加不同浓度高山被孢霉干菌体,高山被孢霉干菌体浓度为060 g/L时,发酵的最终丁醇产量最高为6.50 g/L。
由此可见,蕨根与高山被孢霉的复合培养基是很好的生物丁醇发酵培养基,且都是废弃资源的再利用。
45卷5期毛碧飞等丙酮丁醇梭菌复合诱变及发酵废弃物原料产生物丁醇的研究
参考文献
[1] 陈丽杰,辛程勋,邓攀,等.丙酮丁醇梭菌发酵菊芋汁生产丁醇[J].生物工程学报,2010,26(7):991-996.
[2] 范俊辉,冯文亮,邸胜苗,等.利用甜菜糖蜜补料发酵生产丁醇[J].生物加工过程,2010,8(6):6-9.
[3] 王风芹,原欢,楚乐然,等.玉米秸秆水解液燃料丁醇发酵条件优化研究[J].食品与发酵工业,2010,36(10):79-83.
[4] 马晓建,张霞,常春.丙酮丁醇梭菌发酵玉米秸秆生产丁醇[J].华南理工大学学报(自然科学版),2014,42(2):27-32.
[5] 李汉广.高产丁醇菌株选育及其耐受丁醇机制研究[D].无锡:江南大学,2014.
[6] 田毅红,朱志豪,高媛,等.红薯发酵产丁醇的工艺优化[J].化学与生物工程,2016,33(2):64-66.
[7] 李鑫,李志刚,史仲平.原料碳氮比对丁醇发酵两阶段发酵性能的影响[J].食品与生物技术学报,2014,33(11):1168-1175.
