植物外源抗氧化剂硫脲基肉桂酰基硫脲衍生物的合成
2017-05-30段志芳邵玲李新昌
段志芳 邵玲 李新昌

摘要[目的]合成植物外源抗氧化剂取代硫脲基肉桂酰基硫脲衍生物。[方法]以肉桂酸为原料,通过酰氯化、置换和加成反应,得到5个相应的取代硫脲基肉桂酰基硫脲衍生物,经红外(IR)、质谱(MS)、核磁共振氢谱(1H NMR)和元素分析(EA)确认了新化合物的结构。以维生素C(VC)为对照,测定了这些新化合物体外清除超氧自由基(O2-·)、羟自由基(·OH)和2,2-二苯基-1-苦味酰基自由基(DPPH·)的活性及总还原能力。[结果]在测定浓度下,这些化合物均具有抗氧化活性,其中N-对氯苯硫脲基-N′-肉桂酰基硫脲(1c)对DPPH·的清除活性强于VC。[结论]N-对氯苯硫脲基-N′-肉桂酰基硫脲(1c)具有較强的抗氧化性,作为外源抗氧化剂有望应用于植物氧化胁迫的保护中。
关键词肉桂酰基硫脲;合成;抗氧化作用
中图分类号S482;O621文献标识码A文章编号0517-6611(2017)09-0023-03
Synthesis of Thioureido Cinnamic Acyl Thiourea Derivatives as Plant Exogenous Antioxidants
DUAN Zhifang,SHAO Ling,LI Xinchang
(College of Life Science,Zhaoqing University,Zhaoqing,Guangdong 526061)
Abstract[Objective] To synthesize substituted thioureido cinnamic acyl thiourea derivatives as plant exogenous antioxidants.[Method] Five cinnamic acyl thiourea derivatives had been gotten after the acylchlorination of cinnamic acid,thioureation with ammonium thiocyanate and then the reaction with arylthiosemicarbazide or thiosemicarbazones under solventfree condition.Their structures were characterized by IR,1HNMR,MS and EA.The scavenging effects of these compounds on the superoxide radical(O2-·),hydroxyl radical(·OH) and DPPH· and their total reduction capacity were also compared with ascorbic acid(VC) as the reference material.[Result] They all had scavenging effects on these radicals,in which Npchlorophenylthioureido N′cinnamic acyl thiourea(1c) had stronger effect on DPPH· than the others and VC.[Conclusion] As exogenous antioxidant Npchlorophenylthioureido N′cinnamic acyl thiourea(1c) could be used in the protection of plant oxidative stress.
Key wordsCinnamic acyl thiourea;Synthesis;Antioxidant activity
基金项目广东省科学技术厅基金项目(2014A030304070)。
作者简介段志芳(1973—),女,河南安阳人,副教授,博士,从事药用植物资源开发与利用研究。
收稿日期2017-01-13
植物在生长过程中会不可避免地遭受逆境胁迫,如病原菌侵染、极端温度、干旱洪涝、金属离子、化学药剂等,胁迫发生时,细胞内会产生大量的活性氧,活性氧若未及时清除,会在一定条件下转变成自由基,导致膜脂过氧化,膜透性丧失,引起一系列生理生化变化、代谢紊乱,致使植物遭受伤害[1-3]。
研究表明某些外源物质能明显增加植物的抗逆性,对植物的抗逆作用可能是由于其具有清除含氧自由基的作用或诱导细胞内抗氧化机制[4-5]。天然产物是农药先导化合物的重要来源,在植物中广泛存在的肉桂酸类化合物及其衍生物对一些由自由基导致的病变和损伤具有良好的预防和保护作用,对植物的生长表现出较好的调节作用[6]。李倩[7]发现外源肉桂酸预处理可以提高黄瓜叶片抗氧化酶的活性,减少活性氧含量,进而减轻低温胁迫对叶片膜系统的伤害;陈蔚燕等[8]发现肉桂酸酯类化合物对花生、生姜和玉米等农作物具有较高的生物活性和增产性能。
硫脲类和酰基硫脲类化合物在农药化学方面具有广泛的潜在应用,如除草、调节植物生长等。肖彩琴等[9]研究了含酰基硫脲查尔酮衍生物的合成及其植物生长调节活性,发现对双子叶油菜籽的生长具有调节作用;林桂汕等[10]合成了樟脑基苯基硫脲化合物,对苹果轮纹病菌、番茄早疫病菌等植物病原菌显示不同程度的抑菌活性。目前关于该类衍生物的抗氧化研究鲜见报道。鉴于不同活性的基团聚集于同一分子中能明显改善化合物的生物活性,笔者采用亚结构连接法,以肉桂酸为起始原料,通过酰氯化,无溶剂条件下与硫氰酸铵反应得到相应的中间体肉桂酰基异硫氰酸酯,不经分离分别与芳氨基硫脲或单缩二氨基硫脲发生加成,设计合成了5个新型的含有硫脲基的肉桂酰基硫脲化合物,采用紅外、质谱、核磁共振氢谱和元素分析对其进行了结构鉴定,并通过测定清除超氧自由基(O2-·)、羟自由基(·OH)和2,2-二苯基-1-苦味酰基自由基(DPPH·)及总还原能力,初步研究了其体外抗氧化活性,以期找到效果较好的化合物作为外源物质能进一步应用于植物抗逆研究。
1材料与方法
1.1仪器与试剂
X-4显微熔点测定仪(温度计未校正);日本岛津UV-2550型紫外可见分光光度计;德国Bruker AVANCE AV 400 超导脉冲傅里叶变换核磁共振谱仪;德国Elementar varioEL cube型元素分析仪;美国Nicolet FT-IR 6700型红外光谱仪(KBr压片);美国Thermo公司DSQ质谱仪(EI);其他试剂均为国产分析纯试剂,二氯亚砜重蒸后使用。
1.2方法
1.2.1目标化合物的合成。
芳氨基硫脲类化合物參照文献[11]制备,单缩二氨基硫脲类化合物参照文献[12]制备,肉桂酰氯参照文献[13]制备,所得化合物理化性质与文献相符。
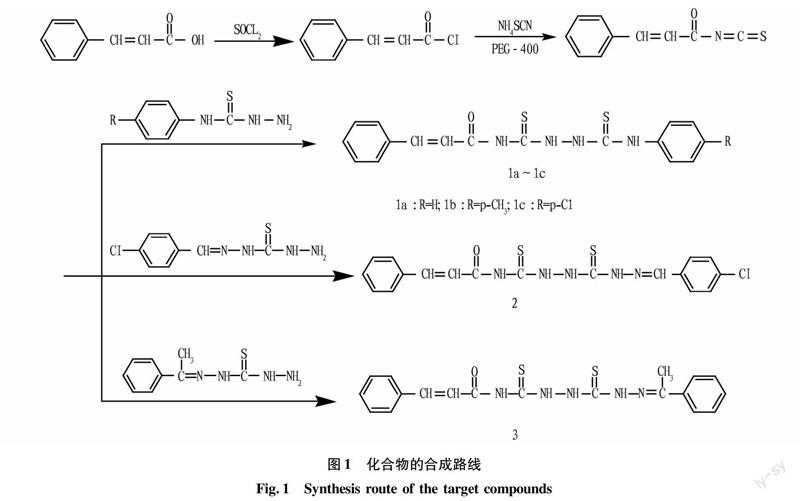
将5.0 mmol肉桂酰氯、7.5 mmol的硫氰酸铵和1滴PEG400置于玻璃研钵中,混合均匀,室温研磨5 min,加入4.5 mmol芳氨基硫脲或单缩二氨基硫脲,继续研磨10 min,固体用蒸馏水洗涤多次,再用无水乙醇洗涤,晾干后用DMF/EtOH重结晶,得到化合物1~3。合成路线见图1。
1.2.2抗氧化活性试验。
新化合物抗氧化活性试验参考文献[14]方法进行,试样浓度配制为1.0 mg/mL二甲亚砜溶液,其中还原能力测定采用铁氰化钾还原法,DPPH自由基用无水乙醇配制直接使用,羟自由基由Fe2+-H2O2-水杨酸体系产生,超氧自由基采用碱性条件下邻苯三酚的自氧化产生。
2结果与分析
2.1目标化合物的合成将肉桂酰氯和硫氰酸铵在催化剂PEG-400存在下室温固相研磨,然后加入芳氨基硫脲或单缩二氨基硫脲反应得到相应产物,反应过程中不使用有机溶剂,具有操作简单、反应条件温和和环境友好等特点,为肉桂酰基硫脲类化合物的合成提供了一条绿色途径。
目标化合物的红外谱图在 3 338~3 054 cm-1处出现的中等强度的吸收峰或强的宽峰,为 N—H伸缩振动特征吸收峰。在1 687~1 661 cm-1处出现的强吸收峰为CO 的伸缩振动特征吸收峰。在 3 007 cm-1左右出现的吸收峰为苯环的 C—H 伸缩振动吸收峰,1 603、1 489、1 450 cm-1左右出现的峰为苯环骨架振动吸收峰。在1 210、1 161 cm-1处出现的中等强度吸收峰为 CS 的伸缩振动吸收峰,1 265 cm-1处出现的强吸收峰为C—N—C反对称伸缩振动吸收峰。
目标化合物的核磁氢谱中有4个N—H的共振吸收峰(单峰),与其化学环境相符合。OCNHCS中N—H中的氢原子处在—CS—的正屏蔽区,化学位移比NHCS位于高场。
目标化合物的质谱图中分子离子峰很弱,其他离子峰可以得到较好的解释。
N-苯硫脲基-N′-肉桂酰基硫脲(1a):浅黄色粉末,产率4.77%,m.p.228~229 ℃;1H NMR(400 MHz,DMSO-d6)δ:13.65(s,1H,PhNH),11.68(s,1H,CONHCS),10.73(s,1H,CSNH),10.37(s,1H,NHCS),7.79(d,J=15.8 Hz,1H,PhCHC),7.14~7.72(m,10H,Ar—H),7.02(d,J=15.8 Hz,1H,CCHCO);IR(KBr)ν:3 194(NH),3 028,1 679(CO),1 626(CC),1 597,1 519,1 451,1 220、1 152(CS),975,764,697;Anal.calcd.for C17H16N4OS2:C 57.30,H 449,N 15.73;found C 57.21,H 4.39,N 15.55。
N-对甲苯硫脲基-N′-肉桂酰基硫脲(1b):浅黄色粉末,产率29.46%,m.p.281~282 ℃;1H NMR(400 MHz,DMSO-d6)δ:13.60(s,1H,PhNH),11.67(s,1H,CONHCS),10.61(s,1H,CSNH),10.27(s,1H,NHCS),7.79(d,J=15.8 Hz,1H,PhCHC),7.12~7.64(m,9H,Ar—H),7.01(d,J=15.8 Hz,1H,CCHCO),2.29(s,3H,—CH3);IR(KBr)ν:3 335、3 229、3 196(NH),3 054,3 027,3 003,1 685(CO),1 629(CC),1 510,1 448,1 345,1 196、1 154(CS),977,819,762,705;Anal.calcd.for C18H18N4OS2:C 58.38,H 487,N 15.14;found C 58.31 ,H 4.79,N 15.25。
N-对氯苯硫脲基-N′-肉桂酰基硫脲(1c):浅黄色粉末,产率9.28%,m.p.>290 ℃;1H NMR(400 MHz,DMSO-d6)δ:12.44(s,1H,PhNH),10.18(s,1H,CONHCS),9.96(s,1H,CSNH),9.75(s,1H,NHCS),7.75(d,J=15.8 Hz,1H,PhCHC),7.45~7.68(m,9H,Ar—H),6.91(d,J=15.8 Hz,1H,CCHCO);IR(KBr)ν:3 338、3 195、3 108(NH),3 003,1 661(CO),1 620(CC),1 573,1 543,1 493,1 346,1 193、 1 162(CS),1 089,777,539;EI-MS m/z (%):356(M+-H2S,4.54),279(3.38),243(5.17),226(439),203(5.48),184(9.48),169(24.43),131(100),127(32.45),111(28.39),103(25.17),75(12.49),65(6.32);Anal.calcd.for C17H15ClN4OS2:C 52.24,H 3.84,N 14.34;found C 52.31,H 379,N 14.25。
N-对氯苯甲醛缩氨基硫脲基-N′-肉桂酰基硫脲(2):淡黄色固体粉末,产率68.44%,m.p.232~234 ℃;1H NMR(400 MHz,DMSO-d6)δ:13.35(s,1H,NHCS), 1232(s,1H,CSNHCO),11.84(s,1H,NNH),10.99(s,1H,CSNH),8.15(s,1H,CHN),7.80 (d,J=15.8 Hz,1H,PhCH),7.47~7.83(m,9H,Ar—H),7.02(d,J=15.8 Hz,1H,CHCO);IR(KBr) ν:3 323、3 159(NH),3 055,1 687(CO),1 633(CC),1 520、1 484、1 449(Ar),1 226,1 193、1 151(CS),1 086,978,763,681;Anal.calcd.for C18H16ClN5OS2:C 51.72,H 3.83,N 16.76;found C 51.66,H 374,N 16.83。
N-苯乙酮缩氨基硫脲基-N′-肉桂酰基硫脲(3):淡黄色固体,产率60.25%,m.p.214~216 ℃;1H NMR(400 MHz,DMSO-d6)δ:13.76(d,J=7.3 Hz,1H,NHCS), 11.86(s,1H,CSNHCO),11.37(s,1H,NNH),11.17(d,J=6.4 Hz,1H,CSNH), 7.90~7.93(m,2H,Ar—H),7.81(d,J=15.8 Hz,1H,PhCH),7.44~7.66(m,8H,Ar—H),7.01(d,J=15.8 Hz,1H,CHCO),2.40(s,3H,CH3);IR(KBr) ν:3 326、3 204(NH),3 055,3 024,1 687(CO),1 632(CC),1 538、1 509、1 488(Ar),1 446,1 224,1 198、1 153(CS),978,764,686;EI-MS(%):397(M+,0.5),363(5.25),348(12.26),221(27.49),202(8.49),176(2556),148(686),131(100),118(17.55),103(28.26),77(25.34),51(4.79);Anal.calcd.for C19H19N5OS2:C 56.78,H 4.78,N 17.58;found C 57.43,H 4.79,N 17.63。
2.2化合物的抗氧化活性
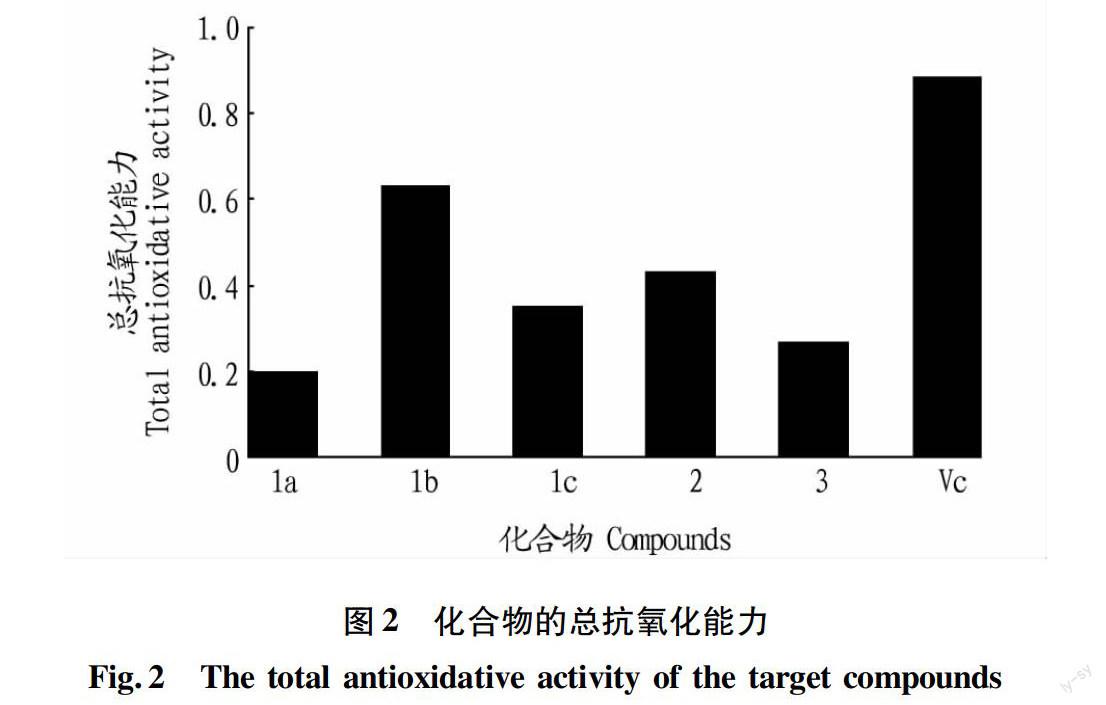
试验测定了硫脲基肉桂酰基硫脲新化合物清除O2-·、·OH和DPPH·的活性及总还原能力,并同维生素C(VC)抗氧化活性进行了比较。试验过程中选用多个浓度,结果发现低浓度时,清除自由基效果较弱,而高浓度时化合物在测定体系中的溶解度小,清除自由基效果也较弱,为了便于比较,选用浓度为1.0 mg/mL时的试验结果(取3次测定平均值)。
由图2~5可知,在1.0 mg/mL时,这些化合物均具有清除自由基活性,其中N-对氯苯硫脲基-N′-肉桂酰基硫脲(1c)对DPPH·的清除活性较强,抑制率为95.29%,作用强于VC;其他化合物抗氧化活性均弱于VC,这可能是由于該类化合物在测定体系中的溶解度比VC小所致。
3结论
无溶剂条件下肉桂酰基异硫氰酸酯与芳氨基硫脲或单缩二氨基硫脲发生加成反应得到5个相应的硫脲基肉桂酰基硫脲衍生物,经红外、质谱、核磁共振氢谱和元素分析确认了新化合物的结构。测定了这些新化合物清除超O2-·、·OH和DPPH·的活性及还原能力。结果表明,这些化合物均具有抗氧化活性,其中N-对氯苯硫脲基-N′-肉桂酰基硫脲(1c)对DPPH·的清除活性较强,作用强于VC,有望进一步进行植物氧化胁迫的保护作用研究。该结果提供了一种绿色合成方法,为设计与合成活性更高的酰基硫脲化合物分子提供了理论依据。
参考文献
[1]
HUSSEIN Y,AMIN G,GAHIN H.Antioxidant activities during drought stress resistance of sesame(Sesamum indicum L.) plant by salicylic acid and kinetin[J].Research journal of botany,2016,11(1):1-8.
[2] QUINN L D,STRAKER K C,GUO J,et al.Stresstolerant feedstocks for sustainable bioenergy production on marginal land[J].BioEnergy research,2015,8(3):1081-1100.
[3] 夏民旋,王维,袁瑞,等.超氧化物歧化酶与植物抗逆性[J].分子植物育种,2015,13(11):2633-2646.
[4] 孙立荣,崔香环,廖立冰,等.外源水杨酸对Cu2+胁迫下小麦幼苗中活性氧和抗氧化酶的影响[J].河南大学学报(自然科学版),2008,38(2):176-180.
[5] 张春平,何平,韦品祥,等.外源5-氨基乙酰丙酸对盐胁迫下紫苏种子萌发及幼苗抗氧化酶活性的影响[J].中草药,2011,42(6):1194-1200.
[6] 吴争荣.肉桂酸类衍生物的合成及其生物活性研究[D].兰州:兰州大学,2013.
[7] 李倩.外源肉桂酸对低温胁迫下两个黄瓜品种叶片DNA甲基化的影响[D].泰安:山东农业大学,2012.
[8] 陈蔚燕,关立婷,许良忠.肉桂酸酯类化合物的合成及在农作物上的应用研究[J].农学学报,2013,3(10):34-37.
[9] 肖彩琴,傅颖.新型含酰基硫脲查尔酮衍生物的合成及其植物生长调节活性[J].合成化学,2015,23(9):785-790.
[10] 林桂汕,黄翊,段文贵,等.樟脑基苯基硫脲类化合物的合成及生物活性研究[J].化学通报,2015,78(8):722-727.
[11] 钟蒙,刘兆鹏,徐丽君,等.腺嘌呤衍生物的合成及体外抗疱疹病毒活性[J].药学学报,1996,31(11):837-843.
[12] 周琳,王麟生,王海霞,等.单缩和双缩二氨基硫脲类化合物的合成与表征[J].化学通报,2006(5):355-358.
[13] 左明明,周健民,胡国辉,等.肉桂酰胺类化合物的合成及其体外抗肿瘤活性[J].化学世界,2012(4):239-242.
[14] 王蓓蓓,牛付阁,段玉峰.高良姜与大高良姜总黄酮抗氧化活性比较研究[J].食品科学,2011,32(7):117-120.
