急性ST段抬高型心肌梗死合并应激性高血糖患者围手术期应用GLP-1效果观察
2017-05-25付立强赵文萍贾辛未高淑贤付静静张浩高宏博
付立强,赵文萍,贾辛未,高淑贤,付静静,张浩,高宏博
(1河北大学,河北保定071000;2河北大学附属医院)
急性ST段抬高型心肌梗死合并应激性高血糖患者围手术期应用GLP-1效果观察
付立强1,赵文萍2,贾辛未2,高淑贤1,付静静1,张浩1,高宏博1
(1河北大学,河北保定071000;2河北大学附属医院)
目的 探讨急性ST段抬高型心肌梗死(STEMI)合并应激性高血糖(SHG)患者围手术期应用胰高血糖素样肽-1(GLP-1)对心肌灌注和心功能的影响。方法 选择STEMI合并SHG患者114例,随机分为观察组59例和对照组55例。入院后均给予标准AMI强化治疗,观察组从急诊PCI术前至术后7 d给予GLP-1干预,对照组从急诊PCI术前至术后7 d给予胰岛素常规干预。于术后7 d及3个月采用静息99mTc-MIBI心肌灌注显像17节段积分法评价两组术后心肌灌注缺损积分,常规超声心动图测量左心室舒张末内径(LVEDD)、二维双平面Simpson法测量左心室射血分数(LVEF),胶体金免疫层析法检测不同时间点肌酸激酶同工酶(CK-MB)及肌钙蛋白T(cTnT)水平。结果 两组术后3个月的心肌灌注缺损积分均较术后7 d降低,观察组术后3个月心肌灌注缺损积分较对照组同期降低(P<0.01);两组术后3个月LVEDD、LVEF均较术后7 d升高,观察组术后3个月LVEF较对照组同期升高(P<0.01);观察组围手术期CK-MB及cTnT峰值低于对照组(P均<0.05)。结论 STEMI合并SHG患者围手术期应用GLP-1可以逐步改善心肌灌注及心脏功能。
心肌梗死;应激性高血糖;胰高血糖素样肽-1;心肌再灌注;围手术期
应激性高血糖(SHG)是指由严重疾病或创伤等应激状态导致的糖代谢紊乱,继而出现高血糖、胰岛素抵抗或糖耐量异常的现象。SHG在AMI患者中常伴随发生,是影响AMI患者心肌灌注、再灌注损伤及临床预后的重要因素。AMI后出现SHG的患者较血糖正常患者主要不良心血管事件(MACE)发生率明显增高[1]。胰岛素主动干预AMI后SHG是目前临床普遍采取的措施。然而早期胰岛素干预虽然可使充血性心力衰竭发生率和3个月内再发梗死率降低[2],但严重低血糖的发生风险显著增加。胰高血糖素样肽-1(GLP-1)是一种新型的血糖调节药物,极少引发低血糖,同时对心血管系统具有多方面的保护作用[3],本研究对急性ST段抬高型心肌梗死(STEMI)合并SHG患者围手术期使用GLP-1进行干预,观察其对患者心肌灌注和心功能的影响。现报告如下。
1 资料与方法
1.1 临床资料 选择2012年11月~2015年12月在河北大学附属医院行急诊经皮冠状动脉介入治疗(PCI)的STEMI合并SHG患者114例,男81例、女33例,年龄35~65(56.2±6.9)岁。心功能Killip分级Ⅰ级87例、Ⅱ级21例、Ⅲ级6例。冠状动脉造影检查显示梗死相关动脉(IRA)位于左前降支57例、左回旋支23例、右冠状动脉32例,合并多支病变68例。SHG诊断标准:入院即刻血糖≥11.1 mmol/L,既往无糖尿病病史或入院时HbA1c正常或经口服糖耐量试验排除糖尿病。排除标准:既往有心肌梗死、冠状动脉支架植入、冠状动脉搭桥或心脏瓣膜病病史;严重肝肾功能障碍、甲状腺功能亢进、血液系统疾病、重度感染、外伤、恶性肿瘤、脑卒中、皮质醇增多症以及需糖皮质激素治疗的其他疾病。将患者随机分为观察组59例和对照组55例,两组性别、年龄、心功能分级具有可比性。
1.2 治疗方法 患者入院后均给予标准AMI强化治疗(波立维300 mg、拜阿司匹林300 mg、立普妥40 mg)。观察组从急诊PCI术前至术后7 d给予GLP-1干预,术前30 min皮下注射1.8 mg,术后从0.6 mg/d开始逐渐加量,第1、2天0.6 mg/d,第3、4天1.2 mg/d,第5、6、7天1.8 mg/d。对照组从急诊PCI术前至术后7 d给予胰岛素常规干预,根据入院即刻血糖值计算胰岛素用量,术前30 min皮下注射,术后监测三餐前后血糖,根据血糖调整用量。控制血糖在7.8~10.0 mmol/L。两组均经桡动脉(首选)或股动脉途径完成冠状动脉造影及球囊扩张与支架植入术,只对IRA进行干预,置入药物洗脱支架。术后给予双联抗血小板治疗方案(波立维75 mg/d、拜阿司匹林100 mg/d),根据情况给予他汀类、β受体阻滞剂、硝酸酯类及ACEI或ARB等药物。
1.3 心肌灌注情况观察 使用SPECT系统(GE公司)分别于术后7 d及3个月行静息99mTc-MIBI心肌灌注显像。图像采用17节段积分法定量分析,根据每个节段的放射性稀疏程度进行评分。正常0分,轻度稀疏1分,中度稀疏2分,重度稀疏3分,完全缺损4分,评估后计算积分总和,记为缺损积分。缺损积分越高,则表明心肌灌注越差。
1.4 心功能指标检测 使用LOGIQ-E9(GE公司)超声诊断仪,配备M5S探头(频率1.5~4.3 MHz),分别于PCI术后7 d和术后3个月行超声心电图检查。患者平卧,平静呼吸,连接胸导连心电图,测量左心室舒张末期内径(LVEDD),二维双平面Simpson法测量左心室射血分数(LVEF)。
1.5 心肌损伤指标检测 分别于PCI术前以及术后4、8、16、24、36、48 h采用罗氏h232床旁快速心梗心衰检测仪测定静脉血肌酸激酶同工酶(CK-MB)及肌钙蛋白T(cTnT)水平,其中最高值定义为峰值。峰值越高表明心肌损伤越重,短期内心功能越差。

2 结果
2.1 两组冠状动脉造影、PCI手术资料及常规口服药物情况比较 观察组发病至开通时间(314±207)min,对照组为(325±212)min,两组比较无统计学意义;两组IRA、术前TIMI血流及常规口服药物情况比较差异均无统计学意义。见表1。
2.2 两组心肌灌注情况比较 观察组术后7 d、术后3个月的心肌灌注缺损积分分别为(8.26±1.21)、(7.83±1.32)分,对照组分别为(10.09±1.62)、(9.52±1.51)分,两组术后3个月的缺损积分均较术后7 d降低(P均<0.05)。观察组术后3个月缺损积分较对照组降低(P<0.01)。
2.3 两组心功能指标比较 两组术后3个月LVEDD、LVEF均较术后7 d升高,观察组术后3个月LVEF较对照组同期升高(P<0.01)。见表2。
2.4 两组围手术期心肌损伤指标比较 观察组和对照组围手术期CK-MB峰值分别为(192.7±85.1)、(237.4±76.3)mmol/L,cTnT峰值分别为(4.3±2.7)、(5.4±3.9)ng/mL,观察组CK-MB峰值、cTnT峰值均低于对照组(P均<0.05)。
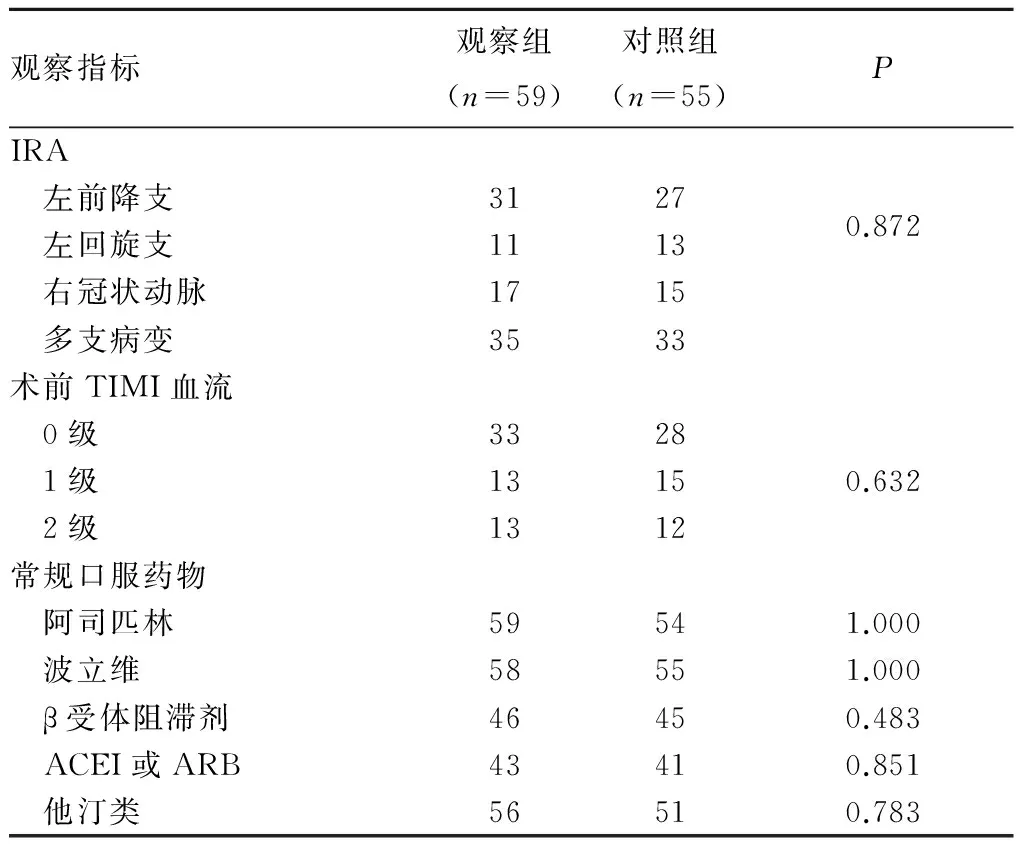
表1 两组IRA、术前TIMI血流及常规口服药物情况比较(例)
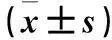
表2 两组PCI术后7 d及3个月LVEDD、LVEF比较
注:与同组术后7 d比较,*P<0.05;与对照组同时点比较,#P<0.01。
3 讨论
STEMI是AMI中一种严重的临床分型,常提示IRA完全闭塞,损伤累及心肌全层,可使机体迅速进入应激状态,导致胰高血糖素、儿茶酚胺、糖皮质激素等升糖激素的大量释放,造成血糖升高和胰岛素抵抗状态,从而引发SHG。目前关于STEMI后SHG的干预尚存在争议,部分学者认为,适度的SHG可为重要器官能量代谢提供必需的葡萄糖供应,O-糖基化修饰在急性应激所致的心血管损伤中发挥着保护作用。但目前多数研究结果更倾向于SHG导致心血管损伤。研究表明,SHG对AMI患者PCI术后心肌微循环灌注具有明显不良影响。一方面,急性血糖水平增加可导致冠状动脉微血管的内皮功能障碍,造成心肌微循环灌注不良[4],AMI后机体自由基和脂质过氧化物水平增加,造成毛细血管及内皮细胞氧化应激损伤,同时SHG可增强氧化应激反应程度,使以上损伤加重[5];另一方面,高糖血症使血小板活性增强,组织的纤溶活性降低,导致心肌微血栓形成,同时血小板脱颗粒释放的血栓素A2和5-羟色胺等引起微血管痉挛,加重心肌微循环障碍[6];此外,SHG还可通过引发水钠潴留、心肌细胞膜钙超载及心肌能量代谢异常等,影响患者预后[7]。相关研究表明,SHG与左心室功能降低呈独立相关性[8]。Kosuge等[9]对发病6 h内行PCI治疗的前壁AMI患者进行研究,发现持续高糖血症患者PCI术后的心功能明显低于无持续高糖血症患者。因此认为,主动干预STEMI后SHG能够降低急性血糖升高导致的心血管损害,对改善患者预后具有重要意义。
GLP-1是新型调节血糖药物,在发挥降糖作用的同时,极少引发低血糖。研究表明,GLP-1对心血管具有多方面的保护作用:GLP-1通过调节胰岛素与胰高血糖素的分泌维持血糖稳态,这种相互反馈调节机制可避免低血糖的发生;通过降低AMI后高血糖,降低SHG对心血管的损伤;通过纠正组织氧化还原失衡,改善血管内皮功能,抑制心肌细胞凋亡,降低应激反应,抑制炎症水平等,发挥对心血管的保护作用[10~15]。
本研究显示,观察组围手术期CK-MB及cTnT峰值较对照组降低,提示GLP-1可能通过某种途径降低心肌再灌注损伤,发挥保护作用。术后3个月,观察组心肌灌注、LVEF显著高于对照组,提示GLP-1可能通过改善心肌灌注和发挥心血管保护的共同作用,挽救处于缺血区和缺血区边缘的残存心肌,亦或恢复一部分处于冬眠或顿抑中的心肌,从而减轻再灌注损伤,改善心功能。
综上所述,STEMI合并SHG患者围手术期应用GLP-1可以逐步改善患者的心肌灌注及心功能。本研究最大的不足在于样本量小,尚需大样本临床试验对以上结果进行验证。针对STEMI后SHG的干预指征、干预策略以及干预后的长期获益值得更进一步的探讨。
[1] Ishihara M, Kagawa E, Inoue I, et al. Impact of admission hyperglycemia and diabetes mellitus on short- and long-term mortality after acute myocardial infarction in the coronary intervention era[J]. Am J Cardiol, 2007,99(12):1674-1679.
[2] Cheung NW, Wong VW, Mclean M. The Hyperglycemia: Intensive Insulin Infusion in Infarction (HI-5) study: a randomized controlled trial of insulin infusion therapy for myocardial infarction[J]. Diabetes Care, 2006,29(4):765-770.
[3] Seufert J, Gallwitz B. The extra-pancreatic effects of GLP-1 receptor agonists: a focus on the cardiovascular, gastrointestinal and central nervous systems[J]. Diabetes Obes Metab, 2014,16(8):673-688.
[4] Zein AF, Nasution SA, Purnamasari D, et al. The influence of hyperglycemia at admission on in-hospital arrhythmia patients with acute coronary syndrome[J]. Acta Med Indones, 2015,47(4):291-296.
[5] Terlecki M, Bryniarski L, Bednarek A, et al. The risk of diabetes development in long-term observation of patients with acute hyperglycaemia during myocardial infarction[J]. Kardiologia Polska, 2015,73(8):606-612.
[6] Iwakura K. Stress hyperglycemia and microvascular obstruction after acute myocardial infarction[J]. J Cardiol, 2015,65(4):270-271.
[7] Mapanga RF, Essop MF. Damaging effects of hyperglycemia on cardiovascular function: spotlight on glucose metabolic pathways[J]. Am J Physiol Heart Circ Physiol, 2015,310(2):153-173.
[8] Modenesi RF, Pena FM, Faria CA, et al. Influence on prognosis and prevalence of stress hyperglycemia in a cohort of patients with acute coronary syndrome[J]. Rev Bras Ter Intensiva, 2012,24(4):352-356.
[9] Kosuge M, Kimura K, Ishikawa T, et al. Persistent hyperglycemia is associated with left ventricular dysfunction in patients with acute myocardial infarction[J]. Circ J, 2005,69(1):23-28.
[10] Woo JS, Kim W, Ha SJ, et al. Cardio protective effects of exenatide in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention; results of exenatide myocardial protection in revascularization (EMPIRE) study[J]. Arterioscler Thromb Vasc Biol, 2013,111(7):2252-2260.
[11] Erdogdu Ö, Eriksson L, Nyström T, et al. Exendin-4 restores glucolipotoxicity-induced gene expression in human coronary artery endothelial cells[J]. Biochem Biophys Res Commun, 2012,419(4):790-795.
[12] Ravassa S, Zudaire A, Carr RD, et al. Antiapoptotic effects of GLP-1 in murine HL-1 cardiomyocytes[J]. Am J Physiol Heart Circ Physiol, 2011,300(4):H1361-1372.
[13] Chang G, Zhang D, Yu H, et al. Cardioprotective effects of exenatide against oxidative stress-induced injury[J]. Int J Mol Med, 2013,32(5):1011-1020.
[14] Noyan-Ashraf MH, Shikatani EA, Schuiki I, et al. A glucagon-like peptide-1 analog reverses the molecular pathology and cardiac dysfunction of a mouse model of obesity[J]. Circulation, 2013,127(1):74-85.
[15] Cai Y, Hu X, Yi B, et al. Glucagon-like peptide-1 receptor agonist protects against hyperglycemia-induced cardiocytes injury by inhibiting high mobility group box 1 expression[J]. Mol Biol Rep, 2012,39(12):10705-10711.
赵文萍(E-mail: heartfailure1@sina.com)
10.3969/j.issn.1002-266X.2017.06.022
R542.2
B
1002-266X(2017)06-0065-03
2016-10-13)
