表面活性剂SDS和CTAB诱导天青蛋白的解折叠研究
2017-05-25马剑龙杨斌盛
马剑龙,杨斌盛
(山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
表面活性剂SDS和CTAB诱导天青蛋白的解折叠研究
马剑龙,杨斌盛*
(山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
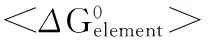
天青蛋白;表面活性剂;稳定性
0 引言
天青蛋白(Azurin简称Az)是由128个氨基酸残基组成的I型铜金属蛋白,在植物与细菌中充当电子传递体[1],其二级结构包括一个α螺旋和八股β折叠,这些β折叠形成了一个“三明治”状的疏水核心[2],唯一的色氨酸残基(Trp48)位于这个疏水区。具有氧化还原特性的铜离子(Ⅱ)整合在Az中,成为CuⅡ-Az[3]。晶体结构表明,铜离子(Ⅱ)的配位构型为三角双锥。其与处于三角平面的His117, His46以及Cys112结合较强,与处于垂直方向的Gly45和Met121结合较弱[4]。CuⅡ-Az中铜的特殊的配位环境使得其在625 nm处有明显的荷移吸收[3]。电子传递伴随着铜离子(Ⅱ)的氧化还原以及色氨酸自由基的光诱导生成和淬灭[5]。作为一种模型蛋白,Az的解折叠过程被广泛研究。有研究表明,Az有很强的稳定性。盐酸胍诱导表明apo-Az解折叠为两态,结合铜离子(Ⅱ)后形成的CuⅡ-Az稳定性增加,同时解折叠表现为三态[6]。
除了盐酸胍之外,表面活性剂也经常用于蛋白质解折叠过程的研究。表面活性剂通常包括极性的头部,和非极性的烷基链尾巴[7]。非离子型表面活性剂通常不能使蛋白质变性,但是离子型表面活性剂在很低浓度的条件下(通常是毫摩尔)就能使蛋白变性。这表明表面活性剂与蛋白作用的方法与化学变性剂不同。通常认为,解折叠的驱动力是表面活性剂与变性的蛋白质有更高的亲和力[7]。
在本文中,我们用色氨酸残基(Try48)的荧光和铜(Ⅱ)的吸收光谱作为内源探针,用十二烷基硫酸钠(SDS)和十六烷基三甲基溴化铵(CTAB)作为变性剂,所得到的解折叠曲线用结构基元模型处理[8]。研究了表面活性剂诱导Az的解折叠过程。
1 实验部分
1.1 材料与仪器
氯化钠,冰乙酸,醋酸钠,氰化钾,氯化铜,盐酸胍,丙烯酰胺(Acrylamide),碘化钾(KI),硫代硫酸钠,十二烷基硫酸钠(SDS),十六烷基三甲基溴化铵(CTAB)以及其他试剂均为分析纯。
荧光光谱仪HORIBA scientific FluoroMax-4,紫外-可见分光光度计Varian Cary 50,MILLIPOPE 8010超滤装置,AKTA primeTMplus蛋白纯化系统。
1.2 蛋白的表达纯化
以pGEX-6P-1为表达载体,通过基因工程得到pGEX-6P-1-Az重组质粒并转入大肠杆菌BL21。用20 μmol/L氯化铜以及0.2 mmol/L IPTG诱导可表达出可溶性蛋白,纯化方法参照文献[9]。通过AKTAprimeTMplus蛋白纯化系统之后,所得到的蛋白样品中仍有部分CuⅡ-Az和ZnⅡ-Az,之后用400 mmol/L氰化钾浸泡该蛋白样品4 h以除去金属离子[3]。最终所得到的蛋白保存在50 mmol/L(pH 5.0) 的醋酸钠缓冲液中。
1.3 方法
1.3.1 荧光光谱
在本文,所有蛋白样品溶解在50 mmol/L,pH 5.0醋酸钠缓冲液中,设定温度为25℃。使用1.0 cm比色皿在HORIBA scientific FluoroMax-4荧光光谱仪上进行测定。激发波长280 nm,扫描范围290~500 nm,激发狭缝宽度为10 nm,发射狭缝宽度为10 nm。
1.3.2 紫外可见光谱
蛋白质的紫外可见吸收在Varian Cary 50吸收光谱仪上测定,扫描范围250~800 nm。
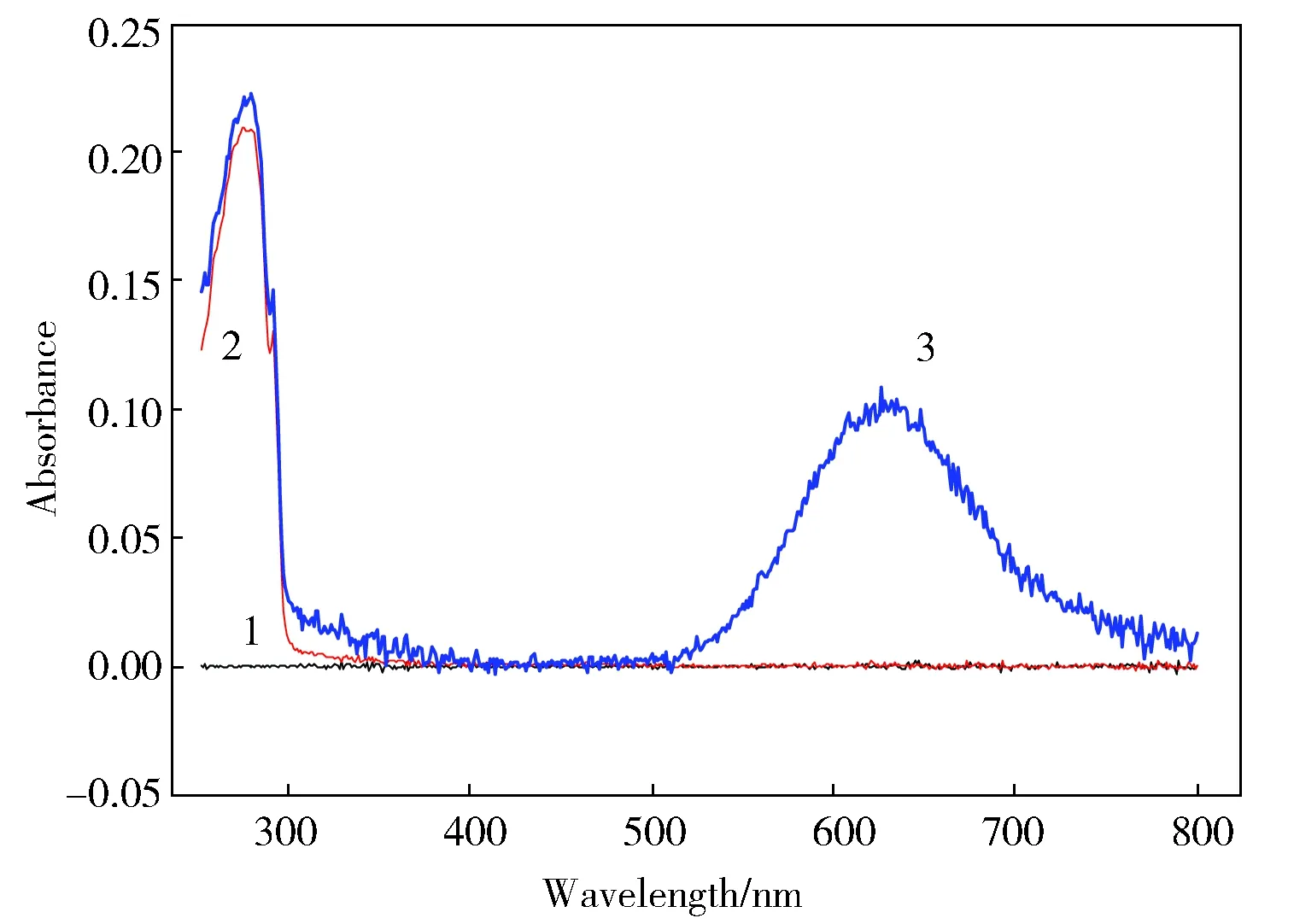
Fig.1 Ultraviolet-visible absorption spectra of Az in 50 mmol/L sodium acetate, pH 5.0(1)baseline;(2)apo-Az;(3)CuⅡ-Az图1 Az的紫外可见吸收光谱(1)基线;(2) apo-Az;(3) CuⅡ-Az
2 结果与讨论
2.1 apo-Az与CuⅡ-Az的紫外可见吸收光谱
图1给出了apo-Az与CuⅡ-Az的紫外可见吸收光谱。可以看出,apo-Az在280 nm处有强烈的紫外吸收,摩尔消光系数大约为9 000 mol/L-1·cm-1。CuⅡ-Az呈现明显的亮蓝色,紫外可见光谱测定表明其在625 nm附近有强烈的可见吸收,并且其吸光度约为280 nm处的42%。
2.2 Az在不同状态下的荧光光谱
Az结构包含有一个疏水核,唯一的色氨酸残基(Trp48)就位于其中[2,10]。因此,Az在280 nm波长的紫外光照射下,会发出荧光。色氨酸残基的荧光最大峰会随着周围环境极性的变化而发生移动,如图2所示。
图2给出了不同变性剂存在下,apo-Az在50 mmol/L (pH 5.0) 醋酸钠缓冲液中的荧光发射光谱。可以看出,蛋白质的荧光发射峰的形状没有太大的变化,只是最大发射波长发生了移动。在没有变性剂时,apo-Az最大发射波长位于308 nm;在1.0 mmol/L SDS存在下,最大发射波长红移至330 nm;在0.7 mmol/L CTAB存在下,最大发射波长红移至344 nm;在5.0 mol/L GuHCl存在下,最大发射波长红移至358 nm。可以看出,5.0 mol/L GuHCl存在下,apo-Az中的色氨酸残基(Trp48)完全处于极性的水相中。而在0.7 mmol/L CTAB或1.0 mmol/L SDS存在下,apo-Az中的色氨酸残基(Trp48)处于部分亲水的状态[11]。
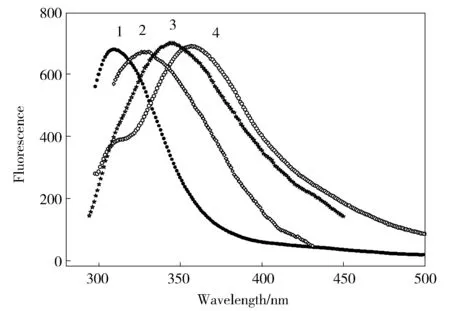
Fig.2 Fluorescence spectra of apo-Az in the presence of different denaturant in 50 mmol/L sodium acetate, pH 5.0(1) no denaturant,(2) 1.0 mmol/L SDS, (3) 0.7 mmol/L CTAB, and (4) 5.0 mol/L GuHCl图2 不同变性剂存在下apo-Az在50 mmol/L (pH 5.0) 醋酸钠缓冲液中的荧光光谱(1)没有变性剂,(2) 1.0 mmol/L SDS,(3) 0.7 mmol/L CTAB,(4) 5.0 mol/L GuHCl

Fig.3 Fluorescence spectra of CuⅡ-Az in thepresence of different denaturant in 50 mmol/L sodium acetate,pH 5.0 (1) no denaturant, (2) 5.0 mmol/L CTAB,(3) 5.0 mmol/L SDS, and (4) 5.0 mol/L GuHCl图3 不同变性剂存在下CuⅡ-Az在50 mmol/L (pH 5.0)醋酸钠缓冲液中的荧光光谱(1)没有变性剂,(2) 5.0 mmol/L CTAB,(3) 5.0 mmol/L SDS,(4) 5.0 mol/L GuHCl
图3给出了CuⅡ-Az在不同溶液中的荧光发射光谱。可以看出,与apo-Az相似,在没有变性剂存在时,CuⅡ-Az的最大发射波长位于308 nm;在5.0 mol/L GuHCl存在下,CuⅡ-Az的最大发射波长红移至358 nm。然而,在5.0 mmol/L SDS或5.0 mmol/L CTAB存在下,CuⅡ-Az的最大发射波长仍旧位于308 nm,只是荧光峰的宽度增加,表明色氨酸残基(Trp48)仍旧被包围在疏水环境中。
2.3 Az的解折叠行为及稳定性
Az的解折叠伴随着色氨酸残基(Trp48)从疏水环境到亲水环境的变化,因此色氨酸残基(Trp48)可以作为内源荧光探针研究蛋白质的构象变化[12]。由图2可知,apo-Az中加入SDS,使得其最大发射波长从308 nm红移至330 nm。表明,SDS使得apo-Az由天然状态转变为解折叠状态。为了更好地描述蛋白质的解折叠过程,本文用330和308 nm (I330 nm/I308 nm)的荧光强度的比值对SDS浓度并归一化作图,如图4A变性曲线1所示。可以看出,SDS诱导apo-Az的解折叠是典型的两态过程,50%的蛋白质由天然态转变为解折叠态时的变性剂(表面活性剂)浓度D1/2为0.46 mmol/L (SDS),蛋白质对变性剂(表面活性剂)敏感程度的参数-m值为38.17 kJ/moL(mmol/L),并通过线性外推法得到解折叠的吉布斯能(ΔG)为17.39 kJ/mol[8]。所有的热力学参数总结在表1中。图3显示,5.0 mmol/L SDS使得CuⅡ-Az的荧光峰形状发生了变化。表明SDS同样使CuⅡ-Az发生了解折叠。为了更好的比较apo-Az和CuⅡ-Az的稳定性,SDS诱导CuⅡ-Az的变性曲线也展现在图4A中的曲线2。显然,CuⅡ-Az的解折叠呈现为三态过程,也就是存在一个中间态。基于结构基元模型,这个三态曲线可由2个结构基元解折叠曲线Y1和Y2的线性叠加而得到[8,13]。SDS诱导两个结构基元解折叠的D1/2分别为1.53和2.78 mmol/L,均大于SDS诱导apo-Az解折叠的D1/2(0.46 mmol/L),表明铜离子(Ⅱ)的结合使两个结构基元都变得更稳定。两个结构基元解折叠的吉布斯自由能(ΔGi)分别为15.88和28.45 kJ/mol,其中ΔG1(15.88 kJ/mol),小于SDS诱导apo-Az解折叠的吉布斯自由能(17.39 kJ/mol),是因为相比于apo-Az,CuⅡ-Az对SDS的敏感程度降低,也就是其-m值减小了。相应的热力学参数列在表1中。
Fig.4 SDS(A) and CTAB(B) induced unfolding of (1) apo-Az and (2) CuⅡ-Az. Y1 and Y2 are the unfolding curves of structural element 1 and structural element 2, respectively图4 SDS (A) 和CTAB(B) 诱导的蛋白质解折叠曲线(1) apo-Az, (2) CuⅡ-Az。Y1和Y2分别是拟合得到的结构基元1与结构基元2的解折叠曲线
在0.7 mmol/L CTAB存在下,apo-Az的最大荧光峰红移至344 nm (图2)。因此,用344 nm和308 nm (I344nm/I308nm)处荧光强度的比值来对CTAB浓度作图,得到解折叠曲线,如图4B曲线1所示。可以看出,apo-Az的解折叠是两态过程。解折叠的D1/2和吉布斯自由能(ΔG)分别为0.25 mmol/L和18.00 kJ/mol。同样的,CTAB诱导的CuⅡ-Az的变性曲线也呈现为两态过程 (图4B曲线2)。但是D1/2明显移动到了更高的浓度(0.68 mmol/L),吉布斯自由能(ΔG)为24.79 kJ/mol。相应的热力学参数也列在表1中。
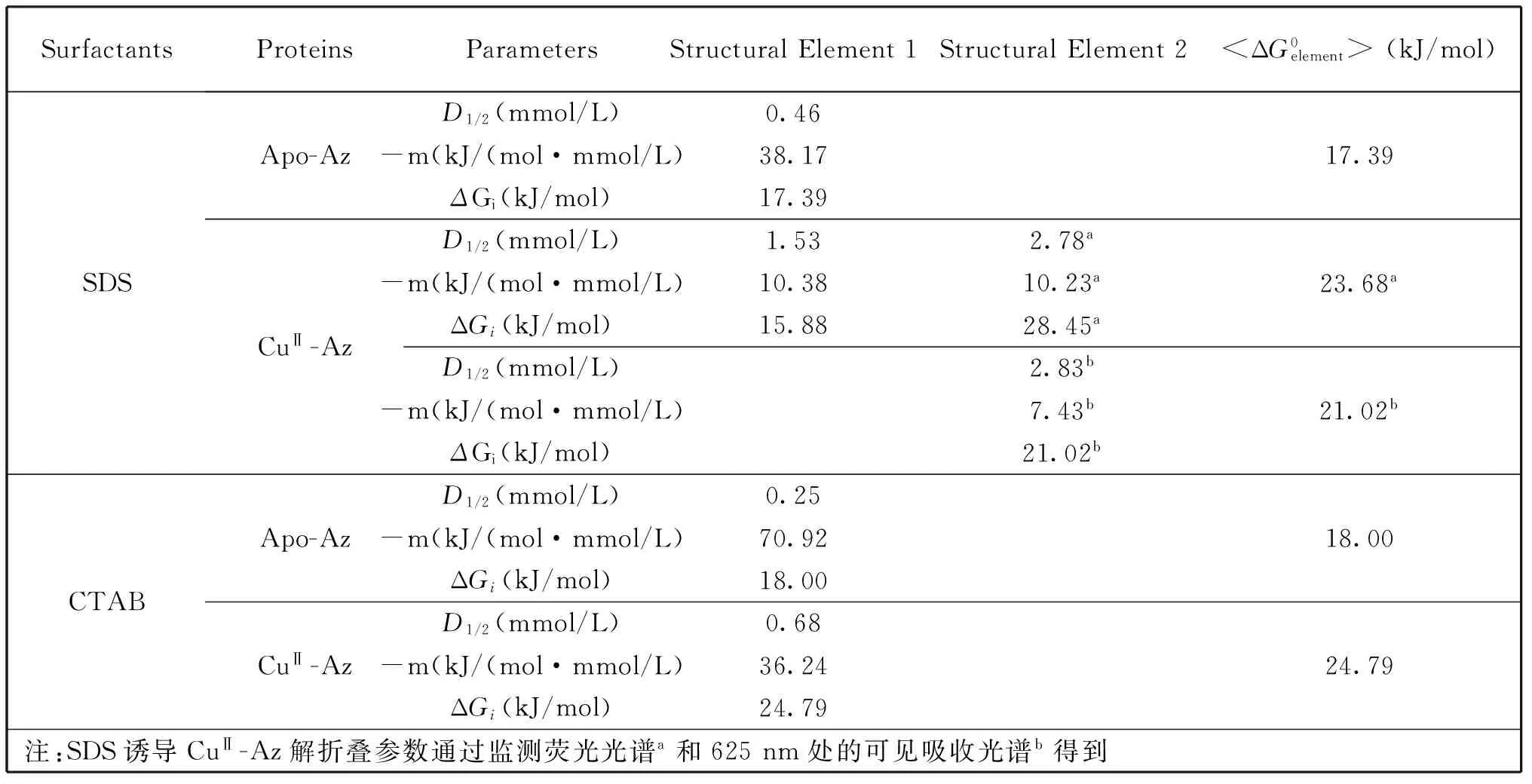
表1 SDS和 CTAB 诱导的蛋白质解折叠数据
高浓度的SDS不能使CuⅡ-Az的荧光峰发生移动,但会使CuⅡ-Az原本固有的蓝色消失。图5A为不同浓度SDS存在下,CuⅡ-Az在500~800 nm 的可见吸收光谱。可以看出,CuⅡ-Az在625 nm处有明显的可见吸收,随着SDS的加入,该吸收峰逐渐减小,并最终消失。表明SDS诱导的CuⅡ-Az构象变化导致铜(Ⅱ)离子的配位环境被破坏,也就是说Az的结构基元2 发生了解折叠。用625 nm处的可见吸收对SDS浓度作图可得到其变性曲线,如图5B曲线1所示。可以看出,可见吸收光谱测定的CuⅡ-Az解折叠是两态过程,而荧光光谱监测到的SDS诱导CuⅡ-Az解折叠的过程呈现为三态(图4A曲线2)。为了比较,将此三态过程也作在如图5B中曲线2。可以看出,结构基元2的解折叠曲线Y2与曲线1的形状相似,并且有相近的D1/2。表明紫外可见吸收光谱只能监测到结构基元2的解折叠。荧光光谱与紫外光谱监测到的SDS诱导CuⅡ-Az结构基元2解折叠曲线并不完全重合。
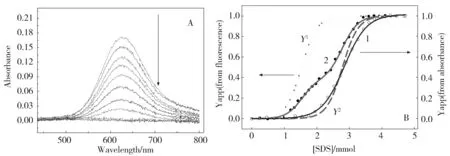
Fig.5 (A)Ultraviolet-visible specta of CuⅡ-Az in 50 mmol/L sodium acetate, pH,5.0 in different concentrations of SDS, (B) SDS-induced unfolding curves of CuⅡ-Az obtained by monitoring (1) the ultraviolet-visible spectra at 625 nm and (2) the fluorescence at 308 and 330 nm图5 (A)CuⅡ-Az在不同浓度SDS中的紫外可见吸收光谱,(B)由监测625 nm处的吸光度(1) 和330/308 nm荧光强度(2)得到的CuⅡ-Az的解折叠曲线
Az含有128个氨基酸残基,其中酸性氨基酸残基13个,碱性氨基酸残基17个,疏水性氨基酸残基55个,唯一的色氨酸残基位于疏水核中使蛋白质的最大荧光发射峰出现在308 nm处。按照结构基元模型,Az由2个结构基元组成,唯一的色氨酸残基位于结构基元1,铜结合位点位于结构基元2。荧光光谱监测的是位于疏水核中唯一色氨酸残基随变性剂SDS浓度变化其所处环境的变化,由于该蛋白含有大量的疏水性氨基酸残基,蛋白整体对变性剂SDS是较敏感的,-m(kJ/(mol·mmol/L)为10.23。可见吸收光谱监测的是位于结构基元2中铜结合位点配位环境的变化,只有能破坏铜配位环境时才有响应,即铜结合位点对变性剂SDS的敏感度较低,-m(kJ/(mol·mmol/L)为7.43。尽管CuⅡ-Az的铜结合位点对SDS的敏感度较低,但SDS的负电荷与五配位铜(Ⅱ)的静电作用、与非极性疏水氨基酸残基的疏水作用仍能破坏铜的配位环境。
即使在高浓度CTAB存在下,CuⅡ-Az的可见吸收光谱也没有变化,表明CuⅡ-Az铜(Ⅱ)离子的配位环境没有被破坏。CuⅡ-Az中的铜五配位环境呈正电性,有利于负电性基团(如SDS)进攻发生配体取代反应,而CTAB带正电荷,单分子CTAB不可能与CuⅡ-Az中的五配位铜(Ⅱ)发生配位取代反应。此外,SDS为十二烷基,在溶液中带负电荷,CTAB为十六烷基,在溶液中带正电荷。CTAB的临界胶束浓度很低,大约为0.16 mmol[13],在临界胶束浓度以下仅靠单分子与铜(Ⅱ)配位氨基酸残基间的疏水作用不足以破坏铜的配位环境,高浓度时CTAB形成胶束更不可能与极性区的铜结合位点作用。因此,CTAB不能使结构基元2发生解折叠。
2.4 SDS和CTAB诱导CuⅡ-Az解折叠态中色氨酸残基(Trp48)与结合铜(Ⅱ)离子间的距离
作为电子传递体,由于铜(Ⅱ)离子与apo-Az的Cys等残基配位,CuⅡ-Az是非常稳定的,即使在高浓度化学变性剂(GuHCl)存在下,铜(Ⅱ)离子仍与apo-Az结合[2]。因此,本文用Förster无辐射能量转移估算SDS和CTAB诱导CuⅡ-Az解折叠态中色氨酸残基(Trp48)与结合铜(Ⅱ)离子间的距离[14]。供体与受体之间的能量转移取决于供体的荧光发射光谱与受体紫外可见光谱的重叠积分,积分面积J可由公式(1)计算得到。
(1)
(1)式中,FD(ν) 为荧光供体在波数为ν的荧光强度;εA(ν) 为受体在波数为ν的摩尔消光系数。能量转移效率E与供体-受体之间的距离r及临界能量转移距离R0有关。
(2)
能量转移效率E可由公式(3)计算得到。
(3)
F0和F分别表示apo-Az 和CuⅡ-Az的荧光强度。
R0是能量转移效率为50%的临界距离。
(4)
其中K2为偶极空间的取向因子,为2/3。n为介质的折射指数,取值 1.33[14]。色氨酸的荧光量子产率φD, 取值 0.097[15]。
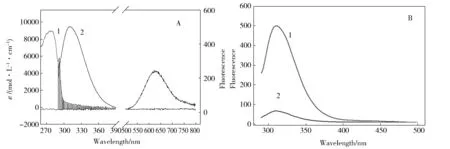
Fig.6 (A) Spectral overlap between the absorption spectrum of CuⅡ-Az (1) and emission spectrum of apo-Az (2), (B)Emission spectra of apo-Az (1) and CuⅡ-Az(2)图6 (A)CuⅡ-Az(1)的紫外可见吸收光谱和apo-Az(2)的荧光光谱,(B)apo-Az(1) 与CuⅡ-Az(2)的荧光光谱
在没有表面活性剂 (SDS和CTAB) 存在时,能量转移供体(Trp48)的发射光谱与受体(结合铜(Ⅱ))的紫外可见吸收光谱的光谱重叠图如图6A所示,由式(1)计算得到重叠积分值为5.38×10-16cm3·mol·L-1。根据式(4)可以求得能量转移效率为50%的临界能量转移距离R0为14.10 Å。相同状态下apo-Az与CuⅡ-Az的荧光发射光谱如图6B所示。可得能量转移效率E为0.80。按照式(2)可计算出结合铜(Ⅱ)与色氨酸残基(Trp48)之间的距离为11.19 Å,这一数值与晶体结构数据很接近(11.00 Å, 通过Pymol测量蛋白晶体1E5Y得到)。图4的解折叠曲线表明,2.0 mmol/L SDS 或1.0 mmol/L CTAB 存在下,CuⅡ-Az处于不同的解折叠状态,因此,我们测定了这两种表面活性剂存在时结合铜(Ⅱ)离子与色氨酸残基(Trp48)之间的距离,相应的参数列在表2中。
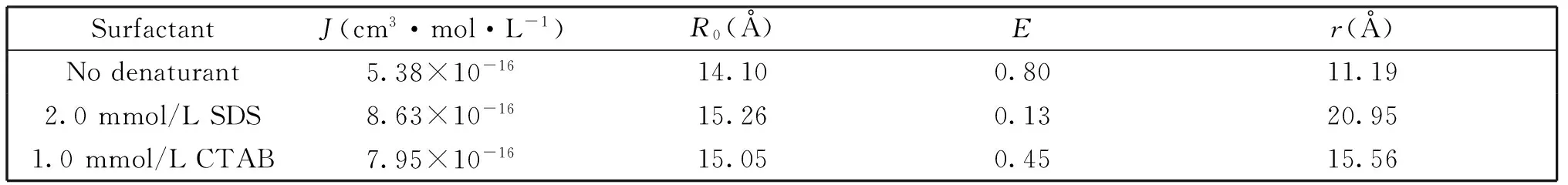
表2 不同表面活性剂存在下,CuⅡ-Az的一些参数
从表2中数据可知,天然态CuⅡ-Az中结合铜(Ⅱ)与色氨酸残基(Trp48)之间的距离约为11 Å,能量转移效率达80%;当有表面活性剂SDS或CTAB存在时,能量转移效率显著降低, CuⅡ-Az中结合铜(Ⅱ)与色氨酸残基(Trp48)之间的距离增大,分别约为21Å (2.0 mmol/L SDS中) 和16Å (1.0 mmol/L CTAB)。表明表面活性剂的确引起了蛋白质的解折叠,SDS诱导CuⅡ-Az解折叠的程度大于CTAB诱导CuⅡ-Az解折叠。
3 结论
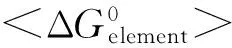
致谢:本文所用Az基因由中国科技大学刘扬中教授惠赠
[1] Baldacchini C,Bizzarri A R.Electorn Transfer,Conduction and Biorecognition Properties of the Redox Metalloprotein Azurin Assembled Onto Inorganic Substrates[J].EurPolymJ,2016,83:407-427.DOI:10.1016/j.eurpolymj.2016.04.030.
[2] Stafshede P W.Role of Cofactors in Folding of the Blue-Copper Protein Azurin[J].InorgChem,2004,43:7926-7933.DOI:10.1021/ic049398g.
[3] Larson B C,Pomponio J R,Shafaat H S,etal.Photogeneration and Quenching of Tryptophan Radical in Azurin[J].JPhysChemB,2015,119:9438-49.DOI:10.1021/jp511523z.
[4] Paraskevopoulos K,Sundararajan M,Surendran R,etal.Active Site Structures and the Redox Properties of Blue Copper Proteins:Atomic Resolution Structure of Azurin Ⅱ and Electronic Structure Calculations of Azurin,Plastocyanin and Stellacyanin[J].DaltonTrans,2006,25:3067-3076.DOI: 10.1039/b513942b.
[5] Miller J E,Gradinaru C,Crane B R,etal.Spectroscopy and Reactivity of a Photogenerated Tryptophan Radical in a Structurally Defined Protein Environment[J].JAmChemSoc,2003,125:14220-14221.DOI: 10.1021/ja037203i.
[6] Fuentes L,Oyola J,Fernandez M,etal.Conformational Changes in Azurin from Pseudomona Aeruginosa Induced Through Chemical and Physical Protocols[J].BiophysJ,2004,87:1873-1880.DOI:10.1529/biophysj.104.042580.
[7] Otzen D.Protein-surfactant Interactions:a Tale of Many States[J].BiochimBiophysicaActa,2011,1814:562-91.DOI: 10.1016/j.bbapap.2011.03.003.
[8] Yang B S,Song Z,Zheng X Y,etal.Stability of Proteins with Multi-state Unfolding Behavior[J].ScienceChinaChemistry,2012,55:1351-1357.DOI:10.1007/s11426-012-4642-6.
[9] Duan L,Zhao Y Q,Wang Z J,etal.Lutetium(Ⅲ)-dependent Self-assembly Study of Ciliate Euplotes Octocarinatus Centrin[J].JInorgBiochem,2008,102:268-77.DOI: 10.1016/j.jinorgbio.2007.08.010.
[10] Warren J J,Herrera N,Hill M G,etal.Electron flow Through Nitrotyrosinate in Pseudomonas Aeruginosa Azurin[J].JAmChemSoc,2013,135:11151-8.DOI: 10.1021/ja403734n.
[11] Song Z,Ming J,Yang B S.The Effect of Metals on SDS-induced Partially Folded States of CopC[J].JBiolInorgChem,2014,19:359-374.DOI: 10.1007/s00775-013-1071-8.
[12] Killian J A,Heijne G V.How Proteins Adapt to a Membrane—water Interface[J].TrendsBiochemSci,2000,25:429-434.
[13] Song Z,Ming J,Yang B S.Spectroscopic Probing of the Unfolding of the CopC Induced by Surfactant[J].ProteinPeptLett,2015,22:1031-1040.
[14] Zheng X Y,Pang E G,Yang B S,etal.The Role of Cupric in Maintaining the Structure of CopC[J].ChineseSciBul,2007,52:743-747.DOI: 10.1007/s11434-007-0089-0.
[15] Ugurbil K,Bersohn R.Tyrosine Emission in the Tryptophanless Azurin from Pseudomonas Fluorescens[J].Biochemistry,1977,16:895-901.
Unfolding of Azurin Induced by SDS and CTAB
MA Jianlong,YANG Binsheng*
(Institute of Molecular Science, Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan, 030006,China)
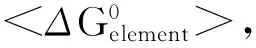
azurin;surfactant;stability
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.02.021
2017-01-17;
2017-02-14
国家自然科学基金(21571117);教育部博士点专项基金(20131401110011)
马剑龙(1991-),男,山西晋城人,在读硕士,从事无机化学方面研究,E-mail:1033095494@qq.com
*通信作者:杨斌盛(YANG Binsheng),E-mail:yangbs@sxu.edu.cn
O629
A
0253-2395(2017)02-0324-07
