药根碱与DNA G-四链体的相互作用研究
2017-05-25李俊芬樊鸽董川
李俊芬,樊鸽,董川
(1.山西大学 化学化工学院,山西 太原 030006;2.山西大学 环境科学与工程研究中心,山西 太原 030006)
药根碱与DNA G-四链体的相互作用研究
李俊芬1,樊鸽1,董川2
(1.山西大学 化学化工学院,山西 太原 030006;2.山西大学 环境科学与工程研究中心,山西 太原 030006)
DNA单链(PS2.M)在K+存在下可被诱导形成G-四链体。文章利用圆二色谱(CD)以及核磁共振光谱(NMR)表征了G-四链体的形成,并通过荧光滴定光谱、紫外滴定光谱以及核磁共振光谱研究了盐酸药根碱与G-四链体的相互作用。加入G-四链体后,药根碱在530 nm处的荧光明显增强;紫外吸收光谱表现出减色和红移现象,说明药根碱可能堆积到G-四链体的尾部或者插入到G-四链体尾部的两个G-四分体之间形成夹心结构。由等摩尔连续变化法算出药根碱和DNA的结合比为1∶1,利用Scatchard方程计算出二者的结合常数为3.12×106L/mol、结合位点为0.98。实验表明:盐酸药根碱与G-四链体有很强的相互作用,药根碱可以稳定DNA的G-四链体结构,二者的作用模式可能为末端堆积。
盐酸药根碱;G-四链体;光谱法;Scatchard方程
0 引言
G-四链体(G-quadruplex)结构是一种特殊的DNA二级结构,其结构的形成会对相应基因的表达水平及体内一系列的生物学功能产生影响,例如细胞增殖、细胞凋亡、信号转导和肿瘤的形成等。自从1991年Zahle[1]等证实K+能够稳定G-四链体结构并抑制端粒酶的活性以来,以G-四链体为靶点,通过稳定G-四链体结构或促进G-四链体的形成进而抑制癌细胞的增殖[2-5]。 能诱导和稳定G-四链体结构的化合物都可能成为潜在的治疗癌症新药物。近年来,G-四链体与配体相互作用的研究成为了肿瘤治疗和防治的热点研究之一,能与G-四链体结合的化合物的研究越来越引起化学家的关注。但是人们对G-四链体结构的研究还不够透彻,因此筛选出高选择性、高灵敏的能够诱导和稳定G-四链体结构的配体,仍然是个难题。
研究表明小檗碱类生物碱能够稳定G-四链体,从而抑制癌细胞的增长[6]。小檗碱对G-四链体具有较高的相对亲和性[7]。药根碱(Jatrorrhizine)属季铵型原小檗碱(QPA),它不仅具有抗肿瘤活性高、易于修饰、毒性低等特点。若药根碱对DNA四链体具有较强的选择性作用,则可以克服传统抗肿瘤药物以双螺旋DNA为靶点而对DNA非选择性的结合所引起的毒副作用。目前关于药根碱与G-四链体相互作用的系统研究报道甚少。
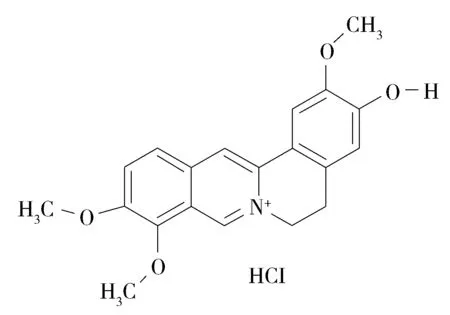
Fig.1 Structural formula of jatrorrhizine图1 盐酸药根碱的结构式
本文采用荧光光谱、紫外可见吸收光谱(UV)、圆二色谱(CD)和核磁共振氢谱(1H-NMR)探讨了药根碱和G-四链体DNA的相互作用,有望为潜在的抗肿瘤药物研究提供一定的理论依据。
1 实验部分
1.1 仪器与试剂
主要仪器:F-4500型荧光分光光度计(日本日立公司),U-2910紫外可见分光光度计(日本日立公司),MOS 450多功能圆二色谱仪(法国Bio-Logic公司),LX-200迷你型离心机(7 000 r/min),AVANCE Ⅲ HD(德国布鲁克公司)。
主要试剂:Tris-HCl缓冲缓冲溶液(5×10-3mol/L,pH=7.4,cK+=0.06 mol/L);盐酸药根碱(中国药品生物制品检定所);其余试剂均为国产分析纯,实验所有用水均为二次蒸馏水。DNA(5’-GTGGGTAGGGCGGGTTGG-3’)购自上海强耀生物科技有限公司。
1.2 实验方法
1.2.1 溶液的配置
①pH=7.4Tris-HCl缓冲溶液(tris:0.605 5 g,KCl:0.745 5 g,浓盐酸:41.67 μL,二次水),核磁所用的Tris-HCl由90%二次水和10%氘代水配置而成。
②5×10-3mol/L药根碱用Tris-HCl缓冲液配制,使用前适当稀释。
③DNA的处理:加入37.1 μL Tris-HCl缓冲溶解,放入90℃水浴锅中恒温10 min,待其冷却到室温方置于冰箱,4℃储存备用(5×10-3mol/L),使用时适当稀释。
1.2.2 实验过程
1)紫外可见滴定光谱:向1 cm比色皿中加入2.5 mL含Tris-HCl缓冲和8 μL 5×10-3mol/L药根碱,参比池中加入2.5 mL Tris-HCl,每次分别向比色皿和参比池中滴加0.5 μL DNA,扫描,直到吸光度无明显改变。
2)荧光滴定光谱:取700 μL 2.5×10-5mol/L药根碱加入1 cm荧光杯中,扫描药根碱的荧光光谱,接着每次滴加0.5 μL DNA进行扫描,直至荧光强度几乎不变(激发和发射狭缝设置:EX=5.0 nm,EM=10.0 nm,激发波长为340 nm)。
3)圆二色谱:取350 μL Tris-HCl缓冲溶液和2.5 μL DNA加入1 cm石英比色皿中,扫描此时DNA的圆二色谱,每次滴加10 μL药根碱,依次扫描直到无明显变化。
4)核磁共振谱:取500 μL 1.1×10-3mol/L的DNA以及150 μL浓度为3.71×10-3mol/L的DNA和350 μL浓度为1.73×10-3mol/L的药根碱的混合液分别加入核磁管中,扫描氢谱。
2 结果与讨论
2.1 药根碱与G-四链体DNA的紫外滴定光谱
紫外吸收光谱能够反映出化合物环境或结构的变化。当二者发生作用后,配合物的电子结构就会受到DNA电荷分布的影响,使得紫外吸收光谱发生减色和红移现象或者是增色和蓝移现象。一般来说,二者发生作用时,吸光度改变越大,说明二者的相互作用就越强[8-9]。
从图1可以看出药根碱在340 nm附近出现最大吸收峰,依次加入 DNA后其吸光度不断减弱,减色率为27.9%,最大吸收波长红移6 nm,并且分别在356 nm、366 nm、450 nm附近出现了等吸收点。由此说明药根碱与DNA形成了络合物,该现象与有关文献报道结果相似,说明在体系中达到了键合平衡。初步推断药根碱结合到了G-四链体的尾部或插入到了G-四链体的两个G-四集体之间形成夹心结构[9-12]。

Fig.2 Ultraviolet titration of jatrorrhizine with DNA,c药根碱=1.6×10-5 mol/L,curves from up to down图2 DNA与药根碱相互作用的紫外滴定光谱。c药根碱=1.6×10-5 mol/L,曲线由上到下cDNA=0~1.3×10-5 mol/L
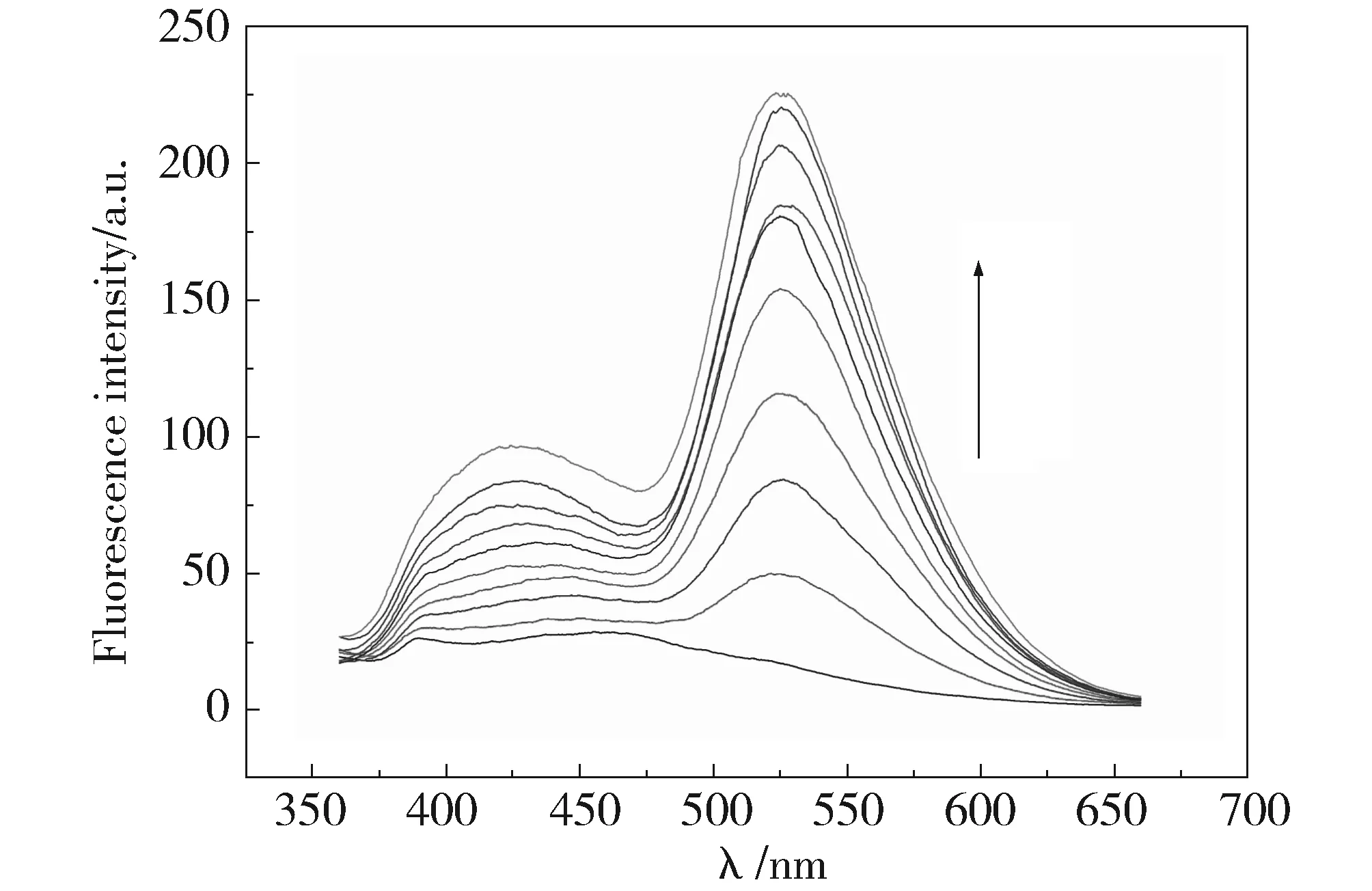
Fig.3 Fluorescence spectra titration of jatrorrhizine with DNA. c药根碱=5×10-5 mol/L,curves from down to up: cDNA=0~3.2×10-5 mol/L图3 G-四链体DNA滴定药根碱的荧光光谱,c药根碱=5×10-5 mol/L,曲线由下到上cDNA=0~3.2×10-5 mol/L
2.2 药根碱与G-四链体DNA的荧光光谱滴定
DNA与荧光较弱的小分子发生嵌插结合时,会使其荧光强度增强[13]。从图3可看出药根碱本身几乎没有荧光,但是随着DNA的不断加入,在425 nm和525 nm左右的峰强度都出现了明显的增强。这表明药根碱与G-四链体DNA发生了较强的作用。
采用等摩尔连续变化曲线法考察药根碱与G-四链体DNA作用的可能的结合位点数[14],由荧光发射波长处的荧光强度对两者摩尔比作图,如图4示,由图可看出药根碱与G-四链体DNA之间是单一的键合模式, 即1∶1的比例结合。
当G-四链体DNA与药根碱按1∶1比例结合时,可遵循Scatchard方程[14-15]:
r/cf=K(n-r)
(1)
其中K和n分别指的结合常数和结合位点,r是cb/[ct-DNA]的比值,cf=ct-cb是游离的药根碱浓度,并且cb可以用下列公式计算:
cb=ct[(F-F0)/(Fmax-F0)]
(2)
其中,药根碱ct=2.5×10-5mol/L,F0和F分别是药根碱最大荧光强度和每次加入DNA后的最大荧光强度,Fmax是二者反应完全时的最大荧光强度。根据(1)及(2),分别以r为横坐标,r/cf为纵坐标,作r-r/cf关系图,如图5所示。由直线的斜率和截距得到的结合常数K=3.12×106L/mol,结合位点n=0.977 6。说明药根碱与G-四链体发生了较强的结合。
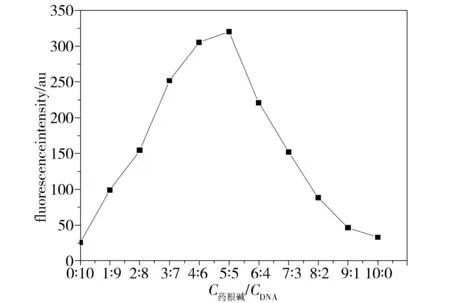
Fig.4 Job’s plot of DNA was obtained by different concentration ratio,plots from left to right was respectively concentration of c药根碱/cDNA:0∶10、1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0图4 药根碱和DNA作用的等摩尔变化曲线,图中从左到右各点所代表的摩尔比分别是c药根碱/cDNA:0、1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1、10∶0

Fig.5 Scatchard plot of G-quadruplex and jatrorrhizine图5 G-四链体和药根碱相互作用的Scatchard图
2.3 药根碱与G-四链体DNA相互作用的核磁共振氢谱研究
核磁共振谱图能够明了的显示出小分子与DNA键合的详细结构信息,亚胺质子化学位移>12.5 ppm,表示的是Watson-Crick碱基对(NH…N)氢键存在;化学位移在10.5~12 ppm,表示鸟嘌呤的氢键(NH…O)的存在,形成了G-四分体[18]。图6可以看出,未加入药根碱时,G-四链体低场区出现了四个峰,表明四分体的形成;加入药根碱后,其中两个峰消失,另外两个峰向高场移动,且峰强度减弱,表明药根碱与G-四链体
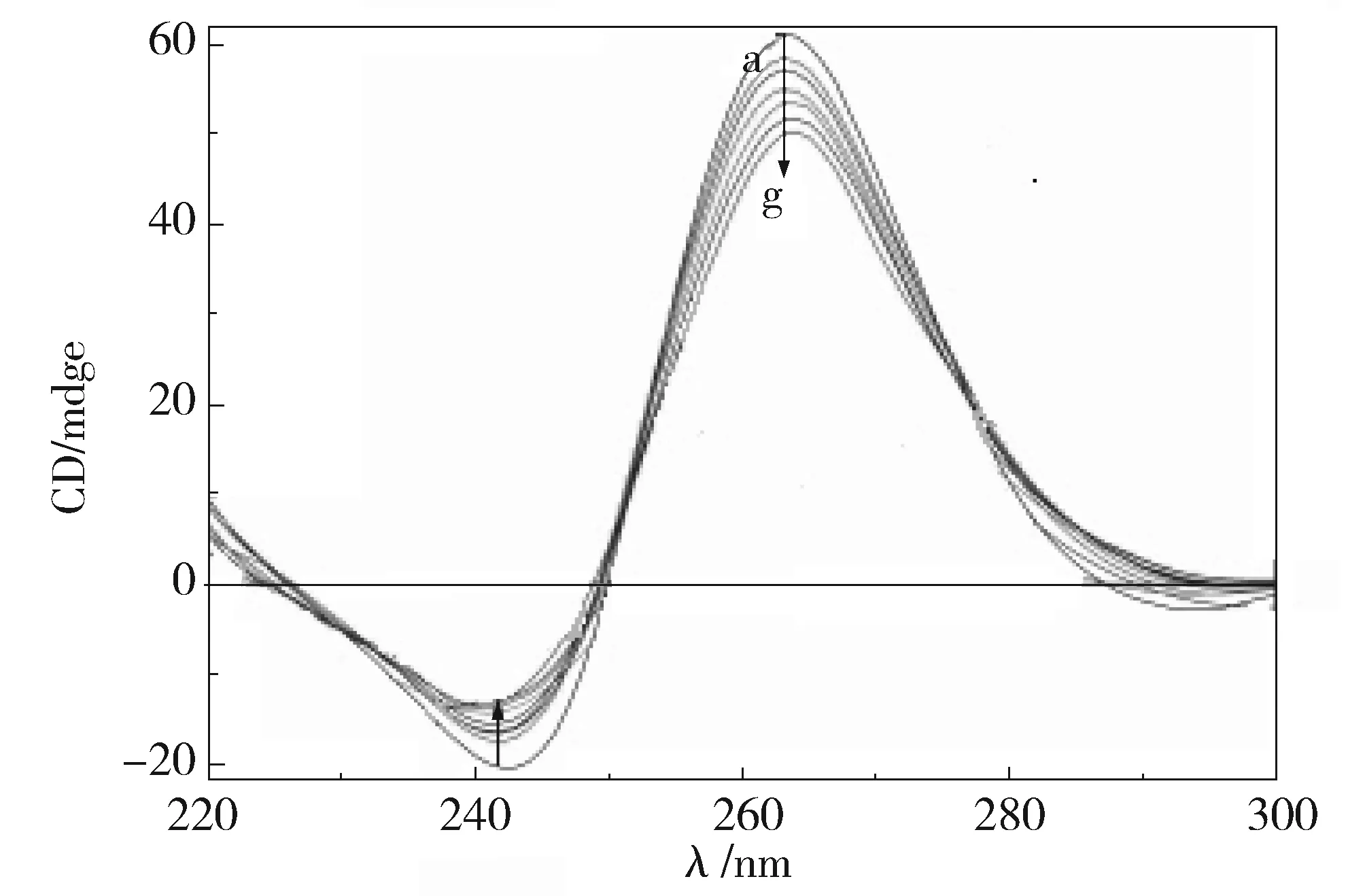
Fig.6 CD titration spectra of jatrorrhizine with DNA cDNA=3.5×10-5 mol/L,c药根碱=0~7.1×10-5 mol/L图6 药根碱滴定DNA的圆二色谱,cDNA=3.5×10-5 mol/L,a-g:c药根碱=0~7.1×10-5 mol/L

Fig.7 1H-NMR spectra of the mixture of jatrorrhizine and DNA (curve 1 is the 1H-NMR curve of interaction between jatrorrhizine and DNA;curve 2 is the 1H-NMR curve of DNA)图7 药根碱与G-四链体的1H-NMR(曲线1是药根碱与DNA发生相互作用后的1H-NMR;曲线2是DNA的1H-NMR)
发生相互作用,药根碱与G-四链体结合之后氨基质子周围的电子云密度增大,屏蔽效应也随之增强,导致峰位向高场移动[17-19]。
3 结论
本文利用圆二色谱(CD)证实K+存在下,核酸适配体PS2.M形成了平行的G-四链体结构,并通过荧光滴定光谱、紫外滴定光谱以及核磁共振谱研究了盐酸药根碱与G-四链体的相互作用。通过等摩尔连续变化法推测药根碱和DNA的结合比为1∶1,且紫外滴定光谱的红移和减色现象表明药根碱可能堆积在G-四链体的尾部,并通过Π-Π堆积和偶极-偶极相互作用达到稳定;根据Scatchard方程计算结合常数达到106,核磁共振氢谱也同样表明药根碱能够改变DNA的构象,形成G-四链体。以上结果均说明药根碱能够和G-四链体发生很强的作用,并且能够使G-四链体的结构更稳定,其作用模式可能是末端堆积作用,后期还将对其作用模式进一步研究探讨。
[1] Zahler A M,Williamson J R,Cech T R,etalInhibition of Telomerase by G-quartet DNA structures[J].Nature,1991,350(6320):718-720.DOI:10.1038/350718a0.
[2] 郑小辉,穆舸,谭彩萍,等.G-四链体DNA稳定剂的研究进展[J].中国科学:化学,2014,44:485-488.DOI:10.1360/0302013-340.
[3] Zhao Xiaolong,Liu Xiaoyuan,Yang Ruibo,etal.Research Progress in Interaction between Ruthenium Complexes and G-quadruplex DNA[J].Chemistry,2015,78(10):873-876.DOI:10.14159/j.cnki.0441-3776.2015.10.002.
[4] Gao Chao,Liu Shuyao,Zhang Xian,etal.Two-photon Fluorescence and Fluorescence Imaging of Two Styryl Heterocyclic Dyes Combined with DNA[J].Elsevier,2015:4-6.DOI:10.1016/j.saa.2015.11.014.
[5] Boschi E,Davis S,Touylor S,etal.Interaction of a Cationic Porpluyrion and its Metal Devivatives with G-Quadmplex DNA[J].Journal of Physical Chemistry B,2016,120(50):12807-12819.DOI:10.1021/acs.jpcb.6b09827.
[6] 刘慧,黄承志.荧光碳点与小檗碱类药物的作用及盐酸药根碱的选择性测定[J].中国科学·化学,2016,8:810-815.DOI:10.1360/N032015-00200.
[7] 马彦,黄志纾.高选择性端粒G-四链体稳定性配体:9-O-多胺取代小檗碱衍生物的合成及活性评价[J].高等学校化学学报,2012,33:2219-2221.DOI:10.7503/cjcu20120327.
[8] 黄琦,汪维鹏,钟文英,等.药物分子与DNA相互作用的研究方法[J].中南药学,2004,2:354-356.
[9] 龙玉华.原小檗碱衍生物的合成及其与DNA作用的研究[D].广州:中山大学,2006:43-50.
[10] 鄢远,许金钩,陈国珍.三维荧光光谱法研究蛋白质溶液构象[J].中国科学(B辑),1997,27(1):16-22.
[11] 李静,李景印,郭玉凤.生物小分子与DNA相互作用的光谱及电化学研究进展[J].化学学报,2005,16:101-104.
[12] 孙红霞,向俊锋,张亚周,等.光谱法研究G-四链体与亚甲蓝之间的相互作用[J].科学通报,2006,51(9):1022-1026.
[13] Wu Fei.DNA Recognition base on Sequence·Dependent Site Strong Binding of the Alkaloids to DNA Abasic Site[D].Zhejiang Normal University,2013:6-19.DOI:10.1371/journal.pone.0048251.
[14] Prabal Giri,Gopinatha Suresh Kumar.Spectroscopic and Calorimetric Studies on the Binding of the Phototoxic and Cytotoxic Plant Alkaloid Sanguinarine with Double Helical Poly(A)[J].Elsevier,2008,194:111-121.DOI:10.1016/j.jphotochem.2007.07.022.
[15] 孟彦波,张立峰,蒋晔.药物分子与DNA相互作用分析方法的概述[J].中国药师,2010,13:572-574.
[16] 鲍伟伟.G-四联体的构象调控及其与小分子配体的相互作用研究[D].温州:温州大学,2014:16-28.
[17] Zhou Qiuju,Li Lin,Xiang Junfeng,etal.Fast Screening and Structural Elucidation of G-quadruplex Ligands from a Mixture Via G-quadruplex Recognition and NMR Methods[J].Biochimie,2009,91(2):304-308.DOI:10.1016/j.biochi.2008.10.011.
[18] 周秋菊,向俊锋,唐亚林.核磁共振波谱在药物发现中的应用[J].波谱学杂志,2010,27(1):71-73.
[19] Liu Changdong,Zhu Guang.Quadruplex Nucleic Acid Structure Determination by Solution NMR[J].ChineseJournalofMagneticResonance,2015,32(2):151-156.DOI:10.11938/cjmr20150202.
Study on the Interaction of Jatrorrhizine and DNA G-quadruplex
LI Junfen1,FAN Ge1,DONG Chuan2
(1.School of Chemistry and Chemical Engineering,Shanxi University,Taiyuan,Shanxi 030006,China;2.Institute of Chemistry,Environmental-science and Engineering-study Center,Shanxi University,Taiyuan 030006,China)
Single stranded DNA(PS2.M) is induced to fold into G-quadruplex in the presence of K+. The characteristic spectra of G-quadruplex were characterized by NMR and CD, meanwhile the interactionspectra between jatrorrhizine and G-quadruplex was studied by fluorescence spectrum,ultraviolet absorption spectrum and nuclear magnetic resonance, which showed the strong interaction of jatrorrhizine with the G-quadruplex. With the addition of G-quadruplex, the fluorescence spectra show that the fluorescence intensity of jatrorrhizine appeared significant increase in 530nm, and UV spectra show the phenomenon of hypochromic effect and red shift. Jatrorrhizine has strong binding ability with DNA, and the binding mode is intercalation. According to the continuous equivalent change method, it is inferred that the jatrorrhizine and DNA combined with 1∶1. And according to the Scatchard equation,the binding constant is 3.12×106L/mol and the binding site is 0.98. The experiments indicate that jatrorrhizine has strong binding capacity with G4 DNA and combined with DNA by terminal stacking.
jatrorrhizine;G-quadruplex;spectrometry;scatchard equation
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.02.019
2016-10-20;
2016-12-21
国家自然科学基金(21105060)
李俊芬(1974-),女,山西运城人, 副教授,博士,研究方向:分子光谱分析及药物分析,E-mail:junfenli@sxu.edu.cn
O657.3
A
0253-2395(2017)02-0311-05
