儿童初发原发性肾病综合征伴高凝状态57例临床分析
2017-05-25汉尹梦笛吕筱航张高福王墨阳海平李
陈 汉尹梦笛吕筱航张高福王 墨阳海平李 秋
1.重庆医科大学附属儿童医院肾内科 儿童发育疾病研究教育部重点实验室(重庆 400014);2.成都市第三人民医院儿科(四川成都 610031)
儿童初发原发性肾病综合征伴高凝状态57例临床分析
陈 汉1尹梦笛2吕筱航1张高福1王 墨1阳海平1李 秋1
1.重庆医科大学附属儿童医院肾内科 儿童发育疾病研究教育部重点实验室(重庆 400014);2.成都市第三人民医院儿科(四川成都 610031)
目的探讨儿童初发原发性肾病综合征(PNS)伴高凝状态的临床特征、影响因素。方法回顾分析57例初发PNS患儿的临床资料,并对高凝状态组、非高凝状态组,以及20例正常对照组的临床特征及治疗情况进行比较,同时分析高凝状态下单纯型肾病组(SNS)和肾炎型肾病组(NNS)的差异,并进行相关性分析。结果57例患儿中,高凝状态组50例,非高凝状态组7例,两组间性别、年龄及临床表现差异均无统计学意义(P>0.05);高凝状态组的血小板数目(PLT)、血小板压积(PCT)、白蛋白(Alb)、纤维蛋白原(Fib)、D-二聚体(D2)与正常对照组比较差异有统计学意义(P<0.01);高凝状态组和非高凝状态组在PLT、Fib、D2、补体C4水平差异有统计学意义(P<0.05)。50例高凝状态患儿中,SNS组(32例)和NNS组(18例)的HCT、TC、LDL、PT、补体C3水平差异有统计学意义(P<0.05);HCT与补体C3呈显著正相关(r=0.30,P<0.05),PLT与其他指标无显著相关性(P>0.05)。57例患儿经治疗后无血栓事件发生,病情好转。结论初发PNS患儿多伴有不同程度的高凝状态,PLT、Fib、D2可作为高凝状态严重程度的参考指标,补体系统激活与高凝状态发生发展可能相关。
原发性肾病综合征; 高凝状态; 儿童
高凝状态又称血栓前状态,是儿童原发性肾病综合征(primary nephrotic syndrome,PNS)常见的并发症,目前对于高凝状态与儿童PNS发生发展关系认识较少,同时对高凝状态的干预及治疗缺少共识。为此,对重庆医科大学附属儿童医院肾内科住院的57例初发PNS伴高凝状态患儿的临床特征进行探讨,旨在了解儿童PNS伴高凝状态的临床意义,并为儿童PNS合并高凝状态的治疗提供合理依据。
1 对象及方法
1.1 研究对象
回顾性分析2015年6月—2016年7月57例初发住院PNS患儿。纳入标准:①年龄≤16岁,性别不限;②起病<4周,且未使用糖皮质类激素或激素治疗时间<3 d;③PNS相关诊断标准参照中华医学会儿科分会肾脏病学组儿童常见肾脏疾病诊治循证指南[1]。
根据患儿凝血功能检测值,筛选凝血功能正常PNS患儿为非高凝状态组,凝血功能异常PNS患儿为高凝状态组,高凝状态具有以下标准[2]:凝血酶原时间(PT)较正常值缩短3 s,活化部分凝血酶原时间(APTT)较正常值缩短10 s,D-二聚体(D2)>0.5 mg/L,纤维蛋白原(Fib) ≥ 4 mg/L;高凝状态组PNS患儿中,根据临床表现分为单纯型肾病综合征(simple nephrotic syndrome,SNS)和肾炎型肾病综合征(nephritic-nephrotic syndrome,NNS),同时参考中国3~17岁儿童青少年血压评价标准[3]。对照组正常儿童为同期的外科疝气择期手术患儿20例,年龄≤16岁,性别不限。
1.2 方法
1.2.1 临床资料收集 通过病史查询,收集患儿的人口学特征(年龄、性别),以及血小板数目(PLT)、红细胞比容(HCT)、血小板压积(PCT)、白蛋白(Alb)、PT、APTT、D2、Fib、凝血酶时间(TT),总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL),免疫球蛋白IgG、IgA、IgM、IgE、补体C3、补体C4,24小时微量蛋白定量(24 UQ)等实验室检测结果。
1.2.2 实验室指标检测 患儿入院次日清晨空腹抽取静脉血,PLT、HCT、PCT等指标予以血液分析仪进行血常规的检测;Alb以醋酸纤维素膜法检测;24 UQ:严格留取24小时尿液,采用双缩脲法检测。血脂各指标:TC采用胆固醇氧化酶法,TG采用酶比色法,LDL采用选择性可溶法,HDL采用化学修饰酶法;凝血功能的检测采用血凝透射比浊法;免疫功能的检测采用英国MININEPH公司标准抗血清、稀释液、缓冲液,采用ELISA法检测,所有标本在送检2小时内检测。
1.2.3 治疗方法 依据儿童常见肾脏疾病诊治循证指南[1],所有PNS患儿均口服醋酸泼尼松抗炎,口服双嘧达莫联合丹参酮ⅡA磺酸钠10 mg/d静滴抗凝治疗。如合并感染,使用敏感抗生素。
1.3 统计学分析
采用SPSS22.0软件进行统计学分析。计数资料以百分比表示,组间比较采用校正χ2或Fisher精确概率法检验。正态分布计量资料以均数±标准差表示,组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用Wilcoxon秩和检验。各项指标相关性采用Pearson或Spearman检验;以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象一般情况
57例PNS患儿中,合并高凝状态的有50例,其中男35例、女15例,男女比例为2.3:1,中位年龄3岁8个月(8个月~13岁8个月);非高凝状态组7例,其中男4例、女3例,男女比例为4:3,中位年龄3岁9个月(1岁5个月~11岁3个月)。正常对照组儿童20例,男13例、女7例,中位年龄2岁5个月(范围:8 个月~16岁),PNS组和正常对照组儿童之间在性别(χ2=0.08,P=0.779)、年龄(Z=1.19,P=0.244)差异均无统计学意义。高凝状态组和非高凝状态组之间性别(χ2=0.06,P=0.802)、年龄(Z=0.35,P=0.752)差异均无统计学意义。
2.2 临床表现
高凝状态组和非高凝状态组初期颜面水肿、全身水肿、腹腔积液、少尿等临床症状的发生率差异均无统计学意义(P>0.05)。高凝状态组中,SNS 32例(64%),NNS 18例(32%);非高凝状态组中,SNS 5例(80%),NNS 2例(20%),两组在临床类型上差异无统计学意义(χ2=0.00,P=1.000)。高凝状态组中,SNS和NNS高血压表现者分别有6例(18.8%),9例(50.0%),差异有统计学意义(χ2=5.36,P=0.021),余临床表现均无统计学意义(P >0.05)。
2.3 实验室检查
高凝状态组患儿中,PLT、PCT、Alb、Fib、D2与正常对照组儿童相比差异有统计学意义(t=2.46~19.70,P均<0.05)。高凝状态组患儿的PLT、Fib、D2、补体C 4水平均高于非高凝状态组,差异有统计学意义(P<0.05)。见表1。高凝状态组中,SNS组的HCT、TC、LDL、补体C3水平均高于NNS组,而SNS组的PT短于NNS组,差异均有统计学意义(P<0.05),余实验室指标差异均无明显统计学意义(P>0.05)。见表2。

表1 PNS高凝状态组与非高凝状态组实验室指标的比较
2.4 各指标相关性分析
伴有高凝状态患儿中,HCT与补体C3呈正相关(r=0.30,P=0.045);PLT与其他指标无显著相关性(P>0.05)。
2.5 并发症
高凝状态组和非高凝状态组相比,两组在泌尿道感染发生率上差异有统计学意义(χ2=4.02,P<0.05),两组间其余并发症差异均无统计学意义(P>0.05)。见表3。在治疗期间,两组患儿均无血栓事件发生;在高凝状态组中,SNS组急性肾功能不全发生率为0%(0/32),和NNS组(61%,11/18)相比,差异有统计学意义(χ2=21.63,P<0.001),两组间其余并发症发生率差异均无统计学意义(P>0.05)。
2.6 治疗及随访
高凝状态组患儿经激素抗炎,双嘧达莫联合丹参酮ⅡA磺酸钠静滴抗凝,均临床症状好转出院,高凝状态较前明显改善,Fib、D2下降(P<0.05),复查PLT、TC、TG、LDL、24 UQ较治疗前明显下降,低蛋白血症较前纠正(P均<0.05);出院1个月后随访,失访3例,均来自高凝状态患儿,高凝状态组复发12例(25.5%),除4例有高水平Fib外(8.5%),其余凝血功能恢复正常。非高凝状态组复发2例(28.6%),随访凝血功能未见异常。高凝状态组32例表现为激素敏感型、7例为激素耐药型、8例为激素依赖型;非高凝状态组5例为激素敏感型、激素耐药型和激素依赖型分别为1例,两组激素疗效的差异无统计学意义(P=1.000)。高凝状态组中SNS和NNS组激素疗效相比,90.3%(28/31)的SNS表现为激素敏感型,75.0%(12/16)NNS主要以激素耐药/依赖型NS为主要表现,二者差异具有统计学意义(P<0.001)。
3 讨论
血栓栓塞是PNS极其危险的并发症,高凝状态是其早期表现,其发生、发展是一个复杂的病理过程,包括血管内皮损伤及血小板活化、凝血系统激活、抗凝物质缺失、纤溶活性增强、脂质代谢紊乱等过程[4,5]。研究显示PNS和继发性NS血栓栓塞的发生率分别为6.6%和17.1%,深静脉血栓比例占76.3%,可以导致患儿活动障碍甚至威胁患儿生命[6]。因此,分析探讨初发PNS伴高凝状态发生的临床特征,选择合适的治疗时机和方法,随访患儿的预后情况成为临床工作中不容忽视、亟待解决的问题。
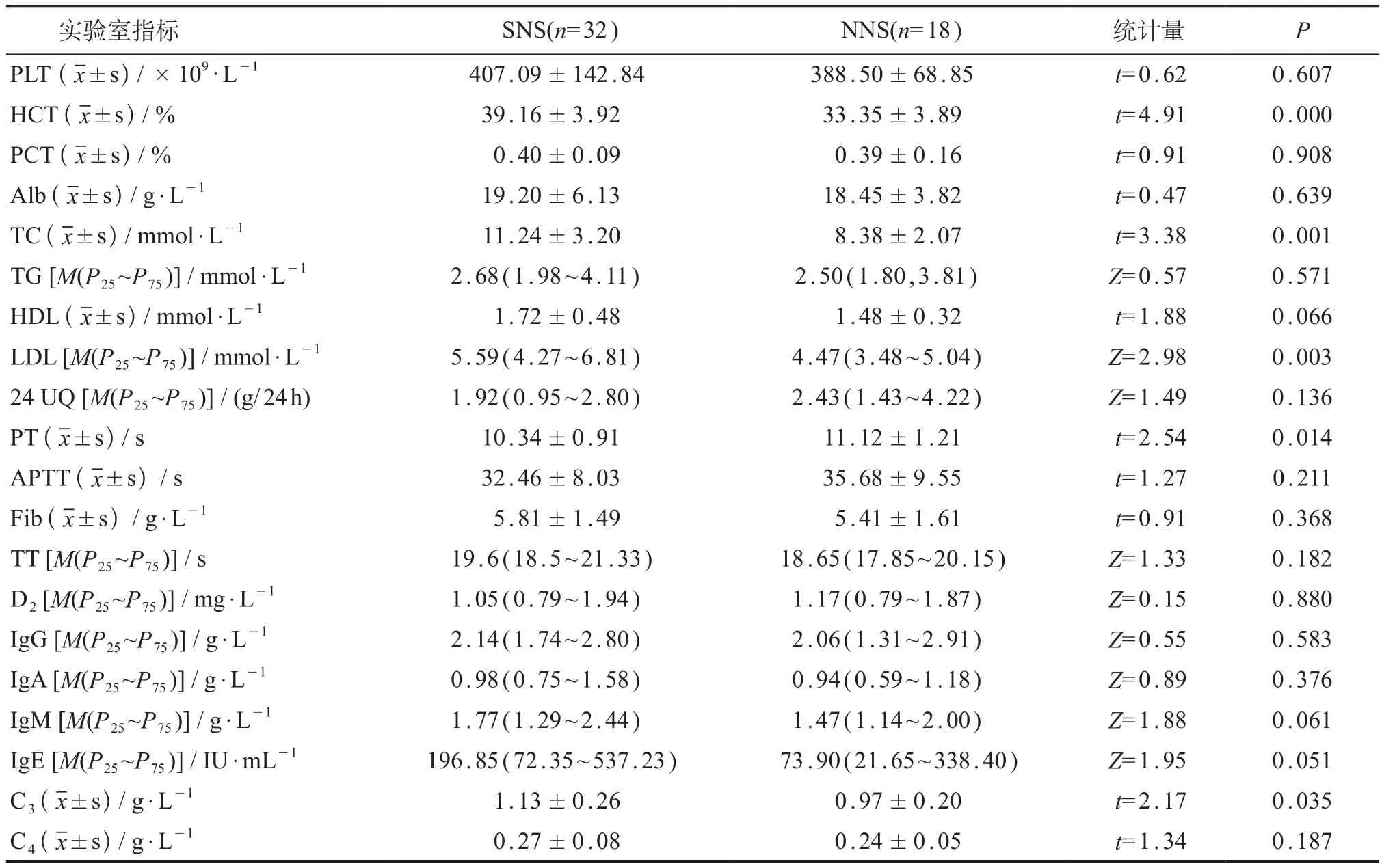
表2 高凝状态下SNS与NNS实验室指标的比较

表3 高凝状态组与非高凝状态组患儿并发症比例比较[n(%)]
本研究显示在初发PNS中大部分患儿有不同程度的高凝状态(87.7%)。不同年龄组的儿童均可发生且男女比例2.3:1,与文献报道[7]类似,表明高凝状态的发生和年龄性别无相关性,其分布与PNS的流行病学特征有关。
水肿是PNS常见临床表现,患儿多以颜面或全身水肿为主要表现,伴有胸水、腹水表现,其主要由血浆胶体压下降、肾性水钠潴留等机制引起。尿蛋白的丢失降低了血浆渗透压,造成血液浓缩,并发的高脂血症使血液黏度增加,进一步加重高凝状态,导致栓塞和血栓,使肾小球局部循环障碍,导致急性肾功能不全[8]。本研究显示高凝状态和非高凝状态PNS患儿水肿的程度和表现无区别,特别是胸水、腹水的发生率二者无差异。同时,高凝状态下,NNS与SNS的发生率无明显差异。出现上述结果可能与本研究纳入初发PNS患儿例数较少有关,特别是非高凝状态组患儿的例数。
由于血栓前状态涉及因素多,相关特异性实验室检查缺乏临床操作性,目前对于NS高凝状态的评判无共识,尤其是对用药时机的选择,多数研究以DIC筛查指标作为参考[9]。NS在高凝状态下和DIC高凝期非常类似,但并不完全一致,当NS患儿出现出血倾向时,应考虑DIC诊断。本研究显示高凝状态组患儿的PLT、Fib、D2较正常对照组儿童和非高凝状态组显著增加,PCT较正常对照组儿童增加,Alb较正常儿童明显降低。在高凝状态下主要表现为PLT、Fib、D2的异常,PT、APTT在初发PNS早期无明显改变。既往研究表明NS患儿血小板数量和功能亢进,使PCT升高,血小板的功能异常主要与低蛋白血症、高脂血症、高纤维蛋白原有关[2],相关性分析显示PLT与其他实验室结果无显著相关性,提示血小板可能是高凝状态的一个独立危险因素。高凝状态组补体C4水平与非高凝状态患儿相比有显著差异,提示补体系统可能参与高凝状态的形成,既往也有研究证实补体旁路的过度激活明显影响体内凝血功能,导致血液高凝状态[10,11]。
临床上PNS分为SNS和NNS,本研究显示在高凝状态组中,SNS的TC、LDL、HCT、补体C3水平较NNS高,PT较NNS有缩短,可能原因是:①NNS的病理生理过程较SNS复杂,在没有肾脏病理证实的情况下,不能完全除外继发性NS,其肾组织常伴有不同程度的炎症反应,在炎症状态下,脂质向细胞内转移可能导致 NNS的血脂水平下降[7]。此外,SNS可向NNS转化,脂质介导(尤其LDL)的肾脏损害是其主要过程[12]。②NNS的补体C3水平与SNS相比明显下降,提示补体C3可能参与了NNS的发生发展过程,其机制有待进一步研究证实。同时本研究显示HCT与补体C3呈正相关,补体C3的下降程度与肾脏损害有非常显著相关性,提示高凝状态下HCT的水平可能与肾脏的损害程度有相关性[13]。PT是反映外源性凝血系统激活的指标,PT缩短提示外源性凝血途径活跃,提示高凝状态下SNS较NNS更易发生外源性凝血途径激活。
感染是初发PNS患儿的最常见并发症,感染可诱发或加重高凝状态[14]。本研究纳入的患儿经过超声及影像学检查均未发现血栓形成。本研究纳入的高凝状态患儿经激素抗炎联合双嘧达莫、丹参酮ⅡA磺酸钠抗凝治疗,临床症状均好转出院,凝血功能和血液生化指标明显改善,均未额外使用抗凝药物,如肝素、低分子肝素、尿激酶等,随访提示高凝状态可随炎症的控制而恢复正常。目前关于肝素及低分子肝素应用时机和方法尚有争议,既往研究认为达到高凝状态初筛标准且抗凝血酶Ⅲ活性<70%或膜性肾病即可使用抗凝药物,另有研究认为当NS患者具有严重的低白蛋白血症(ALB≤20 g/L)和严重的高TC血症(≥12 mmol/L)时,同时伴有高纤维蛋白原血症(Fib>4 g/L)有低分子肝素使用指征[16]。相关研究对36例NS合并高凝状态患儿使用低分子肝素治疗后指出,明显的低白蛋白血症、高脂血症(特别是血TC>12 mmol/L)、PLT较高者(>300 ×109/L),非微小病变型NS患儿均有使用低分子肝素指征[17]。因此,对于儿童初发PNS伴高凝状态的药物干预时机、疗效及远期预后,需要进一步开展临床随机对照试验明确。
[1]中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治循证指南(一): 激素敏感、复发/依赖肾病综合征诊治循证指南(试行) [J]. 中华儿科杂志, 2009, 47(3): 167-170.
[2]Sagripanti A, Barsotti G. Hypercoagulability, intraglomerular coagulation, and thromboembolism in nephrotic syndrome [J]. Nephron, 1995, 70(3): 271-281.
[3]米杰. 中国3-17岁儿童青少年血压评价标准 [J]. 中国儿童保健杂志, 2010, 18(6): 534.
[4]张莹, 夏正坤. 儿童原发性肾病综合征并发高凝状态与血栓栓塞的机制 [J]. 肾脏病与透析肾移植杂志, 2012, 21(1): 64-67.
[5]Enas EA, Chacko V, Senthilkumar A, et al. Elevated lipoprotein (a)-a genetic risk factor for premature vascular disease in people with and without standard risk factors: a review [J]. Dis Mon, 2006, 52(1): 5-50.
[6]Kerlin BA, Blatt NB, Fuh B, et al. Epidemiology and risk factors for thromboembolic complications of childhood nephrotic syndrome: a Midwest Pediatric Nephrology Consortium (MWPNC) study [J]. J Pediatr, 2009, 155(1): 105-110.
[7]王莉, 李秋, 张伟, 等. 964例儿童原发性肾病综合征的临床分析 [J]. 第三军医大学学报, 2008, 30(19): 1849-1851.
[8]郑法雷, 章友康,陈香美,等. 肾脏病临床与进展 [M].北京:人民军医出版社, 2005.
[9]陈文彬, 潘祥林, 康熙雄,等. 诊断学 [M]. 北京: 人民卫生出版社, 2011.
[10]Semeraro N, Ammollo CT, Semeraro F, et al. Sepsis, thrombosis and organ dysfunction [J]. Thromb Res, 2012, 129(3): 290-295.
[11]李敏, 孙黔云, 赵琼, 等. 补体旁路过度激活影响体内凝血功能 [J]. 中国药理学通报, 2014, 30(1): 39-34.
[12]Zubovic SV, Kristic S, Prevljak S,et al. Chronic kidney disease and lipid disorder [J]. Med Arch, 2016, 70(3): 191-192.
[13]李永珍, 何庆南. 原发性肾病综合征免疫发病机制的研究进展 [J]. 国际儿科学杂志, 2016, 4(1): 51-55.
[14]Hashmi M, Wasay M. Caring for cerebral venous sinus thrombosis in children [J]. J Emerg Trauma Shock, 2011, 4(3): 389-394.
[15]Schlegel N. Thromboemblic risks and complications in nephritic children [J]. Semin Thromb Hemost, 1997, 23(3): 271-280.
[16]张毓文. 持续性高凝状态对小儿肾病慢性因素的影响和治疗 [J]. 中国实用儿科杂志, 2002, 17(9): 517-520.
[17]夏正坤, 刘光陵, 高远赋,等. 低分子肝素治疗36例肾病综合征合并高凝状态的疗效观察 [J]. 肾脏病与透析肾移植杂志, 1999, 8(15): 442-444.
Clinical analysis of primary nephrotic syndrome combined with hypercoagulable state in 57 children
CHEN Han1, YIN Mengdi2, LYU Xiaohang1, ZHANG Gaofu1, WANG Mo1, YANG Haiping1, LI Qiu1
(1.Department of Nephrology, Key Laboratory of the Ministry of Education, Children’s Hospital of Chongqing Medical University, Chongqing 400014, China; 2. Department of Pediatrics, The Third People's Hospital of Chengdu, Chengdu 610031, Sichuan, China)
ObjectiveTo explore the clinical characteristics and in fl uencing factors of primary nephrotic syndrome (PNS) combined with hypercoagulability in children.MethodsThe clinical data of 57 children with primary PNS were analyzed retrospectively. The clinical features and treatment were compared among high coagulation state group, non high coagulation state group and control group (20 children). At the same time, the differences between the simple nephrotic syndrome group (SNS) and nephritic syndrome group (NNS) in hypercoagulable state were analyzed. In addition, the correlation analysis was performed.ResultsAmong 57 patients, there were 50 patients in high coagulation state group and 7 in non high coagulation state group. There was no signi fi cant difference in gender, age and clinical manifestations between two groups (P>0.05). The platelet (PLT) count, platelet aggregation (PCT), albumin (Alb), fibrinogen (Fib), D-dimer (D2) were significantly higher than those in the control group, and there were statistically signi fi cant differences (P all<0.01). There were signi fi cant differences in the levels of PLT, Fib, D2and complement C4 between hypercoagulable state group and non hypercoagulable state group (P all<0.05). There were signi fi cant differences in HCT, TC, LDL, PT and complement C3 levels between SNS group (n = 32) and NNS group (n = 18) in 50 patients with high coagulation state (P<0.05). There was positive correlation between HCT and complement C3 (r=0.30, P<0.05), while there was no correlation between PLT and other indices (P>0.05). All of the 57 patients were improved and has no thrombosis after the treatment.ConclusionChildren with primary PNS were usually associated with different degrees of hypercoagulable state, and PLT, Fib, D2could be used as reference indices for the severity of hypercoagulable state, and the activation of complement system might be related to the occurrence and development of hypercoagulable state.
primary nephrotic syndrome; hypercoagulable state; child
10.3969/j.issn.1000-3606.2017.04.007
2016-09-12)
(本文编辑:邹 强)
国家自然科学基金 (No.81270802, 81470946, 81200520)
阳海平,李秋 电子信箱:oyhp0708@163.com
