Mac-1基因缺失抑制小鼠黑色素瘤肺转移的机制
2017-05-25段有发叶志金王丽京章倩倩
段有发 陈 坚 叶志金 王丽京 章倩倩
(广东药科大学基础学院血管生物学研究所,广东 广州 510006)
Mac-1基因缺失抑制小鼠黑色素瘤肺转移的机制
段有发 陈 坚 叶志金 王丽京 章倩倩
(广东药科大学基础学院血管生物学研究所,广东 广州 510006)
目的 探讨Mac-1基因缺失对黑色素瘤肺转移的抑制作用。方法 Mac-1基因敲除(Mac-1-/-)小鼠配种扩群以获得实验需要的数量,取指数生长期B16细胞,分别尾静脉注射到对照组C57BL/6J小鼠和实验组Mac-1-/-小鼠体内,统计小鼠生存率及肿瘤肺转移结节数,并通过H&E观察肺组织中微转移灶。结果 通过配种扩群获得了大量实验用纯合子Mac-1基因敲除小鼠(Mac-1-/-)。与对照组相比,Mac-1缺失后尾静脉注射B16细胞的小鼠存活率显著提高(P<0.001);并且大体观察Mac-1缺失后小鼠肿瘤转移肺结节数目显著减少(P<0.001),抑制率达到75%;进一步通过对肺组织包埋、切片和H&E观察发现,Mac-1缺失后小鼠肺组织中肿瘤微转移灶显著减少(P<0.001)。结论 Mac-1基因缺失能显著抑制小鼠黑色素瘤的肺转移。
Mac-1缺失;黑色素瘤;肺转移
Mac-1是整合素β2亚族的一个重要成员,是由α(CD11b)和β(CD18)两个亚基以非共价键的方式缔合而成的异二聚体。Mac-1主要表达于白细胞膜,在粒细胞和单核巨噬细胞表面广泛表达,部分淋巴细胞也有少量表达,是参与机体防御作用和免疫反应的重要的白细胞黏附分子,主要影响白细胞的迁移和组织浸润〔1,2〕。肿瘤生长微环境中有大量白细胞,越来越多的研究表明,肿瘤微环境中的白细胞能够促进肿瘤的生长和转移〔3~9〕。因此,Mac-1的缺失可能对肿瘤的生长和转移具有重要影响。目前,Mac-1缺失对黑色素瘤转移的影响尚不清楚。黑色素瘤是由异常黑色素细胞过度增生引发的恶性肿瘤,是皮肤肿瘤死亡病例中的主要类型〔10~16〕。黑色素瘤恶性程度高,易转移,侵袭性强,预后极差,容易通过血液发生肺转移〔17〕。本研究利用Mac-1基因敲除小鼠与其背景鼠C57BL/6J建立实验性黑色素瘤肺转移模型,研究Mac-1基因缺失对黑色素瘤肺转移的抑制作用。
1 材料与方法
1.1 细胞株、实验动物、主要试剂和仪器 B16小鼠黑色素瘤细胞株购于中国科学院细胞库,培养于含10%胎牛血清、100 U/ml青霉素和100 mg/L链霉素的DMEM高糖培养基中,37℃贴壁培养在5% CO2培养箱中,待细胞处于指数生长期时进行实验。Mac-1基因敲除(Mac-1-/-)小鼠12只(雌性和雄性各6只),7周龄,购于美国Jackson实验室;C57BL/6J小鼠20只,雌性和雄性随机,6~8周龄,SPF级,购于广东省医学实验动物中心。DMEM高糖培养基、0.25%胰蛋白酶、胎牛血清(Gibco公司)。独立送回风净化笼具(苏杭实验动物设备厂);离心机(Thermo,美国);CO2培养箱(Thermo,美国);正置显微镜、体视显微镜(Olympus,日本)。
1.2 Mac-1基因敲除小鼠的配种扩群 Mac-1-/-小鼠饲养于SPF级环境中,饲养室内的温度维持在(25±3)℃,相对湿度40%~60%,噪音低于60 dB,氨浓度不超过20 ppm,换气次数为10~20次/h,自动光控时间为12 h明/12 h暗,饲养室内定期用消毒水进行清洁消毒。8~12周龄Mac-1-/-小鼠以雄∶雌=1∶3的最佳比例配种,共配两笼,及时记录产仔日期和产仔数,3周龄时将仔鼠雌雄分笼饲养,对小鼠进行剪趾编号。
1.3 小鼠实验性黑色素瘤肺转移模型的建立 分别取C57BL/6J小鼠21只和Mac-1-/-小鼠22只,周龄相同,雌性和雄性随机。取对数生长期B16细胞,0.25%胰蛋白酶消化后,用生理盐水配制成5×108/L的细胞混悬液。用台盼蓝染色确定活细胞数在95%以上,通过尾静脉注射B16细胞混悬液0.2 ml/只。
1.4 肿瘤肺转移结节的测定 给小鼠尾静脉注射B16细胞后,每组取8只小鼠,在第18天时将小鼠脱颈椎处死,取肺组织,观察大体形态并拍照,体视显微镜下计数肿瘤肺转移结节数。
1.5 小鼠生存率统计 每天观察统计肿瘤肺转移实验后剩余小鼠的生长生活情况,记录每只小鼠的自然死亡时间,并统计小鼠生存率。
1.6 H&E染色 取注射B16细胞后18 d处死的小鼠肺组织,固定、脱水后石蜡包埋,切片(3 μm),脱蜡后苏木精伊红染色,镜下观察组织形态。
1.7 统计学分析 采用SigmaPlot统计软件绘制统计图及进行t检验。
2 结 果
2.1 Mac-1-/-小鼠繁育结果 Mac-1-/-小鼠按照雄∶雌=1∶3的最佳比例配种,配种两笼,扩大种群,平均每只母鼠的窝产仔数为7.5只,共产仔45只。
2.2 Mac-1缺失对B16肺转移小鼠生存率的影响 注射B16细胞后C57BL/6J小鼠与Mac-1-/-小鼠在23 w开始出现死亡。C57BL/6J小鼠在32 w时死亡率达到80%左右,在第40周时死亡率达100%;而Mac-1-/-小鼠则在45 w时死亡率才达到80%,50 w时死亡率达100%(见图1)。与对照组C57BL/6J小鼠相比,实验组Mac-1-/-基因敲除小鼠生存时间显著延长,差异有统计学意义(P<0.001)。
2.3 Mac-1缺失对黑色素瘤肺转移的影响 在注射B16细胞后第18天处死实验组Mac-1-/-小鼠和对照组C57BL/6J小鼠,解剖后取肺组织,大体观察发现Mac-1-/-小鼠黑色素瘤肺转移结节显著少于对照组C57BL/6J小鼠(图2);计数后发现Mac-1-/-小鼠黑色素瘤肺转移结节(11.43±2.24)显著少于对照组C57BL/6J小鼠(54.86±13.50)(P<0.001)。
H&E染色,镜下可清楚观察到肺组织有癌细胞浸润,并且Mac-1-/-小鼠黑色素瘤肺组织中微转移灶显著小于对照组,并且数目显著减少。见图3。
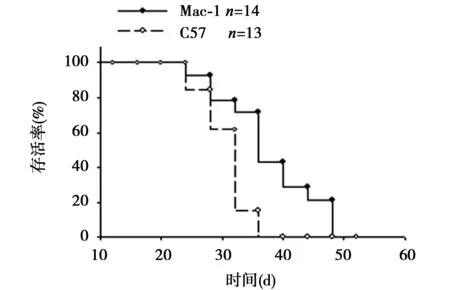
图1 注射B16细胞后Mac-1-/-小鼠和 C57BL/6J小鼠生存率观察

图2 注射B16细胞后Mac-1-/-小鼠和 C57BL/6J小鼠转移肺结节观察
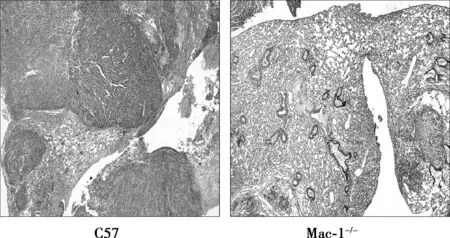
图3 注射B16细胞后Mac-1-/-小鼠和 C57BL/6J小鼠肺组织H&E染色
3 讨 论
Mac-1主要在粒细胞和单核巨噬细胞的细胞膜上表达,少量表达于部分淋巴细胞〔1〕。Mac-1属于白细胞表面的重要黏附分子,可与活化的血管内皮细胞表面上的ICAM-1、ICAM-2等配体高亲和力结合,促使白细胞与血管内皮细胞牢固黏附,从而介导白细胞的游走和渗出〔18,19〕。
肿瘤组织中存在大量白细胞,在肿瘤细胞的生长和转移中发挥着重要作用〔9〕。巨噬细胞能够分泌血管内皮生长因子,促进肿瘤血管的生成,从而促进肿瘤的生长〔3〕。Wang等〔4〕研究发现,巨噬细胞能够分泌MMP7,从而促进肿瘤细胞的侵袭和转移。有临床研究表明,在肿瘤组织中,浸润性巨噬细胞的数量越多,则肿瘤血管微密度(MVD)和增殖指数(PI)越高,肿瘤细胞的生长越旺盛,肿瘤的预后越差〔5,20〕。在肿瘤微环境中,肿瘤相关巨噬细胞能够分泌血管生成因子,从而促进肿瘤血管的生成,进而为肿瘤的生长和转移提供了营养和通道。另外,肿瘤相关巨噬细胞可以通过抑制机体内抗肿瘤免疫应答来促使肿瘤细胞逃逸免疫杀伤,最终促进肿瘤发展〔21,22〕。Nozawa等〔6〕在胰腺瘤模型RIP1-Tag2小鼠中研究发现,在肿瘤血管的形成中,浸润性中性粒细胞发挥着“起始开关”的作用。另外的研究者也报道了多种肿瘤组织血管的形成与中性粒细胞密切相关〔7〕。在黑色素瘤中,巨噬细胞可以通过产生有丝分裂原、生长因子、酶等促进肿瘤血管的生成,进而促进黑色素瘤细胞的生长和转移〔23〕。Shi等〔24〕在临床黑色素瘤组织中发现,黑色素瘤的恶性程度与浸润性巨噬细胞的数量指数和血管分级程度呈正相关。因此,在肿瘤生长的微环境中,白细胞能够分泌各种促血管生成的相关因子或直接参与血管形成,进而促进肿瘤血管的生成,最终促进肿瘤生长〔8〕;或者分泌金属蛋白酶介质,从而促进肿瘤的侵袭和转移〔9〕。
基因敲除动物是目前肿瘤功能基因研究中最理想的动物模型。运用基因打靶技术,将无功能的外源基因片段neo转入细胞,与基因组中的同源序列Mac-1进行同源重组,从而把功能性的同源序列置换出来,造成Mac-1功能的完全缺失,最终得到Mac-1基因敲除小鼠〔25〕。Zhang等〔26〕研究报道,Mac-1缺失通过减少骨髓来源白细胞的募集抑制肠道肿瘤的生长。Ahn等〔27〕研究发现,特异性抗Mac-1的单克隆抗体可以抑制放疗后的肿瘤生长而不会出现反跳现象。抑制Mac-1可以降低募集浸润入肿瘤组织内的髓系白细胞数目,进而导致肿瘤血管生成障碍,血供营养不足,使肿瘤生长受到抑制。肿瘤细胞能够分泌各种趋化因子,白细胞在趋化因子的趋化作用下从血管外渗,被募集浸润入肿瘤组织内,进而为肿瘤生长和转移提供帮助〔7〕。
综上所述,Mac-1在肿瘤的生长和转移中发挥着正向调控作用,Mac-1基因的缺失能够抑制黑色素瘤的肺转移。Mac-1基因缺失抑制黑色素瘤肺转移可能是因为抑制了白细胞与血管内皮细胞的黏附功能,进而影响了白细胞的迁移和组织浸润能力,但其作用机制还不明确,需要进一步探讨。
1 Lefort CT,Hyun YM,Schultz JB,etal.Outside-in signal transmission by conformational changes in integrin Mac-1〔J〕.J Immunol,2009;183(10):6460-8.
2 Li N,Mao D,Lü S,etal.Distinct binding affinities of Mac-1 and LFA-1 in neutrophil activation〔J〕.J Immunol,2013;190(8):4371-81.
3 Tsutsui S,Yasuda K,Suzuki K,etal.Macrophage infiltration and its prognostic implications in breast cancer:the relationship with VEGF expression and microvessel density〔J〕.Oncol Rep,2005;14(2):425-31.
4 Wang FQ,So J,Reierstad S,etal.Matrilysin(MMP-7) promotes invasion of ovarian cancer cells by activation of progelatinase〔J〕.Int J Cancer,2005;114(1):19-31.
5 Hamada I,Kato M,Yamasaki T,etal.Clinical effects of tumor-associated macrophages and dendritic cells on renal cell carcinoma〔J〕.Anticancer Res,2002;22(6C):4281-4.
6 Nozawa H,Chiu C,Hanahan D.Infiltrating neutrophils mediate the initial angiogenic switch in a mouse model of multistage carcinogenesis〔J〕.Proc Natl Acad Sci U S A,2006;103(33):12493-8.
7 Tazzyman S,Lewis CE,Murdoch C.Neutrophils:key mediators of tumour angiogenesis〔J〕.Int J Exp Pathol,2009;90(3):222-31.
8 Murdoch C,Muthana M,Coffelt SB,etal.The role of myeloid cells in the promotion of tumour angiogenesis〔J〕.Nat Rev Cancer,2008;8(8):618-31.
9 Joyce JA,Pollard JW.Microenvironmental regulation of metastasis〔J〕.Nat Rev Cancer,2009;9(4):239-52.
10 覃冠平.黑色素瘤36例临床病理分析〔J〕.吉林医学,2011;32(21):4431.
11 李 海,郑晓娟.恶性黑色素瘤21例临床病理分析〔J〕.现代中西医结合杂志,2012;21(3):272-3.
12 Ravdel L,Robinson WA,Lewis K,etal.Metastatic melanoma in the breast:a report of 27 cases〔J〕.J Surg Oncol,2006;94(2):101-4.
13 纪小龙,徐 薪,申明识.黏膜黑色素瘤的常见临床病理特点〔J〕.诊断病理学杂志,2002;9(2):108-10.
14 全国肿瘤防治研究办公室,全国肿瘤登记中心,卫生部疾病预防控制局.中国肿瘤登记年报2010〔M〕.北京:军事医学科学出版社,2011:80-1.
15 李 真,宋 鑫.黑色素瘤临床研究进展〔J〕.实用肿瘤杂志,2014;29(1):1-6.
16 Gray-Schopfer V,Wellbrock C,Marais R.Melanoma biology and new targeted therapy〔J〕.Nature,2007;445(7130):851-7.
17 Garbea C,Eigentlera TK,Keilholz U,etal.Systematic review of medical treatment in melanoma:current status and future prospects〔J〕.Oncologist,2011;16(1):5-24.
18 Geng JG,Chen M,Chou KC.P-selectin cell adhesion molecule in inflammation,thrombosis,cancer growth and metastasis〔J〕.Curr Med Chem,2004;11(16):2153-60.
19 Languino LR,Duperray A,Joganic KJ,etal.Regulation of leukocyte-endothelium interaction and leukocyte transendothelial migration by intercellular adhesion molecule 1-fibrinogen recognition〔J〕.Proc Natl Acad Sci U S A,1995;92(5):1505-9.
20 Coussens LM,Werb Z.Inflammatory cells and cancer:think different〔J〕.J Exp Med,2001;193(6):23-6.
21 Obeid E,Nanda R,Fu YX,etal.The role of tumor-associated macrophages in breast cancer progression〔J〕.Int J Oncol,2013;43(1):5-12.
22 陈厚娣,夏先如,杜金凤.ManLAM对免疫细胞的抑制作用〔J〕.安徽医药,2013;17(11):1968-70.
23 Torisu-Itakura H,Lee JH,Huynh Y,etal.Monocyte-derived IL-10 expression predicts prognosis of stage Ⅳ melanoma patients〔J〕.J Immunother,2007;30(8):831-8.
24 Shi L,Lei D,Ma C,etal.Clinicopathological implications of tumour-associated macrophages and vascularization in sinonasal melanoma〔J〕.J Int Med Res,2010;38(4):1276-86.
25 van Spriel AB,van Ojik HH,Bakker A,etal.Mac-1(CD11b/CD18) is crucial for effective Fc receptor-mediated immunity to melanoma〔J〕.Blood,2003;101(1):253-8.
26 Zhang QQ,Hu XW,Liu YL,etal.CD11b deficiency suppresses intestinal tumor growth by reducing myeloid cell recruitment〔J〕.Sci Rep,2015;5:15948.
27 Ahn GO,Tseng D,Liao CH,etal.Inhibition of Mac-1(CD11b/CD18) enhances tumor response to radiation by reducing myeloid cell recruitment〔J〕.Proc Natl Acad Sci USA,2010;107(18):8363-8.
〔2016-11-14修回〕
(编辑 曲 莉)
Inhibitory effect of the gene deletion of Mac-1 on the lung metastasis of mouse melanoma
DUAN You-Fa, CHEN Jian, YE Zhi-Jin,etal.
Vascular Biology Research Institute, School of Basic Courses, Guangzhou Pharmaceutical University, Guangzhou 510006, Guangdong, China
Objective To study the inhibitory effect of the gene deletion of Mac-1 on the lung metastasis of melanoma.Methods Mac-1 knockout mice were mated in order to obtain the number of need. Mice melanoma cells B16 were respectively injected into the caudal vein of the control group C57BL/6J mice and the experimental group Mac-1 knockout mice. The melanoma lung metastasis nodules were examined, survival rate of mice was counted, and micro metastases in lung tissue were observed by H&E.Results A large number of experiments with homozygous Mac-1 knockout mice (Mac-1-/-) were obtained by breeding expansion group. Compared with that of control group, the survival rate of Mac-1 knockout mice with intravenous B16 cells was significantly increased, and the lung nodule number was significantly reduced(P<0.001), and inhibition rate reached 75%, further through the lung tissue embedding, sectioning and H&E observation, tumor metastases of Mac-1 knockout mice was significantly reduced in the lung tissue.Conclusions The gene deletion of Mac-1 could significantly inhibite the lung metastasis of mouse melanoma.
Deletion of Mac-1; Melanoma; Lung metastasis
国家自然科学基金(No.31471290);广东省科技计划(No.2015A030302083);广州市珠江科技新星(No.201610010045);广东省高等学校优秀青年教师培养计划(No.YQ2015100)
章倩倩(1981-),女,副研究员,博士,主要从事肿瘤药理、模式动物疾病模型研究。
段有发(1990-),男,在读硕士,主要从事肿瘤药理、模式动物疾病模型研究。
R739.5
A
1005-9202(2017)09-2100-04;
10.3969/j.issn.1005-9202.2017.09.008
