红景天苷对人心肌细胞缺氧损伤的保护作用及可能机制
2017-05-25张俊彪郭军霞
张俊彪,郭军霞
(新乡医学院第一附属医院心内科,河南新乡453100)
红景天苷对人心肌细胞缺氧损伤的保护作用及可能机制
张俊彪,郭军霞
(新乡医学院第一附属医院心内科,河南新乡453100)
目的观察人心肌细胞(HCM)在不同浓度红景天苷的刺激下其乳酸脱氢酶(LDH)、脱酸激酶(CK)、谷草转氨酶(AST)和超氧化物歧化酶(SOD)的释放量,以及心肌细胞活性的变化。分析红景天苷对人心肌细胞的作用,并探讨其可能的分子机制。方法体外模拟缺氧环境对人心肌细胞造成损伤,测定不同浓度红景天苷作用下人心肌细胞LDH、CK、AST以及SOD释放量,并采用活细胞计数法试剂盒(cck-8)检测不同处理组细胞活性,赫克斯特-碘化丙啶(Hoechst-PI)双染观察细胞凋亡情况,免疫荧光染色检测低氧诱导因子(HIF-1α)表达。结果与缺氧对照组比较,1×10-4、10-5及10-6mol/L红景天苷处理组LDH、CK和AST释放量均降低,呈剂量依赖性(P<0.01)。与缺氧对照组比较,红景天苷处理组(1×10-4、10-5及10-6mol/L)细胞上清SOD含量增加,呈剂量依赖性(P<0.01)。与缺氧对照组比较,红景天苷处理组(1×10-4、10-5及10-6mol/L)人心肌细胞随着红景天苷的剂量增大,细胞活性逐渐升高。与缺氧对照组比较,红景天苷处理组(1×10-4、10-5及10-6mol/L)人心肌细胞随着红景天苷的剂量增大,死亡以及凋亡细胞呈现明显减少趋势。缺氧可激活HIF-1α的表达。结论红景天苷能抑制人心肌细胞LDH、CK和AST的释放,增加SOD的含量,同时可提高人心肌细胞的活性并减少其凋亡,对其有保护作用,其分子机制可能与诱导HIF-1α的表达有关。
红景天苷;人心肌细胞;缺氧;细胞活性;低氧诱导因子α
心血管疾病严重威胁着人类的健康。慢性心力衰竭近年来发病率逐年增加,其中冠状动脉粥样硬化性心脏病(冠心病)是其最主要的病因。冠心病的生理机制为冠状动脉急性狭窄使其供应区域的心肌细胞在短期内发生缺血、缺氧以及再灌注损伤,从而导致心肌细胞凋亡。红景天苷是藏药红景天的主要成分,经药效学证实红景天具有明显的抗心肌缺氧、缺血的作用。在急性心肌缺血早期,心肌细胞死亡的主要方式为细胞凋亡[1]。低氧诱导因子(hypoxia-inducible factor 1-alpha,HIF-1α)是低氧诱导的一个特异性转录活化因子。HIF-1可能通过影响凋亡调节蛋白的表达来诱导细胞凋亡。本研究拟通过在细胞水平分析在不同浓度红景天苷的作用下,人心肌细胞乳酸脱氢酶(lactate dehydrogenase,LDH),肌酸激酶(creatine kinase,CK)、谷草转氨酶(aspartate transaminase,AST)以及超氧化物歧化酶(superoxide dismutase,SOD)的释放量以及细胞活性的改变,并观察在红景天苷有效浓度作用下人心肌细胞凋亡情况以及HIF-1表达的情况,进一步探讨红景天苷在心肌细胞的作用机制,为临床应用提供实验支持。
1 材料与方法
1.1 材料
1.1.1 细胞株人心肌细胞株(human cardiac myocytes,HCM)购买于通派(上海)生物有限公司。
1.1.2 主要试剂红景天苷(大连美仑生物技术有限公司),LDH、CK、AST测试盒(南京建成生物工程研究所),SOD检测试剂盒(上海碧云天生物技术有限公司),活细胞计数法试剂盒(cell counting kit-8,CCK-8)(日本同仁化学研究所),胎牛血清(fatal bovine serun,FBS)(美国Gibco公司),达尔伯克必须基本培养基(H-dulbecco's modified eagle medium,H-DMEM)培养基(美国Hyclone公司),Hoechst33342染料(上海碧云天生物技术有限公司),蛋白酶抑制剂(protease inhibitor,PI)染料(上海碧云天生物技术有限公司,HIF-1α抗体(美国BI公司),异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记二抗(上海碧云天生物技术有限公司),磷酸盐缓冲液(phosphate buffered saline,PBS)(美国Hyclone公司),DMSO(上海碧云天生物技术有限公司),胰蛋白酶(上海碧云天生物技术有限公司)。
1.2 实验方法
1.2.1 细胞培养人心肌细胞株(HCM)生长于含10%FBS的H-DMEM培养基中,置于37℃、5%二氧化碳CO2培养箱内常规培养,当生长密度达到90%时开始进行细胞传代。
1.2.2 心肌细胞缺氧模型的建立心肌细胞生长接近至融合状态时,选用Koyama T等人的方法模拟人体内缺氧环境,配制缺氧液(mmol/L):NaH2PO30.9、NaHCO36.0、MgSO41.2、CaCl21.0、乳酸钠40、HEPES 20、KCl 10.0、NaCl 98.5,pH值6.8,37℃。用缺氧液置换正常培养液,在高浓度饱和氮气(>95%,1 L/min)下作用30min,测血气PO2≤4.0 kPa。三气培养箱(950 ml/L N2,50 ml/L CO2)中密闭孵育处理6 h,造成心肌细胞缺氧损伤,建立心肌细胞缺氧模型[2]。
1.2.3 实验分组将培养的心肌细胞随机分为6组:①正常对照组:用正常培养液培养细胞,不加药物处理;②缺氧对照组:参照上述方法,建立缺氧模型,不加药物处理;③取生长对数期细胞状态良好时加入浓度为1×10-4mol/L的红景天苷预处理细胞,然后参照缺氧方法处理细胞;④取生长对数期细胞状态良好时加入浓度为10-5mol/L的红景天苷预处理细胞,然后参照缺氧方法处理细胞;⑤取生长对数期细胞状态良好时加入浓度为1×10-6mol/L的红景天苷预处理细胞,然后参照缺氧方法处理细胞;⑥阳性药物对照组:缺氧+1×10-7mol/L胰岛素初始剂量(initial(dose)insulin,INS)预处理组,处理方法参照③~⑤组。
1.2.4 细胞培养上清液中LDH、CK和AST的活性测定按上述方法处理后的各组细胞取100μl细胞培养上清液,参照LDH、CK和AST试剂盒说明书进行操作,于生化分析仪上检测LDH,CK和AST的活性。
1.2.5 细胞培养上清液中SOD的活性测定按上述方法处理后的各组细胞取100μl细胞培养上清液,参照SOD检测试剂盒说明书的方法于核酸蛋白分析仪上测定550 nm处测光吸收度值,对各组细胞SOD的含量进行测定。
1.2.6 细胞活性检测取生长对数期细胞状态良好时加入浓度分别为1×10-4、10-5及10-6mol/L的红景天苷做预处理,然后参照缺氧方法处理细胞,每组设置5个复孔,每孔5×103个细胞接种于96孔板中,置于37℃,含5%CO2饱和湿度的敷箱中继续孵育24 h过夜。生长融合至90%时取出96孔板,按每孔10 μl加入CCK-8试剂,于敷箱中放置3 h后酶标仪450 nm波长下分别检测各组细胞的吸光度值(optical density,OD),吸光度值既可以反映各处理组的细胞活性,又可以反映活细胞数量。
1.2.7 Hoechst-PI双染检测人心肌细胞凋亡取各组处于生长对数期生长状态良好的细胞弃去原培养液,PBS清洗3次,分别加入5 mg/L Hoechst33342以及5 mg/L PI染料试剂,严格按照说明书操作,室温下避光孵育10 min,于荧光显微镜下观察细胞凋亡的情况。
1.2.8 免疫荧光检测红景天苷对HIF-1α的影响将处于生长对数期的人心肌细胞接种于12孔板,4%多聚甲醛固定并做透化处理,PBS清洗3次后,用10%羊血清封闭,随后加入HIF-1α兔多克隆抗体,于4℃环境过夜孵育。再次PBS清洗3次,羊抗兔FITC标记的荧光二抗孵育30 min后置于光显微镜下观察细胞并拍摄图像保存。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,多组数据间比较用单因素方差分析,组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养上清液中LD H、C K和AST活性
各组细胞培养上清液中的LDH、CK和AST的活力(见表1)。与正常对照组比较,缺氧对照组心肌细胞上清中LDH,CK和AST释放量均升高,差异有统计学意义(P<0.01)。与缺氧对照组1×10-4、10-5及10-6mol/L红景天苷处理组LDH,CK和AST释放量均降低,差异具有统计学意义(P<0.01)。其降低LDH、CK和AST释放量的作用呈剂量依赖性,随着红景天苷作用浓度的增高,心肌细胞释放的LDH、CK和AST逐渐减少,红景天苷10-4mol/L处理组与胰岛素处理组比较差异无统计学意义(P>0.05),说明红景天苷对细胞有保护作用。
表1 红景天苷对缺氧心肌细胞培养上清液LD H、C K和AST释放量的影响(u/dl±s)

表1 红景天苷对缺氧心肌细胞培养上清液LD H、C K和AST释放量的影响(u/dl±s)
注:1)与正常对照组比较,P<0.05;2)与缺氧对照组比较,P<0.05
A S T含量正常对照组2 9 8 . 4 2 ± 2 3 . 5 6 2 0 . 7 1 ± 4 5 . 3 2 3 0 1 ± 4 5 . 2 6缺氧对照组8 9 4 . 9 8 ± 5 6 . 3 91)2 8 6 7 . 6 7 ± 7 8 . 5 71)7 0 5 . 5 8 ± 4 3 . 8 51)组别L D H含量C K含量缺氧+红景天苷1 0-6m o l / L 3 9 7 ± 6 5 . 2 62)1 4 4 5 . 8 7 ± 5 7 . 5 42)6 3 7 . 3 2 ± 3 4 . 6 32)缺氧+红景天苷1 0-5m o l / L 3 6 4 ± 3 5 . 3 52)1 0 7 5 . 7 6 ± 7 5 . 4 32)5 5 8 . 2 3 ± 3 5 . 3 52)缺氧+红景天苷1 0-4m o l / L 3 4 5 ± 1 2 . 5 62)7 8 9 . 4 6 ± 4 6 . 4 22)5 0 1 . 6 4 ± 2 7 . 8 52)缺氧+ 1 × 1 0-7m o l / L胰岛素3 1 2 . 3 2 ± 2 8 . 3 82)1 2 9 . 3 8 ± 3 9 . 2 22)3 7 8 . 5 7 ± 3 9 . 4 82)
2.2 细胞培养上清液中SO D活性
与正常对照组SOD含量(17.83±0.45)u/L比较,缺氧对照组细胞上清SOD含量(9.04±0.28)u/L降低(P<0.01)。与缺氧对照组比较,红景天苷处理组(1×10-4、10-5及10-6mol/L)细胞上清液SOD含量显著增加,其增加SOD含量的作用呈剂量依赖性。随着红景天苷作用浓度的增高,心肌细胞SOD含量逐渐升高(P<0.01),红景天苷10-4mol/L处理组与胰岛素处理组比较差异无统计学意义(P>0.05),说明红景天苷对细胞有保护作用。见图1。

图1 红景天苷对缺氧心肌细胞培养上清液SO D含量的影响
2.3 细胞活性
与正常对照组比较,缺氧对照组心肌细胞活性降低,差异有统计学意义(P<0.05)。与缺氧对照组比较,红景天苷处理组(10-4、10-5及10-6mol/L)人心肌细胞活性随着红景天苷的剂量增大,抑制率逐渐减小,细胞活性逐渐升高,差异有统计学意义(P<0.01),红景天苷10-4mol/L处理组与胰岛素处理组比较差异无统计学意义(P>0.05),说明红景天苷对人心肌细胞有提高细胞活性的作用。见表2。
表2 红景天苷对心肌细胞活性的影响(n=6±s)
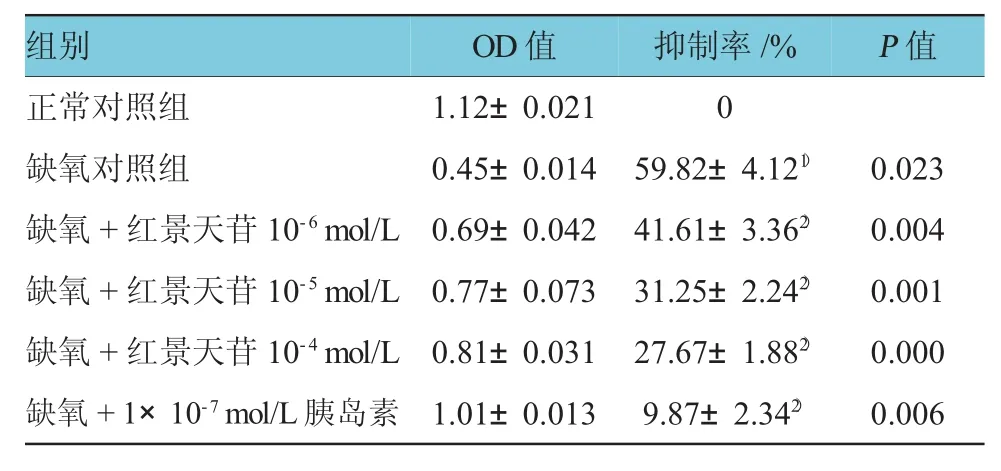
表2 红景天苷对心肌细胞活性的影响(n=6±s)
注:1)与正常对照组比较,P<0.05;2)与缺氧对照组比较,P<0.05
组别O D值抑制率/ %P值正常对照组1 . 1 2 ± 0 . 0 2 1 0缺氧对照组0 . 4 5 ± 0 . 0 1 4 5 9 . 8 2 ± 4 . 1 21)0 . 0 2 3缺氧+红景天苷1 0-6m o l / L 0 . 6 9 ± 0 . 0 4 2 4 1 . 6 1 ± 3 . 3 62)0 . 0 0 4缺氧+红景天苷1 0-5m o l / L 0 . 7 7 ± 0 . 0 7 3 3 1 . 2 5 ± 2 . 2 42)0 . 0 0 1缺氧+红景天苷1 0-4m o l / L 0 . 8 1 ± 0 . 0 3 1 2 7 . 6 7 ± 1 . 8 82)0 . 0 0 0缺氧+ 1 × 1 0-7m o l / L胰岛素1 . 0 1 ± 0 . 0 1 3 9 . 8 7 ± 2 . 3 42)0 . 0 0 6
2.4 红景天苷对缺氧损伤心肌细胞凋亡及死亡的影响
Hoechst-PI双染检测结果(见图2),正常对照组的细胞胞浆饱满,呈椭圆形或梭形,不同浓度红景天苷处理组以及胰岛素处理组的心肌细胞形态变化明显小于缺氧对照组,生长较好,核区染色均匀;缺氧对照组细胞核区体积变小,皱缩明显,出现较多死细胞,PI染色后出现强红色荧光;红景天苷给药组随着药物浓度的逐渐升高,死亡以及凋亡细胞呈现减少趋势。


图2 红景天苷对缺氧损伤的人心肌细胞凋亡及死亡的影响(Hoechst-PI双染×200)
2.5 红景天苷对心肌细胞H I F-1α表达的影响
缺氧可诱导HIF-1α的表达,使细胞适应缺氧环境,正常情况下HIF-1α较少表达,表达主要集中在细胞胞浆中,红景天苷10-4mol/L处理后可增加细胞中HIF-1α的表达(见图3)。
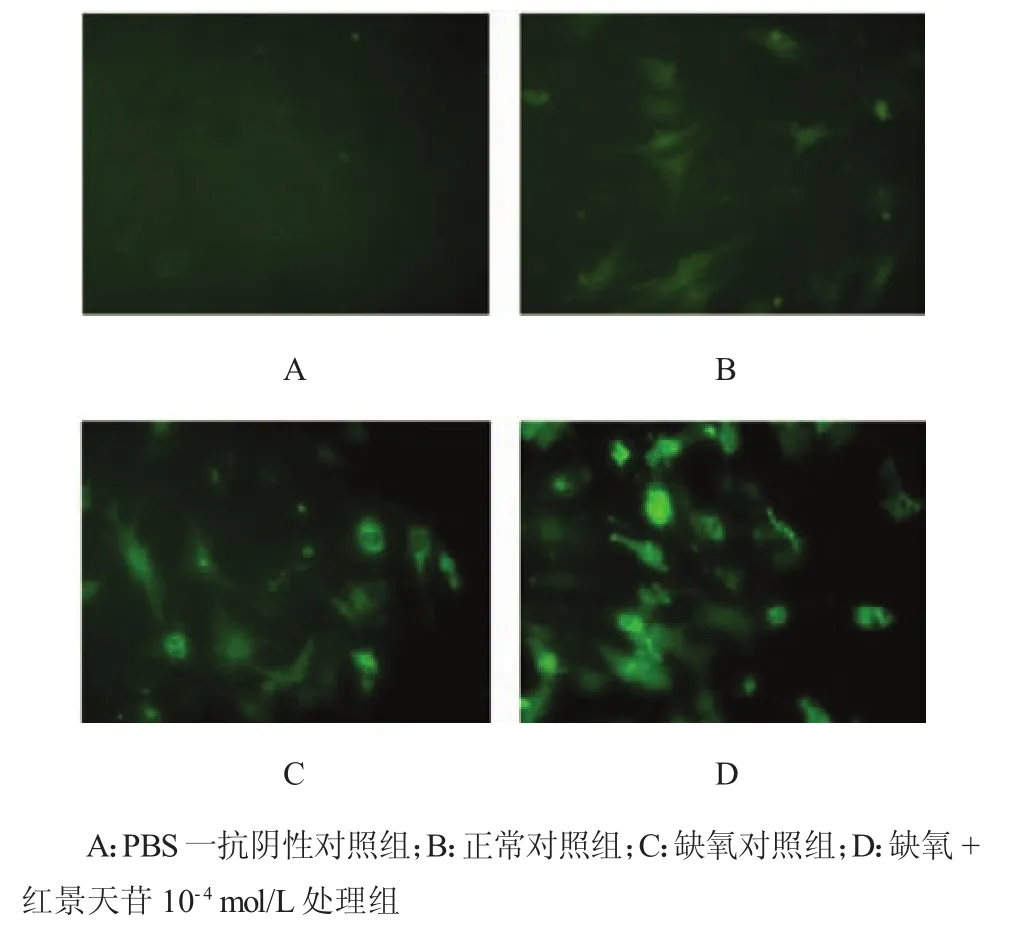
图3 红景天苷对H I F-1α的影响(免疫荧光×200)
3 讨论
红景天系蔷薇目景天科红景天属,是多年生草本或亚灌木野生植物,一般成片密集生长于高海拔地带。红景天苷具有抗缺氧、抗疲劳、抗寒冷、清除氧自由基、免疫调节及保护心血管等诸多药理作用[3]。张中平等[4]人采用冠状动脉结扎法制备大鼠急性心肌缺血模型,发现红景天苷可降低缺血-再灌注损伤的大鼠心电图ST段的变化幅度,并减小大鼠急性心肌梗死的面积,进而减轻心肌缺血-再灌注的损伤。红景天对由过氧化氢诱导的子鼠心肌细胞凋亡有抑制作用,其作用机制可能与其抗脂质氧化有关[5]。临床研究发现,红景天苷可保护冠心病伴糖尿病患者的心肌功能,改善患者的肾功能[6]。此外,红景天还有能够抑制肿瘤的发生的作用,如人肝癌HepG2细胞[7]及腹水型H22肝癌[8]。
NATARAJAN R等人实验得出,心肌细胞在缺氧状态下,可通过上调HIF-1信使核糖核酸(messenger ribonucleic acid,mRNA)的表达,启动对下游靶基因的调控。从而使下游血管内皮生长因子(vascular endothelial growth factor,VEGF)、血红素加氧酶、一氧化氮合酶以促红细胞生成素等靶基因表达活性的增加[9]。红景天苷还具有促进正常生长的内皮细胞发生增殖,类似VEGF样作用[10],内皮细胞的增殖有利于血管的发生和重建从而建立侧支循环,对心室重塑以及改善心肌梗死的预后有促进作用。最近研究发现,红景天苷体外灌流可使(sprague dawley,SD)大鼠心肌细胞膜钠通道电流(INa)的I-V曲线下移,增加电流幅值,该作用可能与红景天苷增加钠通道失活电位、抑制电流失活有关[11]。心力衰竭以及心肌梗死后心室重塑发生、发展中的重要病理生理机制之一是细胞凋亡,红景天苷通过抑制这一机制,可起到保护心肌细胞的作用。
正常情况下,心肌细胞胞质中含有大量的LDH、CK和AST,属于胞浆酶。而培养液中含量较低,细胞损伤后,大量LDH、CK和AST被释放到上清液中使血清酶活性升高。因此本研究通过测定LDH含量的变化可以反映细胞的损伤程度。研究结果表明,随着红景天苷作用浓度的增高,心肌细胞释放的LDH、CK和AST逐渐减少,说明红景天苷对心肌细胞有保护作用。
缺氧可以使心肌细胞能量代谢发生紊乱而导致氧自由基生成增多,氧自由基通过细胞膜脂质过氧化又可导致细胞损伤,从而引起细胞凋亡。SOD可避免超氧离子的损伤。故本实验选用SOD作为检测的指标之一。本实验结果表明,与对照组比较,红景天苷处理组(1×10-4、10-5及10-6mol/L)细胞上清液SOD含量显著增加,其增加SOD含量的作用呈剂量依赖性。说明红景天苷可提高过氧化物酶活性从而达到抗氧化的作用,从而保护心肌细胞。
CCK-8检测细胞活性的原理为试剂中的2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐(WST-8)在电子载体1-Methoxy PMS存在的情况下能够被还原成水溶性的甲臜染料,生成甲瓒物的数量与活细胞的数量成正比。本研究与缺氧对照组比较,红景天苷处理组(1× 10-4、10-5及10-6mol/L)人心肌细胞活性随着红景天苷的剂量增大,细胞活性逐渐升高,差异有统计学意义,说明红景天苷可提高人心肌细胞的活性及存活率,对心肌细胞有一定的保护作用。
在Hoechst-PI双染检测人心肌细胞凋亡的实验中,正常对照组的细胞胞浆饱满,呈椭圆形或梭形,不同浓度红景天苷处理组以及胰岛素处理组的心肌细胞形态变化明显小于缺氧对照组,生长较好,核区染色均匀;缺氧对照组细胞核区体积变小,皱缩明显,出现较多死细胞,PI染色后出现强红色荧光;红景天苷给药组随着药物浓度的逐渐升高,死亡以及凋亡细胞呈现明显减少趋势,说明红景天苷具有减少人心肌细胞凋亡的作用。
HIF-1作为低氧诱导特异的一个特异性转录活化因子可调节多种基因如酪氨酸脱氢酶、促红细胞生成素(erythropoietin,EPO)以及VEGF等在低氧环境下的表达,并可影响低氧时血管形成、血红蛋白合成和多种代谢过程及生理过程,在细胞对低氧反应的信号传递中,具有重要的生物功能[12]。本研究发现,缺氧可诱导HIF-1α的表达,使细胞适应缺氧环境,正常情况下,HIF-1α较少表达,表达主要集中在细胞胞浆中,红景天苷10-4mol/L处理后可明显增加细胞中HIF-1α的表达。
本研究在细胞水平分析人心肌细胞在红景天苷作用下发生的变化,得到结论红景天苷能抑制人心肌细胞LDH、CK和AST的释放,增加SOD的含量,同时可提高人心肌细胞的活性,减少死亡及凋亡的细胞,对其有保护作用,其分子机制可能与诱导HIF-1α的表达有关。进一步阐明红景天苷对心肌细胞可能的作用机制,为临床应用提供实验基础。
[1]HUSAIN-SYED F,MCCULLOUGH PA,BIRK HW,et al.Cardiopulmonary-renal interactions:A multidisciplinary approach[J].Journal of the American College of Cardiology,2015,65(22):2433-2448.
[2]DOMEIER T L,ROBERTS C J,GIBSON A K,et al.Dantrolene suppressesspontaneousCa2+releasewithoutalteringexcitation-contraction coupling in cardiomyocytes of aged mice[J].Ajp Heart&Circulatory Physiology,2014,307(6):H818-29.
[3]张雨舟.红景天药理作用研究进展及应用前景分析[J].安徽农业科学,2015,43(25):77-82.
[4]刘馨骏,宫剑滨,潘涛.红景天苷对大鼠缺血再灌注损伤心肌Akt/GSK-3β作用的研究[J].医学研究生学报,2015,28(2):146-148.
[5]占海思,潘涛.红景天在心肌缺血再灌注损伤中保护机制的研究进展[J].中国实验方剂学杂志,2016,22(8):231-234.
[6]杨枫.红景天苷对冠心病伴糖尿病患者心肾功能的影响[J].中国社区医师,2016,32(13):126-127.
[7]庞晓斌,谢欣梅,赵清辉,等.红景天苷对人肝癌HepG2细胞增殖及凋亡的影响[J].中国药学杂志,2014,49(3):195-198.
[8]何小喜,莫书荣.红景天苷对腹水型H22肝癌抑制作用及其机制的初步研究[J].中国药理学通报,2014,30(5):688-691.
[9]ZHANG X L,YAN Z W,SHENG W W,et al.Activation of hypoxia-inducible factor-1 ameliorates postischemic renal injury via inducible nitric oxide synthase[J].Molecular&Cellular Biochemistry,2011,358(1/2):287-295.
[10]RIVERA D S,INESTROSA N C,BOZINOVIC F.On cognitive ecology and the environmental factors that promote Alzheimer disease:lessons from Octodon degus,(Rodentia:Octodontidae)[J]. Biological Research,2016,49(1):1-10.
[11]黄媛恒,谢剑,黄创明,等.红景天苷体外灌流对大鼠心肌细胞膜钠通道电流的影响[J].山东医药,2016,56(7):31-33.
[12]PRABHAKAR N R,SEMENZA G L.Adaptive and maladaptive cardiorespiratory responses to continuous and intermittent hypoxia mediated by hypoxia-inducible factors 1 and 2[J].Physiol Rev,2012,92(3):967-1003.
Protective effect of salidroside on human myocardial cells during hypoxia injury and possible mechanism
Jun-biao Zhang,Jun-xia Guo
(Department of Cardiology,the First Affiliated Hospital of Xinxiang Medical College, Xinxiang,Henan 453100,China)
ObjectiveTo investigate the effect of different concentrations of salidroside on LDH,CK,AST and SOD release quantity in supernatant of human myocardial cells,and the changes of human myocardial cells activity,and To find the effect of salidroside on human myocardial cells and discuss the possible molecular mechanisms.MethodsThe hypoxic model in vitro was established and the LDH,CK,AST and SOD release quantity in supernatant of human myocardial cells dealt with different concentrations of salidroside were measured.Cell activity of different treatment groups was analyzed by CCK-8 assay.Apoptotic changes in HCM cells were observed by using Hoechst-PI staining.The expression of HIF-1α was determined by immunofluorescence.ResultsCompared with the hypoxia control group,the concentration of LDH, CK,and AST was significantly decreased and SOD was significantly increased with the dose-dependent dealt by different concentrations of salidroside(1×10-4,10-5and 10-6mol/L).Salidroside significantly increased the activity of human myocardial cells with the dose-dependent.Compared with the hypoxia control group,human myocardial cell death and apoptotic of salidroside treatmentgroups(1×10-4,10-5and 10-6mol/L)showed significant decreased trend.Hypoxia activated the HIF-1α expression.ConclusionsSalidroside could significantlyinhibit the release of LDH,CK and AST,and increase SOD content in human myocardial cells.At the same time,it can improve the activity and reduce apoptosis of human myocardial cells.The molecular mechanism may be related to HIF-1α expression.
salidroside;human myocardial cells;hypoxia;cell activity;HIF-1α
R852.11
A
10.3969/j.issn.1005-8982.2017.08.005
1005-8982(2017)08-0021-06
2016-10-05
