载药再生细菌纤维素纤维的制备及其表征
2017-05-24吴焕岭盐城工业职业技术学院九洲药学院江苏盐城224005东华大学化学化工与生物工程学院上海201620
吴焕岭(1. 盐城工业职业技术学院 九洲药学院, 江苏 盐城 224005; 2. 东华大学 化学化工与生物工程学院, 上海 201620)
载药再生细菌纤维素纤维的制备及其表征
吴焕岭1,2
(1. 盐城工业职业技术学院 九洲药学院, 江苏 盐城 224005; 2. 东华大学 化学化工与生物工程学院, 上海 201620)
为获得一种具有优良生物相容性,能够用于伤口敷料的纤维材料,以细菌纤维素为原料,以氯化锂/二甲基乙酰胺为溶剂体系制备纺丝液,以水为凝固浴,采用湿法纺丝技术制备再生细菌纤维素纤维,进而以环丙沙星为模型药物对再生细菌纤维素纤维进行载药整理,制得一种可用于伤口敷料的载药纤维。通过X射线衍射、力学性能、载药性、释药性等测试对再生细菌纤维素纤维进行表征。结果表明:纤维直径约为40 μm,表面呈沟槽结构,力学强度可达2.5 cN/dtex;细菌纤维素再生后,晶型发生了改变,从纤维素Ⅰ型转化成纤维素Ⅱ型,且结晶度从66.3%降低至36.2%;载药和释药结果显示,再生细菌纤维素纤维在碱性条件下载药量最高,载药纤维在酸性条件下释药量最高。
再生细菌纤维素纤维; 湿法纺丝; 载药纤维; 生物医用材料
细菌纤维素(BC)由微生物发酵制得,具有与植物纤维素相同的分子结构,都是由葡萄糖组成的大分子多糖。与植物纤维素相比,它没有木质素和半纤维素等伴生产物,具有高持水性、高结晶度、超精细网络结构、极高的抗张强度和良好的生物相容性等特性[1-2],是一种可持续利用的生物质资源。然而,由于细菌纤维素不易溶解,缺乏可加工性的特点限制了其进一步开发利用,因此,为了弥补其缺陷,更好地发挥其优势特征,对其进行改性和材料复合方面的研究日益增多。通过原位生物生成法[3]、浸渍(后处理)法[4]、溶解再生法等对其进行改性或复合[5-6]。通过改性或复合的方式能够扩大细菌纤维素的应用领域,增强细菌纤维素在特定领域的应用效果,在生物医药[7]、分离纯化[8]、传感或导电材料[9]、增强材料[10]等领域都显示出较好的应用前景。
以前期研究[11]为基础,本文采用溶解再生法,即采用氯化锂/二甲基乙酰胺(LiCl/DMAc)溶剂体系将细菌纤维素溶解,利用湿法纺丝技术将纺丝液重塑制备了一种再生细菌纤维素(RBC)纤维;进而以环丙沙星为模型药物对其进行载药整理制备载药纤维。通过扫描电子显微镜、力学性能、X射线衍射及载药、释药性能等一系列表征来分析RBC纤维和载药RBC纤维的性能。
1 实验部分
1.1 材料与仪器
细菌纤维素(海南亿德食品有限公司),环丙沙星(TCI),二甲基乙酰胺(DMAc,分析纯),氯化锂(LiCl,分析纯)。
湿法纺丝机(东华大学),D2015W型搅拌仪(上海梅颖浦仪器仪表制造有限公司),FD-1D-50型冷冻干燥机(北京博医康仪器有限公司),UV-1800型紫外可见分光光度计(上海菁华科技仪器有限公司),SHZ-82A型气浴恒温强力测试仪(金坛市精达仪器制造厂),JSM-5600LV型扫描电子显微镜(日本日立公司),D/max-2550VB型X射线衍射仪(日本理学电器公司),XQ-2型纤维强度仪(上海利浦应用科学技术研究所)。
1.2 细菌纤维素纤维的制备
1.2.1 细菌纤维素的溶解
首先,将细菌纤维素膜水洗纯化并使用冻干机冻干,待用。其次,配制质量分数为8% 的LiCl/DMAc溶剂体系[12]。然后,将2.0 g细菌纤维素干膜置于98 g配好的溶剂中,先于90 ℃油浴加热并搅拌2 h,再在室温下搅拌一定时间,直至完全溶解,形成质量分数为2%的细菌纤维素纺丝液。
1.2.2 细菌纤维素纤维的湿法纺丝
采用湿法纺丝设备,在氮气的压力作用下将纺丝原液挤出喷丝孔进入凝固浴,经水洗、卷绕得到再生细菌纤维素纤维,纺丝条件如表1所示。

表1 细菌纤维素纤维的湿纺工艺参数Tab. 1 Wet spinning process parameters
注:各辊直径均为25 cm。
1.3 测试方法
1.3.1 线密度及力学性能测试
采用中段法测定载药纤维纱线线密度;采用XQ-2型纤维强伸度仪,按照GB/T 14344—2008《化学纤维长丝拉伸性能试验方法》进行测试。测试条件为:夹距20 mm,拉伸速度50 mm/min,环境相对湿度65%,温度20 ℃。
1.3.2 纤维形貌观察
采用JSM-5600LV型扫描电子显微镜(SEM)观察纤维的表面与断面结构。测试纤维表面,将纤维剪成3~5 mm小段,备用;测试纤维断面,把纤维置于液氮中冷冻脆断,备用。测试前将纤维黏贴到专用载样台上进行喷金处理,喷金厚度为20~30 nm。
1.3.3 结晶性能表征
采用D/max-2550VB型X 射线衍射仪测定结晶度。铜靶 Ni 过滤,管电压为40 kV,管电流为50 mA,2θ为5°~60°。
1.3.4 载药及释药测试
为便于考察pH值对载药性能的影响,排除体系中离子对分析载药性能的干扰,实验没有采用缓冲溶液,仅使用0.1 mol/L NaOH或HCl调节pH值。首先配制2.5 mg/L环丙沙星溶液。将0.2 g(干态)细菌纤维素纤维置于5.0 mL环丙沙星的溶液中,分别在pH值为5、7、9的条件下于50 ℃振荡浸渍4 h,对得到的载药纤维样品进行编号,分别为S1、S2、S3(未载药样品编号为S0)。用紫外分光光度计通过测试残液中环丙沙星的量来计算纤维上的载药量。每个样品做3个平行试样。
为便于考察酸碱性对释药的影响,仅采用中性条件下载药的纤维样品进行释药性能的测试。配制0.1 g/L环丙沙星溶液,将1.0 g(干态)细菌纤维素纤维放入50 mL环丙沙星的溶液中,在50 ℃下振荡浸渍4 h进行载药。然后分别将0.05 g载药纤维置于20 mL不同pH值(分别为5、7、9)的释药溶液中。每隔一定时间取释药液1 mL,待测,并补入1 mL空白溶液。每个样品做3个平行试样。
2 结果与讨论
2.1 RBC纤维的形貌
在扫描电镜下观察再生细菌纤维素纤维的微观形貌,结果如图1所示。可以看出,制备的再生细菌纤维素纤维形貌规整,直径约为40 μm,表面布满沟槽结构。这是由于再生细菌纤维素纤维在制备过程中需要经过水浴,吸收了大量水分,而后进行干燥,失水过程造成纤维表面形成沟槽。从图1还可看出,纤维断面呈椭圆形,结构致密,没有明显的孔洞结构。

图1 RBC纤维表面和断面的SEM照片Fig.1 SEM images of surface morphology (a) and cross-sectional morphology (b) of RBC fiber
2.2 BC膜与RBC纤维的结晶性能


图2 BC与RBC的X射线衍射图Fig.2 X-Ray diffractograms of BC and RBC
2.3 RBC纤维的载药量及其力学性能
表2示出再生纤维素纤维的载药量及力学性能。可看出:在pH=9的弱碱性条件下,细菌纤维素的载药量最高,为36.5 μg/mg;其次是在pH=7的中性条件下细菌纤维素的载药量为33.6 μg/mg;在pH=5的酸性条件下细菌纤维素的载药量最低,为28.2 μg/mg。
图3示出环丙沙星的分子结构。在载药条件下,其与纤维素纤维不会发生强烈的共价键结合,二者结合主要是通过氢键和范德华力的吸附作用进行,同时在一定条件下会产生弱离子键结合。在碱性条件下载药量最高,其次为中性条件,原因是在碱性或中性水溶液中的纤维素纤维(用Cell—OH表示)会形成Cell—O-,表面呈负电性[16],而环丙沙星呈现正电性Cipro+,二者会发生弱离子键结合,起到了促进药物上载的作用。而在酸性条件下,Cell—OH能够接受H+,并且分子间会产生强烈的氢键作用,环丙沙星中—NH—也容易季胺化而带正电,因此,二者除了氢键和范德华力的吸附作用之外,还存在一定的斥力作用,造成降低药物上载纤维的结果。
由表2还可看出不同pH值的载药条件对纤维力学性能的影响。载药对线密度的影响并不大,载药前后的线密度都是50 dtex左右;载药对强力和强度的影响比较大,酸性载药后的强力和强度分别降低了14% 和10%,这是由于纤维素不耐酸造成,碱性条件和中性条件下的强力和强度均略有升高;载药对断裂伸长率也有一定影响,在中性和酸性条件下,伸长率略有降低,而在碱性条件下略有升高。
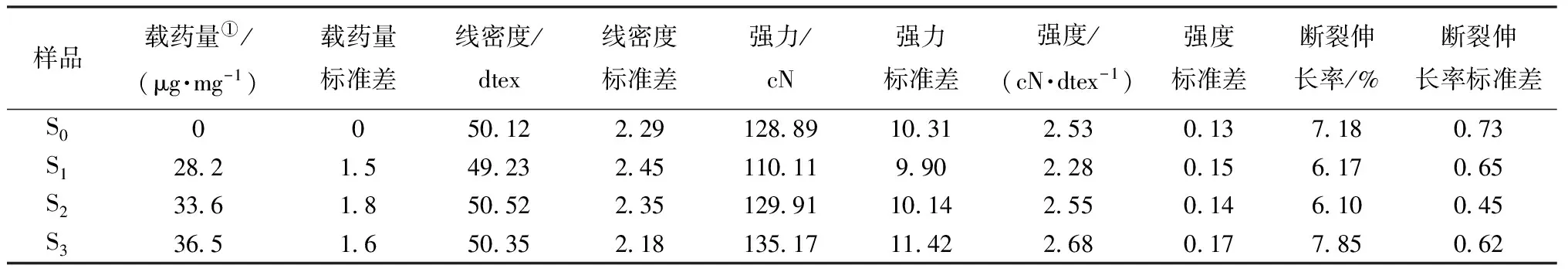
表2 湿纺再生细菌纤维素纤维的载药量及其力学性能Tab.2 Drug loading capacity and mechanical parameters of wet spun RBC fibers
注:①是指单位质量的纤维中载入的环丙沙星的质量。
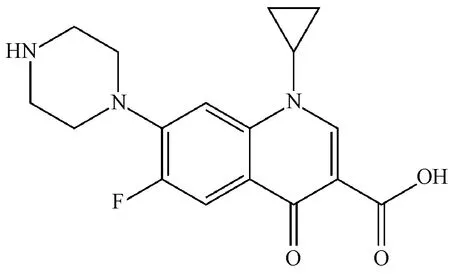
图3 环丙沙星的分子结构Fig.3 Chemical structure of ciprofloxacin
由以上分析可知,细菌纤维素纤维在不同pH值下的载药量明显不同,在弱碱性条件下的载药量最高,其次为中性条件,并且弱碱性和中性条件下对纤维力学性能的影响小。
2.4 细菌纤维素载药纤维的体外释药分析
图4示出同一批次制备的一定量载药纤维(0.1 g,中性条件载药)分别在pH值为 5、7、9的条件下的累积释药量。可明显看出:在pH值为5的酸性条件下的累积释药量最高,达到3.5 mg;其次在pH值为9的碱性条件为2.8 mg;在pH值为7的中性条件下释药量最低,为1.7 mg。在不同pH值下的累积释药量有很大不同,pH值为9时的释药量约为pH值为5时的2倍。这是由于药物与纤维主要通过氢键和范德华力的作用以及少量离子键进行结合,结合不牢固,因此,解析过程比较容易。在中性条件下,纤维通过自溶胀和自解吸来释放药物而达到平衡,因此,释药量最低。在酸性条件下,由于纤维素纤维不耐酸,易发生降解,为促进释药提供了条件。在碱性条件下,纤维素纤维更容易水合化和溶胀,利于促进释药。此外,碱性条件会导致环丙沙星与纤维的弱离子键发生断裂,造成碱性条件下的释药量较高,因此,在酸性条件和碱性条件下,除了纤维的自溶胀和自解吸作用外,电荷作用、降解作用起到了促进药物释放的结果。

图4 不同pH值下载药细菌纤维素纤维的体外释药量Fig.4 In vitro drug-release curves of drug-loaded RBC fibers
3 结 论
通过湿法纺丝技术成功制备了成形良好、力学性能优良的再生细菌纤维素(RBC)纤维。从BC制备RBC纤维的过程中,纤维素晶型发生了改变,从纤维素Ⅰ型转化成纤维素Ⅱ型,且结晶度从66.3%降为36.2%。以环丙沙星为模型药物,对RBC纤维进行载药和释药性能分析,结果显示,其在碱性条件下载药量最高,在酸性条件下释药量最高。
FZXB
[1] TANG W, JIA S, JIA Y, et al. The influence of fermentation conditions and post-treatment methods on porosity of bacterial cellulose membrane [J]. World Journal of Microbiology & Biotechnology, 2010, 26(1):125-131.
[2] 吕鹏飞, 王清清, 李国辉, 等. 织物表面修饰细菌纤维素对碳纤维织物性能的影响 [J]. 纺织学报, 2015, 36(7):50-54. LÜ Pengfei, WANG Qingqing, LI Guohui, et al.Influence of fabric surface modification of bacterial cellulose on carbon fiber fabric properties [J]. Journal of Textile Research, 2015, 36(7):50-54.
[3] GU J, CATCHMARK J M. Impact of hemicelluloses and pectin on sphere-like bacterial cellulose assembly [J]. Carbohydrate Polymers, 2012, 88(2): 547-557.
[4] SILVA N H C S, RODRIGUES A F, ALMEIDA I F, et al. Bacterial cellulose membranes as transdermal delivery systems for diclofenac: in vitro dissolution and permeation studies [J]. Carbohydrate Polymers, 2014, 106: 264-269.
[5] CHEN P, KIM H S, KWON S M, et al. Regenerated bacterial cellulose/multi-walled carbon nanotubes composite fibers prepared by wet-spinning [J]. Current Applied Physics, 2009, 9(2): 96-99.
[6] LU X, TANG S, HUANG B, et al. Preparation and characterization of bacterial cellulose/hydroxypropyl chitosan blend as-spun fibers [J]. Fibers and Polymers, 2013, 14(6): 935-940.
[7] UL-ISLAM M, SHAH N, HA J H. Effect of chitosan penetrationon physico-chemical and mechanical properties of bacterial cellulose [J]. Korean Journal of Chemical Engineering, 2011, 28(8), 1736-1743.
[8] JANTARAT C, TANGTHONG N, SONGKRO S, et al. S-Propranolol imprinted polymer nanoparticle-on-microsphere composite porous cellulose membrane for the enantioselectively controlled delivery of racemic propranolol[J]. International Journal of Pharmaceutics, 2008, 349(1/2): 212-225.
[9] FENG Y, ZHANG X, SHEN Y, et al. A mechanically strong, flexible and conductive film based on bacterial cellulose/graphene nanocomposite [J]. Carbohydrate Polymers, 2012, 87(1): 644-649.
[10] NOGI M, HANDA K, NAKAGAITO A N, et al. Optically transparent bionanofiber composites with low sensitivity to refractive index of the polymer matrix [J]. Applied Physics Letters, 2005, 87(24): 243110.
[11] WU H, BREMNER D H, LI H, et al. A novel multifunctional biomedical material based on polyacrylonitrile: preparation and characterization [J]. Materials Science and Engineering: C, 2016, 62: 702-709.
[12] 王敏, 朱平, 赵晓霞, 等. 细菌纤维素在 LiCl/DMAc 溶剂体系中的溶解性能研究 [J]. 合成纤维, 2008, 37(6): 20-23. WANG Min, ZHU Ping, ZHAO Xiaoxia, et al. Dissolution properties of bacterial cellulose in LiCl/DMAc solutions [J]. Synthetic Fiber in China, 2008, 37(6): 20-23.
[13] GAO Q, SHEN X, LU X. Regenerated bacterial cellulose fibers prepared by the NMMO·H2O process [J]. Carbohydrate Polymers, 2011, 83(3): 1253-1256.
[14] 朱勇军, 任力, 李立风, 等. 再生细菌纤维素膜的制备与性能表征[J]. 功能材料, 2013, 44(23): 3474-3477. ZHU Yongjun, REN Li, LI Lifeng, et al. Preparation and characterization of regenerated bacterial cellulose membrane [J]. Journal of Functional Materials, 2013, 44(23): 3474-3477.
[15] 赵晓霞, 朱平, 王敏, 等. 细菌纤维素再生前后结构与性质上的差异 [J]. 合成纤维, 2009,38 (1): 6-10. ZHAO Xiaoxia, ZHU Ping, WANG Min, et al. The comparison between bacterial cellulose and regenerated bacterial cellulose on structure and properties [J]. Synthetic Fiber in China, 2009,38 (1): 6-10.
[16] 赵涛.染整工艺学教程[M].北京:中国纺织出版社,2005:59. ZHAO Tao. Dyeing and Finishing Process Tutorial[M]. Beijing: China Textile & Apparel Press,2005:59.
Preparation and characterization of drug-loaded regenerated bacterial cellulose fiber
WU Huanling1,2
(1.JiuzhouCollegeofPharmacy,YanchengInstituteofIndustryTechnology,Yancheng,Jiangsu224005,China; 2.CollegeofChemistry,ChemicalEngineeringandBiotechnology,DonghuaUniversity,Shanghai201620,China)
The regenerated bacterial cellulose(RBC)fiber used for wound dressing and having good biocompatibility was prepared by a wet spinning process, taking bacterial cellulose as raw material, adopting LiCl/Dimethylacetamide as solvent system and using water as coagulation bath. Then ciprofloxacin was used as the model drug to prepare drug-loaded RBC fiber. The characterization of morphological, mechanical properties, XRD, drug loading and release performance were determined. The results shows that the RBC fiber has a groove surface structure with a diameter of about 40 μm. The tensile breaking strength of the RBC fiber is as high as 2.5 cN/dtex. X-ray diffraction results indicate that the crystal form of RBC fiber is transformed from cellulose crystalⅠto II, and the degree of crystallinity is reduced from 66.3% to 36.2%. The drug loading and release experiments show that the RBC fiber has the highest drug loading capacity under alkaline condition, while the drug loaded RBC fiber has the largest release amount under acid condition.Keywords regenerated bacterial cellulose fiber; wet spinning; drug-loaded fiber; biomedical materials
2016-04-27
2017-02-16
盐城工业职业技术学院科研基金项目(ygy1512);高等学校学科创新引智计划建设项目(B07024)
吴焕岭(1982—),女,讲师,博士。主要研究方向为载药纤维的研发及释药机制。E-mail: wuhuanlingok@126.com。
10.13475/j.fzxb.20160407505
TS 102.5; TB 332
A
