集成惯性聚焦结构的介电泳微流控芯片的粒子连续分离*
2017-05-24曾一笑谭秋林
曾一笑,方 明,樊 磊,吴 菲,谭秋林*,孙 东
(1.中北大学电子测试技术重点实验室,太原 030051;2.仪器科学与动态测试教育部重点实验室,太原 030051)
集成惯性聚焦结构的介电泳微流控芯片的粒子连续分离*
曾一笑1,2,方 明1,樊 磊1,2,吴 菲1,2,谭秋林1,2*,孙 东1,2
(1.中北大学电子测试技术重点实验室,太原 030051;2.仪器科学与动态测试教育部重点实验室,太原 030051)
设计并制造了一种带有惯性聚焦结构的介电泳微流控芯片,以实现不同介电性质的粒子连续分离。采用MEMS工艺制作了介电泳微流控芯片:通道入口侧壁设置一对梯形结构使经过的粒子受惯性升力的作用聚焦到通道两侧;通道底部光刻一组夹角为90°的倾斜叉指电极产生非均匀电场,利用介电泳力和流体曳力的合力使通道两侧不同的粒子发生角度不同的偏转进入不同通道,从而实现分离。将酵母菌细胞和聚苯乙烯小球作为实验样本,分析了流速和交流电压对分离的影响,确定了二者分离的最优条件并进行分离。实验结果表明,将电导率为20 μS/cm的样本溶液以5 μL/min的流速注入到通道中,施加6 Vp-p、10 kHz的正弦信号,酵母菌细胞沿电极运动至夹角处后沿通道中心排出,聚苯乙烯小球沿通道两侧排出,成功实现分离,平均分离效率达92.8%、平均分离纯度达90.7%。
介电电泳;惯性聚焦;微流控芯片;连续分离
随着微制造技术的发展,应用于生物学的集成流体、电场以及光学元件的芯片发展迅速[1-3]。这些芯片充分利用不同的技术进行样品的制备以及分析。在样品制备方面,一种重要的技术就是细胞分离,它包含光学[4]、电学[5]、声学[6]、流体学[7]、磁学[8]等方法。其中介电电泳能在微通道中利用外加电压对粒子产生非接触力,根据细胞的性质如尺寸[9]、密度[10]、介电性质[11]等进行分离,是一种不需要对粒子进行标记,对细胞无损伤,可同时对多细胞进行操作,而且还可以与其他技术相结合进而提高分离效率的方法。
传统的介电泳粒子分离主要分为间断分离和连续分离:Markx等人[12]利用城垛型电极间断分离了酵母菌细胞和巨大芽孢杆菌,这种分离方法需要间断性的施加或者关闭电场,分离过程复杂、效率低、周期长,并且不能分离介电性质相同的粒子;Liming Yu等人[13-15]制备了3D硅电极对活酵母菌和死酵母菌细胞进行分离,这种方法虽然减少了电场在垂直方向的衰减、提高了间断分离的效率,但是加工工艺困难、成本昂贵;Jason G等人、Il Doh等人和Unyoung Kim等人[16-19]利用介电泳力均实现了不同粒子的连续分离,与间断分离方法相比缩短了粒子的分离周期提高了工作效率。但是这些连续分离方法往往需要双通道或多通道引入缓冲液,先精确调节缓冲液与样本溶液的流速比实现对样本的聚焦后再进行介电泳分离,过程十分复杂并且导致了样本密度的减小。
本文设计并制造了一种带有梯形惯性聚焦结构的介电泳微流控芯片,用于粒子连续、高通量的分离。芯片采用设有一对梯形结构的单通道入口,能够不需要任何附加力就实现粒子高通量聚焦,再对粒子进行介电泳连续分离,避免了复杂的流量控制,简化了分离过程。并且这种惯性聚焦结合介电泳分离的方法与单纯的惯性流体分离方法[20-21]相比,通道结构简单,分离效率也有较大的提高。首先,利用通道入口两侧的梯形结构使通过的粒子受到惯性升力的作用,将粒子聚焦到通道两侧,采用夹角为90°的阵列叉指电极结构产生非均匀电场,根据不同介电性质的粒子所受介电泳力不同[22],使通道中的两种粒子在流体曳力的作用下发生不同角度的偏转而进入不同的出口进行分离。
1 实验部分
1.1 分离原理
样本由入口注入到通道中经过梯形结构时,这种缩放结构改变了通道中流场的方向,粒子主要受到惯性升力和动量变化引起的惯性力的作用。在低流速时,粒子所受到的惯性升力Fi占主导作用,粒子在惯性升力的作用下背离梯形结构向位于微通道两侧的平衡位置运动,在通道两侧聚焦成两股颗粒流[23-24],其表达式为[25]:
(1)式中:CL为无量纲升力系数,ρf为流体密度,G=Um/Dh为流体的剪切率(Um为流体的流速,Dh为微通道直径),αp为粒子直径。
如图1所示,粒子进入非均匀电场时,主要受到垂直于电极方向的介电泳力FDEP和水平方向的流体曳力FDrag的共同作用发生偏转,偏转角度的大小取决于介电泳力和流体曳力的相对大小。
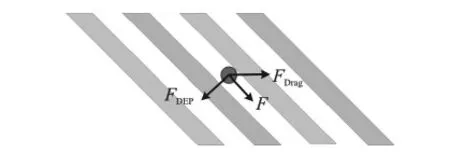
图1 粒子在通道中的受力分析
对于一个半径为r的球形粒子,其在交流电场中受到的介电泳力[26]:
(2)

FDrag=6πηrv
(3)
式中:流体的粘度为η,流体的流速为ν。由以上分析可知,粒子所受介电泳力的大小与粒子的CM因子有关,所以,当不同介电性质的粒子在通道两侧经过插指电极上方时所受的介电泳力大小不同,一种粒子受较大的介电泳力在曳力的作用下发生偏转沿电极运动;另一种粒子受较小的介电泳力(或不受介电泳力)基本不发生偏转在曳力的作用下水平运动,从而实现分离。
1.2 芯片的设计和制作
根据分离原理设计了如图2(A)所示微流控芯片结构。芯片由ITO电极和微通道组成。通道部分有一个主通道和3个分通道,通道入口处设有一对梯形结构,通道内部由24对夹角为90°的倾斜阵列插指电极构成,两侧分别连接函数信号发生器。施加一定的流速使混合粒子溶液从通道入口进入,粒子经过微通道入口处梯形缩放结构时,受到惯性升力的作用分别被聚焦到通道两侧的平衡位置,施加正弦信号,两种不同粒子经过非均匀电场受大小不同的合力分别从中心和两侧出口流出,图2(B)。芯片各部分尺寸如图2(C)所示,倾斜插指电极宽度为30 μm,电极间隔为30 μm,主通道宽度为400 μm、高度为50 μm,分通道的宽度分别为350 μm、400 μm、350 μm,梯形结构的宽度为250 μm、高度为170 μm。
微流控芯片的加工工艺流程如图2(E)所示。在镀有ITO薄膜的玻璃上旋涂厚度约为2 μm的正光刻胶(RZJ304),通过匀胶,曝光,显影,湿法刻蚀以及剥离等工艺过程制作出微流控芯片微电极结构。在2.5 inch硅片旋涂50 μm厚的负光刻胶(SU8-2025),通过匀胶、曝光、显影得到微通道的阳模结构。然后,将PDMS预聚物与固化剂按10∶1混合,经抽真空后浇注在微通道的阳模结构上,95 ℃下固化2 h,剥离后得到PDMS微通道。将氧等离子体处理过的PDMS微流通道和玻璃基片在通道和电极位置对准之后进行键合。加工好的微流控芯片如图2(D)所示。

图2 (A)微流控芯片的设计;(B)微流控芯片的工作原理;(C)微流控芯片各部分尺寸;(D)微流控芯片实物图;(E)微流控芯片加工工艺流程:(a)ITO电极的制作(b)PDMS微通道的制作(c)键合
1.3 样本准备和实验平台
采用酵母菌细胞(5 μm,安琪酵母股份有限公司)和聚苯乙烯小球(10 μm,天津倍思乐)作为分离实验样本。将酵母菌细胞在 30 ℃ 的细胞培养液中培养24 h,经过离心后弃去上层清液,加入去离子水,进行二次离心,重复3 次,得到酵母菌细胞悬浮液(1×106/mL);将去离子水中加入0.1 wt%的Tween-20对聚苯乙烯小球进行清洗后加入去离子水备用(0.2×106/mL)。将酵母菌细胞溶液和聚苯乙烯小球溶液以1∶1体积比混合制成样本溶液,通过添加少量的混合磷酸缓冲液(PBS,HyClone)调节电导率至20 μS/cm。
介电泳细胞分离装置主要由计算机,倒置显微镜(Axio Vert.A1,蔡司),函数信号发生器(AFG-3081,安捷伦科技有限公司),注射泵(LSP01-2A,兰格恒流泵有限公司)以及介电泳芯片构成。电极的两端分别连接函数信号发生器的输出端口以及接地端口,信号采用正弦信号。采用注射泵控制粒子混合溶液在微通道中的流速,通过连接到显微镜上的CCD相机(德国 Imaging Source 公司)记录粒子在电场作用下的运动情况。
1.4 酵母菌细胞和聚苯乙烯小球的分离实验
根据本课题组先前的研究结果可知[27-28],由于酵母菌细胞和聚苯乙烯小球的介电性质不同,在电导率为20 μS/cm缓冲液中,施加10 kHz频率的正弦信号,酵母菌细胞受较大的负介电泳力,而聚苯乙烯小球受微弱的正介电泳力。所以,根据酵母菌细胞受较大的介电泳力在曳力的作用下沿电极运动而聚苯乙烯小球受较小的介电泳力在曳力的作用下水平运动的原理实现二者的分离。
1.4.1 梯形结构对粒子聚焦的影响
由式(1)可知,流体的流速决定了其所受惯性升力的大小,从而影响粒子的聚焦。将样本溶液以1 μL/min、3 μL/min、5 μL/min的流速注入到带有梯形结构的微通道中,观察梯形结构对粒子聚焦的影响。
1.4.2 流速对粒子分离的影响
由式(3)可知,流体的流速对粒子所受曳力的大小有直接的影响。为了考察流速对粒子分离的影响,施加6 Vp-p、10 kHz的正弦信号令介电泳力大小不变,分别观察酵母菌细胞和聚苯乙烯小球在3 μL/min、5 μL/min、8 μL/min、10 μL/min流速下的分离情况。
1.4.3 电压对粒子分离的影响
正弦信号电压的大小直接决定了其所受介电泳力的大小(式(2))。为了考察电压大小对粒子分离的影响,在流速为5 μL/min、频率为10 kHz时,观察电压分别为8 Vp-p、6 Vp-p、4 Vp-p、3 Vp-p时的分离情况。
1.4.4 酵母菌细胞和聚苯乙烯小球的分离
以5 μL/min的流速将样本溶液注入到芯片中,施加电压为6 Vp-p、频率为10 kHz的正弦信号,观察酵母菌细胞和聚苯乙烯小球的分离并计算分离效率。

图4 6 Vp-p交流电压、不同流速下酵母菌细胞和聚苯乙烯小球的分离
2 结果与讨论
2.1 梯形结构对粒子聚焦的影响
图3是样本溶液流速分别为1 μL/min、3 μL/min、5 μL/min时粒子的运动轨迹:流速为1 μL/min时,粒子在经过梯形结构开始有分别向通道的两个侧壁偏转的趋势(图3(a));随着流速增加到3 μL/min时(图3(b)),粒子偏转的趋势越来越明显;当流速增加到5 μL/min时,粒子的运动轨迹如图3(c)所示,粒子被聚焦到了通道的上部和下部两部分,聚焦现象十分明显。这是由于流体的流速越快,粒子所受的惯性升力越大、聚焦越明显,说明微通道中的梯形结构可以实现粒子的高通量聚焦,为粒子的介电泳分离做准备。

图3 酵母菌和聚苯乙烯小球混合液经过梯形结构
2.2 流速和电压对粒子分离的影响
2.2.1 流速对粒子分离的影响
图4是正弦信号为6 Vp-p、1 kHz时,3 μL/min、5 μL/min、8 μL/min、10μL/min流速下的酵母菌细胞和聚苯乙烯小球在惯性聚焦后经过非均匀电场的分离情况。如图4(a),调整流速为3 μL/min,酵母菌细胞所受负介电泳力占优势,沿电极方向从通道两侧运动到电极的夹角处并吸附在电极上,聚苯乙烯小球受较微弱的正介电泳力,流体曳力占主导作用,在通道两侧沿水平方向从出口1、3流出;增加流速至5 μL/min时,流体曳力与介电泳力基本平衡,酵母菌细胞运动至夹角处后随着流体沿通道中心线运动至出口2,聚苯乙烯小球运动轨迹不变,图4(b);流速为8 μL/min时,酵母菌细胞所受曳力占优势,大部分酵母菌细胞随流体排出,图4(c);当流速增至10 μL/min时,流体曳力过大,酵母菌细胞基本没有偏转的趋势,两种粒子均随流体排出,无法实现分离,图4(d)。所以,在施加6 Vp-p、1 kHz的正弦信号时,选择5 μL/min的流速最优。
2.2.2 交流电压对粒子分离的影响
图5是施加5 μL/min流速,频率为10 kHz、电压分别为8 Vp-p、6 Vp-p、4 Vp-p、3 Vp-p正弦信号下经过惯性聚焦后的酵母菌细胞和聚苯乙烯小球在非均匀电场中的分离情况。当调整正弦信号电压为8 Vp-p时,酵母菌细胞所受负介电泳力占优势,从通道两侧沿电极运动至夹角处被吸附在电极上,不能随流体排出,聚苯乙烯小球受正介电泳力较小、曳力占主导作用,在通道的两侧沿水平方向从出口1、3流出,图5(a);降低电压至6 Vp-p,介电泳力减小至与曳力平衡,酵母菌细胞运动至夹角后沿通道中心线从出口2流出,聚苯乙烯小球运动轨迹不变,图5(b);电压为4 Vp-p时,随流体排出的酵母菌细胞数量增加,图5(c);电压降低到3 Vp-p时,曳力占优势,酵母菌细胞大部分被流体带走,只有少部分运动至夹角处,分离效果较差,图5(d)。所以,在施加5 μL/min流速,频率为10 kHz的正弦信号时,电压为6 Vp-p为最优。

图5 5 μL/min流速、不同电压下酵母菌细胞和聚苯乙烯小球的分离
综上所述,在样本溶液的电导率为20 μS/cm时,选择10 kHz、6 Vp-p正弦信号、5 μL/min流速作为酵母菌细胞和聚苯乙烯小球的分离条件为最佳。
2.3 酵母菌细胞和聚苯乙烯小球的分离
图6是样本溶液在5 μL/min流速下,施加电压为6 Vp-p、频率为10 kHz的正弦信号时酵母菌细胞和聚苯乙烯小球的分离情况。
酵母菌细胞和聚苯乙烯小球首先经过通道两侧的梯形结构被聚焦到通道两侧(图6(a)),然后在通道两侧随着流体沿水平方向运动;经过非均匀电场时,酵母菌细胞沿电极方向运动到电极夹角处后在通道中心线向出口2运动,聚苯乙烯小球在通道两侧沿水平方向向出口1、3运动,实现了连续分离(图6(b))。

图6 施加5 μL/min的流速、6 Vp-p 10 kHz正弦信号时酵母菌细胞和聚苯乙烯小球的分离情况
2.4 分离效率的计算
选择聚苯乙烯小球为目标粒子,定义一定时间内出口1和3收集到的聚苯乙烯小球数量M1和3个出口收集到的聚苯乙烯小球数量总和M2之比为分离效率,出口1和3内收集到的聚苯乙烯小球数量N1、N12分别与出口1和3内粒子总数N2、N22之比的均值为分离纯度。利用血细胞计数板进行计数,30 s内出口1、2、3收集到的聚苯乙烯小球数量分别为243、38、298,出口1、3 收集到的酵母菌数量为261、327,则M1=541、M2=579、N1=243、N2=261、N12=298,N22=327,芯片的分离效率约为93.4%、纯度为93.1%,重复多次实验芯片的平均分离效率为92.8%,平均纯度为90.7%。
3 结论
设计并制造了一种用于粒子连续分离的带有惯性聚焦结构的介电泳微流控芯片。分析了粒子在微通道中的受力情况,并对流速和交流电压对酵母菌细胞和聚苯乙烯小球分离的影响进行了讨论。利用酵母菌细胞和聚苯乙烯小球作为细胞模型验证芯片的功能,调整电压和流速的大小,确定了二者分离的最优条件,并以此条件对样本溶液进行了分离实验。结果表明,以5 μL/min 流速将电导率为20 μS/cm的样本溶液注入芯片,施加6 Vp-p、10 kHz的正弦信号时,酵母菌细胞和聚苯乙烯小球先经过梯形结构被聚焦到通道两侧,然后在非均匀电场中酵母菌细胞从通道两侧沿电极运动至夹角处后从出口2排出,聚苯乙烯小球从出口1、3排出,实现分离,其平均分离效率达到92.8%、纯度达90.7%。该芯片在通道入口两侧设置了一对梯形结构,利用惯性将粒子聚焦后再进行介电泳分离,提高了芯片的分离效率,避免了样本浓度的稀释,并且利用介电性质不同对粒子分离,对粒子的尺寸、密度没有要求,可以广泛的用于不同种类细胞、微粒的连续高效的分离。
[1] Srinivasan V,Pamula V K,Fair R B. An Integrated Digital Microfluidic Lab-on-a-Chip for Clinical Diagnostics on Human Physiological Fluids[J]. Lab on a Chip,2004,4(4):310-315.
[2] Zeng J,Korsmeyer T. Principles of Droplet Electrohydrodynamics for Lab-on-a-Chip[J]. Lab on a Chip,2004,4(4):265-277.
[3] Balslev S,Jorgensen A M,Bilenberg B,et al. Lab-on-a-Chip with Integrated Optical Transducers[J]. Lab on a Chip,2006,6(2):213-217.
[4] Huang S B,Wu M H,Lin Y H,et al. High-Purity and Label-Free Isolation of Circulating Tumor Cells(CTCs)in a Microfluidic Platform by Using Optically-Induced-Dielectrophoretic(ODEP)Force[J]. Lab on a Chip,2013,13(7):1371-1383.
[5] Doh I,Cho Y H. A Continuous Cell Separation Chip Using Hydrodynamic Dielectrophoresis(DEP)Process[J]. Sensors and Actuators A:Physical,2005,121(1):59-65.
[6] Li P,Mao Z,Peng Z,et al. Acoustic Separation of Circulating Tumor Cells[J]. Proceedings of the National Academy of Sciences,2015,112(16):4970-4975.
[7] Yamada M,Nakashima M,Seki M. Pinched Flow Fractionation:Continuous Size Separation of Particles Utilizing a Laminar Flow Profile in a Pinched Microchannel[J]. Analytical Chemistry,2004,76(18):5465-5471.
[8] Smistrup K,Hansen O,Bruus H,et al. Magnetic Separation in Microfluidic Systems Using Microfabricated Electromagnets—Experiments and Simulations[J]. Journal of Magnetism and Magnetic Materials,2005,293(1):597-604.
[9] Kang K H,Kang Y,Xuan X,et al. Continuous Separation of Microparticles by Size with Direct Current-Dielectrophoresis[J]. Electrophoresis,2006,27(3):694-702.
[10] Huang L R,Cox E C,Austin R H,et al. Continuous Particle Separation Through Deterministic Lateral Displacement[J]. Science,2004,304(5673):987-990.
[11] Markx G H,Pethig R. Dielectrophoretic Separation of Cells:Continuous Separation[J]. Biotechnology and Bioengineering,1995,45(4):337-343.
[12] Markx G H,Huang Y,Zhou X F,et al. Dielectrophoretic Characterization and Separation of Micro-Organisms[J]. Microbiology,1994,140(3):585-591.
[13] Yu L,Iliescu C,Xu G,et al. Sequential Field-Flow Cell Separation Method in a Dielectrophoretic Chip with 3-D Electrodes[J]. Journal of Microelectromechanical Systems,2007,16(5):1120-1129.
[14] Iliescu C,Xu G L,Samper V,et al. Fabrication of a Dielectrophoretic Chip with 3D Silicon Electrodes[J]. Journal of Micromechanics and Microengineering,2005,15(3):494-500(7).
[15] Tay F,Yu L,Pang A J,et al. Electrical and Thermal Characterization of a Dielectrophoretic Chip with 3D Electrodes for Cells Manipulation[J]. Electrochimica Acta,2007,52(8):2862-2868.
[16] J G K,M T W L,M A S,et al. Continuous Dielectrophoretic Size-Based Particle Sorting[J]. Analytical Chemistry,2006,78(14):5019-25.
[17] Doh I,Cho Y H. A Continuous Cell Separation Chip Using Hydrodynamic Dielectrophoresis(DEP)Process[J]. Sensors and Actuators A Physical,2005,121(1):59-65.
[18] Kim U,Qian J,Kenrick S A,et al. Multitarget Dielectrophoresis Activated Cell Sorter.[J]. Analytical Chemistry,2008,80(22):8656-61.
[19] Rakow A L,Fernald D. Concentration of Spirulina,Suspensions by Radial Migration with Flow Through Vertical Tees[J]. Biotechnology Progress,2003,7(4):343-347.
[20] Bhagat A A S,Papautsky I. Enhanced Particle Filtration In Straight Microchannels Using Shear-Modulated Inertial Migration[J]. Physics of Fluids,2008,20(10):101702-101702-4.
[21] Di Carlo D,Irimia D,Tompkins R G,et al. Continuous Inertial Focusing,Ordering,and Separation of Particles in Microchannels[J]. Proceedings of the National Academy of Sciences,2007,104(48):18892-18897.
[22] 陈慧英,韩萍,王斌,等. 介电泳芯片的研制及不同细胞介电分离的应用[J]. 传感技术学报,2010,23(6):757-763.
[23] Park J S,Jung H I. Multiorifice Flow Fractionation:Continuous Size-Based Separation of Microspheres Using a Series of Contraction/Expansion Microchannels[J]. Analytical Chemistry,2009,81(20):8280-8288.
[24] Park J S,Song S H,Jung H I. Continuous Focusing of Microparticles Using Inertial Lift Force and Vorticity Via Multi-Orifice Microfluidic Channels.[J]. Lab on A Chip,2009,9(7):939-48.
[25] Li H,Bashir R. Dielectrophoretic Separation and Manipulation of Live and Heat-Treated Cells of Listeria on Microfabricated Devices with Interdigitated Electrodes. Sens. Actuators B 86,215-221[J]. Sensors and Actuators B Chemical,2002,86(2-3):215-221.
[26] Qian C,Huang H,Chen L,et al. Dielectrophoresis for Bioparticle Manipulation[J]. International Journal of Molecular Sciences,2014,15(10):18281-18309.
[27] 张洋,张晓飞,白国花,等. 用于细胞排列的介电泳微流控芯片制备与实验研究[J]. 分析化学,2014(11):1568-1573.
[28] 方明. 粒子连续分离介电泳微流控芯片的研究[D]. 太原:中北大学,2016:26-27.
Continous Particles Separation of the Dielectrophoresis-Based Microfluidic Chip with Inertial Focusing Structure*
ZENG Yixiao1,2,FANG Ming2,FAN Lei1,2,WU Fei1,2,TAN Qiulin1,2*,SUN Dong1,2
(1.Key Laboratory of Instrumentation Science and Dynamic Measurement,Ministry of Education,Taiyuan 030051,China2.Science and Technology on Electronic Test and Measurement Laboratory,North University of China,Taiyuan 030051,China)
A dielectrophoresis microfluidic chip with inertial focusing structure was designed and fabricated to realize the continuous separation of particles with different dielectric properties. The dielectrophoresis microfluidic chip was fabricated by MEMS:a pair of trapezoidal structures is provided at the inlet side walls of the channels to allow the passing particles to be focused by inertial lift forces on either side of the channel. At the bottom of the channel,a set of tilted interdigitated electrodes with an included angle of 90 ° were etched to produce a non-uniform electric field. By using the force of the dielectrophoretic force and the fluid drag force,the different particles on both sides of the channel are deflected into different channels at different angles so as to realize the separation. Saccharomyces cells and polystyrene beads were used as experimental samples. The effects of flow rate and AC voltage on the separation were analyzed. The optimal conditions for the separation of the two were determined and the separation was carried out. Experimental results show that the yeast cell is discharged along the channel center at the angle between the electrode and the electrode. Polystyrene beads are discharged along the side of the channel. A sample solution with a conductivity of 20 μS/cm was injected into the channel at a flow rate of 5 μL/min. Applying 6 Vp-p,10 kHz sine signal. The average separation efficiency reached 92.8% and the purity reached 90.7%.
dielectrophoresis;inertial focusing;microfluidic chip;continous separation

曾一笑(1990-),女,硕士,主要研究方向为微流控芯片,15135164475@163.com;

谭秋林(1979-),男,教授,博士生导师,主要研究方向为光学气体传感器、无线无源微纳传感器,tanqiulin@nuc.edu.cn。
项目来源:山西省基础研究项目(2014011021-3)
2016-10-17 修改日期:2016-12-27
O652
A
1004-1699(2017)05-0667-07
C:O652
10.3969/j.issn.1004-1699.2017.05.006
