81例儿童造血干细胞移植后泌尿系损伤临床分析
2017-05-24陈如月唐韩云冯雅君沈芸妍徐勤英朱雪明李晓忠
陈如月 唐韩云 陈 青 冯雅君 沈芸妍 徐勤英 朱 赟 朱雪明 李晓忠
苏州大学附属儿童医院肾脏风湿免疫科(江苏苏州 215025)
81例儿童造血干细胞移植后泌尿系损伤临床分析
陈如月 唐韩云 陈 青 冯雅君 沈芸妍 徐勤英 朱 赟 朱雪明 李晓忠
苏州大学附属儿童医院肾脏风湿免疫科(江苏苏州 215025)
目的探讨儿童造血干细胞移植后泌尿系损伤的病因、病理以及治疗和预后。方法回顾分析81例行造血干细胞移植患儿的临床资料,并复习相关文献。结果在81例患儿中,男50例、女31例,年龄8个月~17岁。肾前性损伤30例(37%),予积极补液等对症治疗后即恢复。肾性损伤9例(11.1%),其中4例放弃或转院,预后不详;其余5例行肾活检明确病理,经积极对症、对因治疗后,4例肌酐以及肾小球滤过率均恢复正常,但在长期随访中,1例因原发疾病复发、干细胞再输注合并肾衰竭死亡,其余3例进入慢性肾脏病;1例合并肾脏血栓性微血管病进入慢性透析。肾后性损伤包括出血性膀胱炎23例(28.4%)和泌尿道感染13例(16.0%),予大量补液、碱化尿液以及抗感染等治疗后,短期内多恢复,预后良好。结论造血干细胞移植后泌尿系损伤分为肾前性、肾性及肾后性,其中肾性损伤多复发。
造血干细胞移植; 移植物抗宿主病; 肾毒性药物; 移植后血栓性微血管病; 儿童
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是多种血液系统疾病的有效治疗手段。近年来,随着HSCT的广泛应用,移植后泌尿系损伤的报道也逐渐增多,包括急性肾损伤(acute kidney injury,AKI)、慢性肾脏病(chronic kidney disease, CKD)、移植相关性血栓性微血管病(transplantation associated thrombotic microangiopathy,TA-TMA)、出血性膀胱炎(hemorrhagic cystitis,HC)等。现回顾81例HSCT患儿的临床资料,并对其泌尿系损伤发病机制、肾活检病理、治疗及预后进行讨论分析。
1 临床资料
收集苏州大学附属儿童医院血液科2014年1月至2015年12月间HSCT患儿的临床资料。其中,男50例、女31例,移植时中位年龄7.3岁(8个月~17岁)。81例患儿中,肾前性损伤30例(37%)。除了原发性疾病临床表现外,多无其他表现,仅为肌酐、尿素、尿酸及肾小球滤过率等肾功能指标轻度异常,以尿素、尿酸升高为主。经早期积极停用或减量肾毒性药物,大量补液等对症处理后,短期内均恢复,预后良好。
肾性损伤9例(11.1%),其中4例放弃或转院,预后不详。其余5例行肾脏穿刺活检。5例患儿中,3例在移植后100天内发生AKI,pRIFLE分期2~3期,在积极的降压、利尿和糖皮质激素、免疫抑制剂等治疗后肌酐、尿素、尿酸以及肾小球滤过率恢复正常。但在长期随访中,1例患儿因血液系统疾病复发,再次行干细胞输注后发生肾衰竭,自动出院后死亡;2例有反复蛋白尿(+),通过简易Schwartz公式[1]估算eGFR分别进入CKD1~2期;1例患儿在移植后4个月出现肾损伤,积极对症对因治疗后肾功能治疗恢复,但长期随访反复蛋白尿(++),估算eGFR进入CKD2期;1例患儿移植前血肌酐即有升高,移植后进一步加重,合并肾脏血管性微血管病(thrombotic microangiopathy,TMA)进入慢性终末期肾脏病(end-stage renal disease,ESRD),见表1。5例肾活检免疫荧光可见表现不同程度的IgG、IgA、IgM、C3、C1q等阳性沉积于小血管壁或肾小球系膜区及血管袢(表2,图1);光镜示轻至重度的系膜增生或膜增生性改变,小管有不同程度的上皮细胞变性或/和小管间质淋巴细胞浸润,2例可见小血管壁增厚、腔内微血栓形成(图2)。
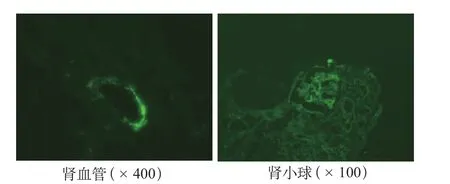
图1 肾活检免疫荧光结果
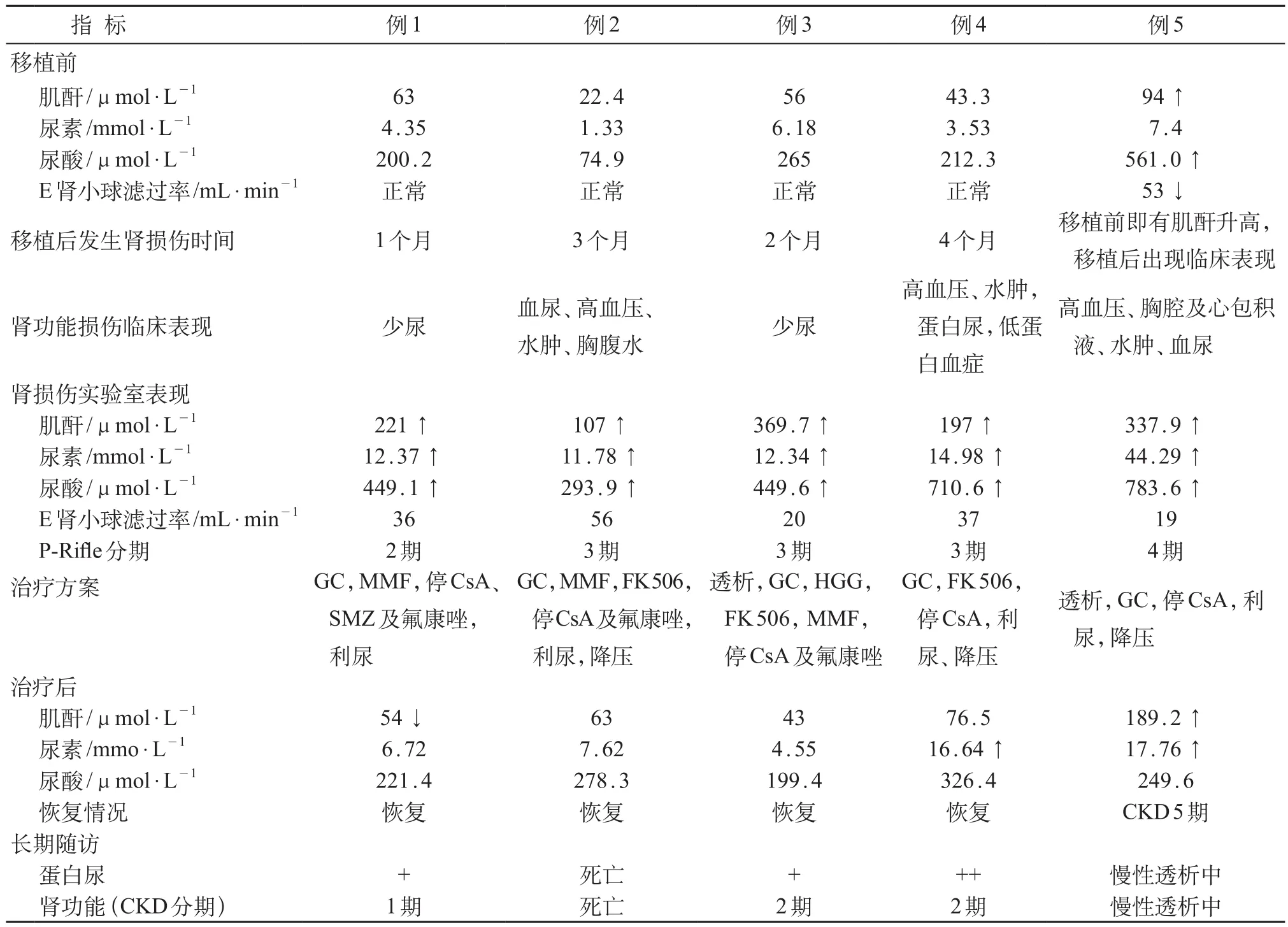
表1 5例移植前、治疗前后的肾功能实验室指标
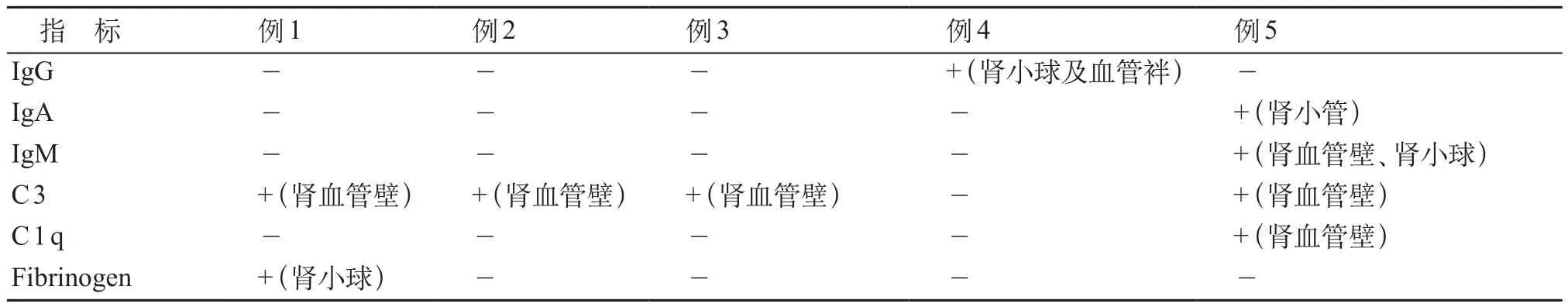
表2 肾活检免疫荧光结果

图2 肾活检光镜病理检查
肾后性损伤36例,包括出血性膀胱炎23例(28.4%)和泌尿道感染13例(16.0%)。其中8例行尿病原学检查:屎肠球菌4例、大肠埃希菌1例及BK多瘤病毒(BK polyomavirus) 3例。予大量补液、碱化尿液以及抗感染等治疗后,短期内多恢复,预后良好。
2 讨论
HSCT后泌尿系损伤分为肾前性、肾性及肾后性3个方面,考虑与移植物抗宿主病(GVHD)、肾毒性药物及移植后并发症等多重因素共同作用所致。
肾前性损伤主要与肾灌注不足相关,利尿剂的过度应用引起肾性失液以及血管紧张素转化酶抑制剂、血管紧张素Ⅱ受体阻滞剂等所致肾自主调节受损。急性移植物抗宿主病(acute graft versus host disease,aGVHD)通过损伤皮肤胃肠道等导致液体丢失[2]。通过损伤肝窦内皮细胞、激活肝星形细胞,导致门静脉高压[3],即肝静脉闭塞综合征(hepatic vein occlusion syndrome,HOVD)进一步引起肾血流灌注不足。预处理中大剂量放化疗、受损组织分泌的细胞因子、体内微生物分泌物破坏黏膜屏障以及移植过程中使用的药物、供者移植物植入过程等激活内皮细胞,损伤毛细血管壁,导致毛细血管渗漏综合征(capillary leak syndrome,CLS),引起血容量不足[4]。
HSCT后的肾性损伤的病因包括慢性移植物抗宿主病(chronic graft versus host disease,cGVHD)、肾毒性药物的应用、感染以及原发疾病复发等。一些小鼠移植物抗宿主病模型中发现,移植后肾脏组织出现多个BV家族的多克隆的T细胞增生,未出现引起GVHD的单克隆或寡克隆的T细胞增生[5]。肾脏是否为GVHD的靶器官,仍有争议。HSCT后患者肾活检关于肾小球、肾小管、肾周毛细血管CD3+T细胞浸润的报道比较多见[6]。本组5例肾活检患儿中,3例光镜下可见肾间质明显淋巴细胞浸润,5例免疫荧光均可见阳性荧光沉积于小血管壁及系膜区,其机制考虑与cGVHD有一定的相关性。
许多报道认为应用钙调磷酸酶抑制剂(calcineurininhibitors,CNI)如环孢素A(cyclosporin A,CsA)是导致AKI的主要因素[7]。CsA可升高血管收缩因子,降低血管舒张因子,造成肾小球入球动脉的收缩,从而导致肾功能和肾小管的急性损伤,这种血管收缩与CsA剂量呈依赖性,一般发生在血CsA浓度高峰后的2周左右[8]。故定期检测血CsA浓度,及时调整剂量,可缓解AKI的发生及进展。除了免疫抑制剂类,一些预防感染的药物如氟康唑、万古霉素、磺胺类药物等也可致肾功能不全。
肾脏病理包括肾小球、肾小管以及肾血管等。肾小球病变包括膜性病变、微小病变、FSGS以及IgA肾病等,主要表现为:肾小球膜溶解,膜基质扩大,毛细血管增宽,内皮损伤脱落,纤维蛋白沉积,其发生多认为与cGVHD相关[9,10],主要以T细胞为中心所介导的体液免疫紊乱,包括炎症因子的释放以及B细胞过度活化[11],但具体机制尚未明确。HSCT后GVHD相关的肾性病变多以肾小球改变为主,单独的肾小管病变报道不多,如肾小管间质性肾炎[12]。HSCT后典型的肾血管病变有TA-TMA,其病理学主要表现为微血管内皮细胞损伤,激活局部凝血系统导致微血栓形成和纤维素沉积。许多报道发现TA-TMA与aGVHD明显相关。免疫抑制剂如CsA、FK506等可以通过增加血栓素A2的合成和减少前列腺素(PGI2)生成促进内皮组织促凝血改变[13]。此外,移植类型的差异,高剂量的放化疗,感染,HOVD等均为TA-TMA的风险因素[14]。本研究中2例肾活检光镜下可见小血管壁增厚、管腔闭塞、血管腔内微血栓形成,符合上述描述特点。
HSCT后肾性损伤予糖皮质激素联合MMF、FK506以及利尿、降压等对症治疗后,可恢复,但长期随访多复发。其疗效与肾脏病理、原发疾病复发、造血干细胞再输注及药物应用相关。许多报道血浆置换治疗TA-TMA效果较差[15],调整免疫抑制剂及联合糖皮质激素对TA-TMA有一定的疗效。预后与病情轻重有关,有神经系统并发症、使用CsA 或FK506、移植后120天内即出现TMA者预后较差[16]。关于cGVHD相关的NS,有报道认为:若为微小病变,以糖皮质激素治疗为主;若为膜性肾病,在糖皮质激素的基础上,联合MMF、FK506等能获得良好的临床疗效[17]。本研究5例肾活检患儿中,4例肌酐以及肾小球滤过率均恢复正常。但长期随访,1例因原发疾病复发、干细胞再输注合并肾衰竭死亡,其余3例进入CKD1~2期;1例合并肾脏TMA进入慢性透析,为慢性终末期肾脏病(ESRD),预后较差。
肾后性损伤主要包括出血性膀胱炎(hemorrhagic cystitis,HC)和尿路感染。HSCT后HC的发病率高达7%~68%[18]。一般把移植后4周内发生的HC定义为急性HC,多认为与血小板减少及药物毒性[19]有关;移植后4周以后发生的HC定义为迟发型HC,多认为与病毒感染[20]和GVHD[21]有关。儿童HSCT发生HC的高危因素有:移植年龄>6岁、伴有CMV感染、aGVHD阳性[22]。关于HSCT后尿路感染的报道不多,由于大剂量的放化疗、粒细胞缺乏、免疫重建耗时、应用免疫抑制剂等导致免疫功能低下,容易感染。本研究中尿路感染的发生率为16%,8例行尿病原学检查:屎肠球菌(4)、大肠埃希菌(1)及BK病毒(3)。
HCST后泌尿系损伤可分为肾前性、肾性及肾后性3个方面,其发病机制可能与GVHD、肾毒性药物的干预以及移植后并发症等相关。肾活检可明确病理,对于病因分析、指导治疗和判断预后有着重要意义。在积极的对症、对因治疗后可恢复,但长期随访,肾性损伤多发展为CKD。
[1] Grubb A, Nyman U, Bjork J, et al. Simple cystatin C-based prediction equations for glomerular fi ltration rate compared with the modification of diet in renal disease prediction equation for adults and the Schwartz and the Counahan-Barratt prediction equations for children [J]. Clin Chem, 2005, 51(8): 1420-1431.
[2] Li JM, Giver CR, Lu Y, et al. Separating graft-versusleukemia from graft-versus-host disease in allogeneic hematopoietic stem cell transplantation [J]. Immunotherapy, 2009, 1(4): 599-621.
[3] Coppell JA, Richardson PG, Soiffer R, et al. Hepatic venoocclusive disease following stem cell transplantation:incidence, clinical course, and outcome [J]. Biol Blood Marrow Transplant, 2010, 16(2): 157-168.
[4] 杜振兰, 陈鹏, 罗荣牡, 等. 儿童造血干细胞移植相关毛细血管渗漏综合征3例分析并文献复习[J]. 国际儿科学杂志, 2014,41(4): 450-454.
[5] 符粤文, 吴德沛, 陈峰, 等. 单倍型骨髓移植小鼠移植物抗宿主病模型的建立及移植物抗宿主病靶器官T细胞受体克隆检测[J]. 郑州大学学报(医学版), 2009, 44(6):1171-1175.
[6] Mii A, Shimizu A, Kaneko T, et al. Renal thrombotic microangiopathy associated with chronic graft-versushost disease after allogeneic hematopoietic stem cell transplantation [J]. Pathol Int, 2011, 61(9): 518-527.
[7] 包宇实, 解汝娟, 王玫, 等. 急性白血病患者异基因造血干细胞移植后急性肾损伤的临床分析[J]. 中华器官移植杂志, 2010, 31(10): 618-620.
[8] Issa N, Kukla A, Ibrahim HN. Calcineurin inhibitor nephrotoxicity: a review and perspective of the evidence [J]. Am J Nephrol, 2013, 37(6): 602-612.
[9] Hingorani S. Chronic kidney disease in long-term survivors of hematopoietic cell transplantation: epidemiology, pathogenesis, and treatment [J]. J Am Soc Nephrol, 2006, 17(7): 1995-2005.
[10] Brukamp K, Doyle AM, Bloom RD, et al. Nephrotic syndrome after hematopoietic cell transplantation: do glomerular lesions represent renal graft-versus-host disease? [J]. Clin J Am Soc Nephrol, 2006, 1(4): 685-694.
[11] 陈瑶, 黄晓军, 张晓辉, 等. 异基因造血干细胞移植后并发肾病综合征的单中心临床分析[J]. 中华内科杂志, 2011, 50(7):572-575.
[12] 侯丽君, 徐景勃, 何志国, 等. 异基因造血干细胞移植后肾脏慢性移植物抗宿主病的特征[J]. 中国组织工程研究与临床康复, 2007, 11(33): 6688-6689.
[13] Daly AS, Xenocostas A, Lipton JH. Transplantationassociated thrombotic microangiopathy: twenty-two years later [J]. Bone Marrow Transplant, 2002, 30(11): 709-715.
[14] 韩悦, 吴德沛, 阮长耿. 造血干细胞移植相关的血栓性微血管病研究进展[J]. 中华血液学杂志, 2007, 28(8): 574-576.
[15] 赵新菊, 连立超, 韦洮, 等. 血浆置换治疗不同病因血栓性微血管病的效果观察[J]. 中国血液净化, 2014, 13(2):85-89.
[16] Qu L, Kiss JE. Thrombotic microangiopathy in transplantation and malignancy [J]. Semin Thromb Hemost, 2005, 31(6): 691-699.
[17] 肖毅, 张义成, 张东华, 等. 异基因造血干细胞移植后慢性移植物抗宿主病相关性肾病综合征[J]. 中国血液流变学杂志, 2007, 17(1): 58-60.
[18] Miodosky M, Abdul-Hai A, Tsirigotis P, et al. Treatment of post-hematopoietic stem cell transplantation hemorrhagic cystitis with intravesicular sodium hyaluronate [J]. Bone Marrow Transplant, 2006, 38(7): 507-511.
[19] Yaghobi R, Ramzi M, Dehghani S. The role of different risk factors in clinical presentation of hemorrhagic cystitis in hematopoietic stem cell transplant recipients [J]. Transplant Proc, 2009, 41(7): 2900-2902.
[20] Mischitelli M, Fioriti D, Anzivino E, et al. Viral infection in bone marrow transplants: is JC virus involved? [J]. J Med Virol, 2010, 82(1): 138-145.
[21] 刘蓓, 吴晓雄,王志红, 等. 造血干细胞移植后出血性膀胱炎的相关因素分析[J]. 中华损伤与修复杂志(电子版), 2010, 5(3): 326-331.
[22] 徐宏贵, 方建培, 黄绍良, 等. 小儿造血干细胞移植后出血性膀胱炎的临床特征与危险因素分析[J]. 中国实用儿科杂志, 2005, 20(11): 659-662.
Clinical analysis of 81 children with urinary system injury after hematopoietic stem cell transplantation
CHEN
Ruyue, TANG Hanyun, CHEN Qing, FENG Yajun, SHEN Yunyan, XU Qinying, ZHU Yun, ZHU Xueming, LI Xiaozhong
(Department of Nephrology Rheumatology and Immunology,Children’s Hosptial of Soochow University,Suzhou 215000, Jiangsu,China)
ObjectivesTo investigate the etiology, renal pathology, treatment, and prognosis of children’s urinary system injury after hematopoietic stem cell transplantation (HSCT).MethodsClinical data of 81 children with urinary dysfunction after HSCT admitted to the Hematology Department in Children’s Hospital of Soochow University were analyzed, and relevant literatures were reviewed.ResultsIn 81 cases (50 males and 31 females), the age ranges from 8 months to 17 years old. Thirty cases (37%) with prerenal injury were recovered after active rehydration and other symptom speci fi c treatment. There were 9 (11.1%) children with renal injury, four cases were given up therapy or transferred to other hospitals, thus lead to an unknown prognosis. Kidney biopsy was performed in the remaining fi ve cases for pathological investigation. After active symptom-spei fi c and etiology-based treatment, serum creatinine and glomerular fi ltration rate of four cases return to normal. But in the long-term follow-up,one case died of recurrence of primary disease, reinfusion of hematopoietic stem cell combined with renal failure. The remaining 3 patients were with chronic kidney disease (CKD). One case with renal thrombotic microangiopathy was in the chronic dialysis. Postrenal renal injuries were mainly hemorrhagic cystitis (28.4%) and urinary tract infection (16%). After a large dose of rehydration, urine alkalization and anti-infection therapy, they were recovered in the short term with a good prognosis.ConclusionsUrinary injury after HSCT is mainly divided into three categories: prerenal, renal and postrenal, in which renal injury is prone to frequent recurrence.
hematopoietic stem cell transplantation; graft-versus-host disease; nephrotoxic drugs; transplantassociated thrombotic microangiopathy; child
10.3969/j.issn.1000-3606.2017.05.006
2016-10-17)
(本文编辑:邹 强)
国家自然科学基金资助项目(No. 81370787);江苏省临床医学科技专项(No. SBL2014030237)
李晓忠 电子信箱:xiaozhonglicn@yeah.net
