日本结缕草滞绿基因ZjSGR对烟草的转化及功能分析
2017-05-23檀鹏辉袁丽丽樊波于安东董笛滕珂晁跃辉
檀鹏辉,袁丽丽,樊波,于安东,董笛,滕珂*,晁跃辉*
(1.北京林业大学草坪研究所,北京 100083; 2.深圳市国艺园林建设有限公司,广东 深圳 518038)
日本结缕草滞绿基因ZjSGR对烟草的转化及功能分析
檀鹏辉1,袁丽丽2,樊波2,于安东1,董笛1,滕珂1*,晁跃辉1*
(1.北京林业大学草坪研究所,北京 100083; 2.深圳市国艺园林建设有限公司,广东 深圳 518038)
SGR基因是植物体内调控叶绿素降解的关键基因之一,在调控植物衰老以及响应非生物胁迫等方面也发挥着重要的作用。 本研究利用 DNA 重组技术,构建 35S::ZjSGR:YFP植物表达载体,并通过农杆菌介导的方法成功转化烟草。PCR 和 qRT-PCR 结果显示日本结缕草滞绿基因ZjSGR已整合到烟草基因组中,并能够在转基因烟草中高效表达。在正常生长环境下,转基因烟草表现出黄化的表型。与对照相比叶绿素含量较低,光合速率下降。亚细胞定位实验证明ZjSGR定位在叶绿体,透射电镜观察结果表明过表达ZjSGR基因使叶绿体发育异常,且有加速降解的趋势。qRT-PCR结果发现转ZjSGR基因的烟草中SAG113,SAG12,NCED和AAO3的表达量明显高于野生型,衰老进程明显加快。本研究证明ZjSGR可在调控叶绿素降解和衰老的进程中发挥重要作用。
日本结缕草;滞绿基因;转基因烟草;叶绿素;衰老
植物由成熟到衰老的过程中,发生的最显著的一个变化是叶绿素降解,叶片变黄。因为草坪草的坪观质量很大程度上决定了其市场定价,因此衰老一直是草地植物研究的重点方向之一[1]。研究表明,滞绿蛋白(STAY-GREEN)的调控是一种不同于PAO(脱镁叶绿酸a加氧酶)途径的重要方式,可调节叶绿体中的多个生化反应,在植物叶绿素降解和衰老过程中发挥着重要作用[2]。随着滞绿突变体的发现,滞绿基因的功能及调控机理在水稻(Oryzasativa)[3]、拟南芥(Arabidopsisthaliana)[4]、苜蓿(Medicagotruncatula)[1]和番茄(Solanumlycopersicum)[5]等模式植物和作物中得以深入开展。拟南芥nye1-1滞绿突变体与野生型相比表现出绿期延长的表型,而过表达拟南芥AtNYE引起叶片黄化,加速衰老[4];苜蓿sgr滞绿突变体与对照相比在黑暗处理后可保持更长的绿期,并且衰老程度较低[1];SlSGR1可直接与SlPSY1基因互作调控番茄红素合成,而RNA干扰SlSGR1延缓番茄果实成熟,使番茄储存寿命延长[5]。然而,目前为止对日本结缕草滞绿基因的认识只有北京林业大学草坪研究所前期在拟南芥中做的初步探索[6],其在调控叶绿素降解和衰老中的确切功能尚未明确,有必要进一步利用转基因的方法进行深入研究。
结缕草(Zoysiajaponica)是我国草坪草的瑰宝,具有抗性强和养护费用低等优点,非常适用于高尔夫球场、足球场、城市园林绿化等[7]。但结缕草的绿期较短,直接影响到其使用价值,极大地制约了在我国北方地区的大面积推广应用[7-8]。结缕草育种的一个主要目标就是培育绿期长、品质好的品种,除传统育种的方法之外,基因工程育种技术的不断发展为这一目标的实现提供了可能。本研究在前期研究的基础上克隆了日本结缕草ZjSGR基因,构建植物表达载体并利用农杆菌介导的方法成功转化了烟草。对转基因烟草的表型特征、生理指标和相关基因的表达模式进行了分析,为研究该基因在调控叶绿素降解和衰老方面的作用提供了理论依据。
1 材料与方法
1.1 实验材料
本试验于2014年7月—2016年9月在北京林业大学草坪研究所进行,试验中所用日本结缕草品种‘Zenith’的种子购自美国Hancock公司,烟草(Nicotianatabacum)野生型品种由本实验室保存。DNA、RNA提取试剂盒购自OMEGA公司。反转录试剂盒、限制性内切酶、T4连接酶和SYBR Mix购自TaKaRa公司。大肠杆菌感受态DH5α和T1克隆载体购自北京全式金公司,PCR Mix购于康为世纪公司。农杆菌LBA4404以及3302Y载体为本实验室保存,其他试剂采用进口分装或国产分析纯。
1.2ZjSGR植物表达载体的构建
根据ZjSGR基因序列(KP148819),设计一对带酶切位点的引物ZjSGR-F(5′-cctCCATGGATGGCTGCGGCCATTTCGGC-3′)和ZjSGR-R(5′-cctACTAGTCTGCTGCGTCTGGCCAG-3′)(划横线部分分别为限制性内切酶NcoⅠ和SpeⅠ酶切位点)扩增基因完整编码区。利用NcoⅠ和SpeⅠ对3302Y载体和上一步获得的PCR产物进行双酶切,纯化之后利用T4连接酶连接,并转化大肠杆菌。对测序正确的菌液提取质粒并保存。利用冻融法将构建好的质粒转化农杆菌LBA4404,挑取阳性菌落测序并保存备用。
1.3 烟草的转化及筛选
通过农杆菌介导,采用叶盘法将3302Y-ZjSGR整合到烟草基因组。对生长1个月的烟草打取叶圆片进行侵染,侵染后的叶片共培养3 d后转移到生芽培养基上培养,促使其生芽,每2个星期换板。待其芽长至1 cm左右,将芽割下并转移到生根培养基上培养,促使其生根。待到根系发育到适宜程度,将其移栽于盆中,25 ℃、16 h光照、8 h黑暗条件下培养。本研究所采用的共培养基、分化培养基和生根培养基配方分别如下:MS+0.2 mg/L NAA+2.0 mg/L 6-BA+6 g/L Agar、MS+0.2 mg/L NAA+2.0 mg/L 6-BA+300 mg/L Cef+3 mg/L Basta+6 g/L Agar、1/2 MS+0.2 mg/L NAA+300 mg/L Cef+3 mg/L Basta+6 g/L Agar。
1.4 再生植株检测
采用CTAB法提取基因组DNA,以3302Y通用引物(3302Y-F:5′-TGACGCACAATCCCACTATCCTT-3′;3302Y-R: 5′-CCGTCCAGCTCGACCAGGAT-3′)进行基因组PCR鉴定;利用Trizol法[6,9]提取总RNA,用反转录试剂盒反转录获得第一链cDNA。然后以cDNA为模板,qSGR-F和qSGR-R为引物(qSGR-F: 5′-CGTCCACTGCCACATCTCCG-3′;qSGR-R: 5′-CGAACGCCTTCAGCACCACA-3′),进行qRT-PCR鉴定,筛选T1代转基因烟草中外源ZjSGR表达量较高的株系用于后续试验。利用单拷贝的烟草内源核糖核酸还原酶基因(RNR2)为内参设计引物(RNR2-F:5′-TACCCGTCACTGGGAAAC-3′;RNR2-R:5′-GGAAGCCGTAGAAAGCAC-3′),以转基因烟草基因组DNA为模板进行荧光定量分析,确定其拷贝数[10]。
1.5 转基因植株形态、亚细胞定位及叶绿体超微结构观察
以野生型烟草为对照,T3代转基因烟草植株正常生长3个月后进行拍照。撕取转基因烟草叶片表皮细胞,在Leica SP5激光共聚焦显微镜下观察ZjSGR的亚细胞定位情况。取相同生长时期和部位的野生型烟草和转基因烟草叶片,切成1 mm2小块后先经2.5%的戊二醛和1%四氧化锇固定,利用酒精逐级脱水处理后进行包埋,然后用包埋块做超薄切片,最后用Hitachi HT7700透射电镜观察叶绿体超微结构。
1.6 转基因植株生理指标及基因表达量测定
采用丙酮法提取叶绿素,利用Li-Cor 6400光合仪测定净光合速率(Pn)、气孔导度(Cd)、胞间二氧化碳浓度(Ci)和蒸腾速率(Tr)。提取RNA,反转录成cDNA后以烟草Actin基因为内参,利用实时荧光定量,按照ΔΔCt的方法[11]测定ZjSGR、NtSAG113、NtSAG12、NtNCED和NtAAO3的相对表达量。所用引物分别为SAG113-F:5′-GGTGCGAACTTCAGACTCCA-3′,SAG113-R:5′-ATTCATCTGGTCGATCCGGC-3′;SAG12-F:5′-CCTATCAAGGACCAAAAGGAATG-3′,SAG12-R:5′-TCACAGTCTACAAGTTCTTGCTCTG-3′;NCED3-F:5′-AGCTTTGGGTCGTCCTGTTT-3′,NCED3-R:5′-AAACCAGCGTTTGCAACTCC-3′;AAO3-F:5′-AGTGCCCCGAGTATGTAGGT-3′,AAO3-R:5′-TCAGTCTTTCGGTTGACGCA-3′;NtACT-F:5′-AGGTTACGCCCTTCCTCAT-3′,NtACT-R:5′-GGACAATTTCCCGTTCAGC-3′。
2 结果与分析
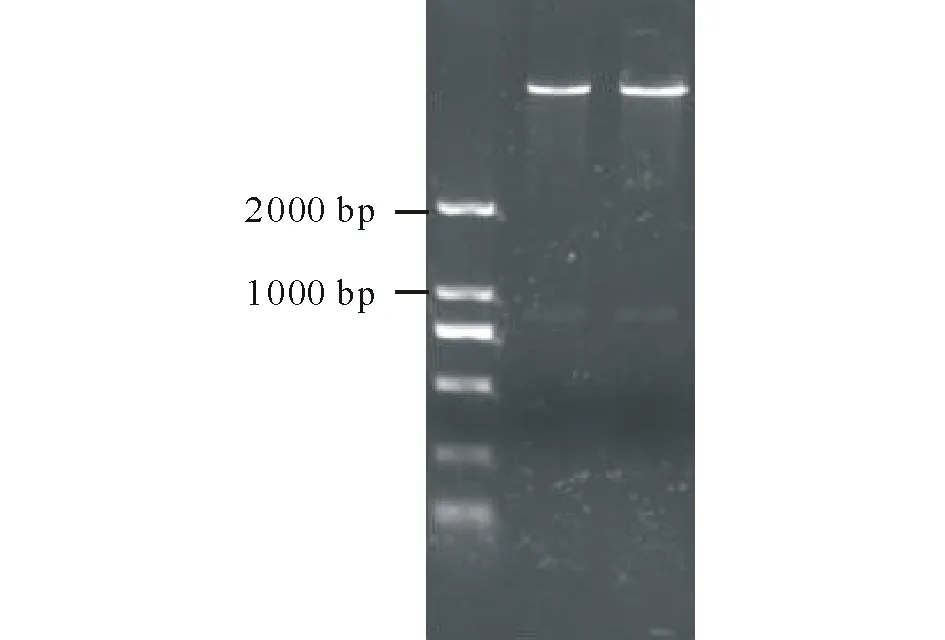
图1 35S::ZjSGR:YFP酶切鉴定Fig.1 35S::ZjSGR:YFP digested with enzymes
2.1 植物表达载体 35S::ZjSGR:YFP的构建
以ZjSGR-F和ZjSGR-R为引物,扩增ZjSGR的完整ORF,经电泳检测后可见一条900 bp的片段,符合预期大小,纯化回收。利用NcoⅠ和SpeⅠ分别对纯化后的3302Y载体和PCR扩增产物进行双酶切,酶切后的产物纯化回收后利用T4连接酶16 ℃过夜连接。连接产物转化DH5α感受态细胞,过夜培养后挑取单菌落进行菌体PCR验证。对可以扩增出目的片段的菌体提取质粒送测序公司测序,并用NcoⅠ和SpeⅠ对重组子双酶切。经1%的琼脂糖凝胶电泳分析,从35S::ZjSGR:YFP酶切获得一条大约900 bp的片段,与预期大小相符(图1)。测序结果显示无突变,证明构建的载体可用于后续的转基因实验。大量提取质粒,转化农杆菌LBA4404。
2.2 转基因烟草鉴定及筛选
通过农杆菌介导的烟草叶盘转化法,将经草铵膦筛选后能正常生芽(图2A)、生根(图2B)的幼苗移植到培养基质中培养生长(图2C)。提取烟草基因组DNA,用3302Y载体通用引物进行PCR验证,电泳结果显示获得11棵转基因阳性植株(图3)。提取总RNA,反转录后用qSGR-F/R进行qRT-PCR验证,结果显示ZjSGR在不同株系中均有不同程度的表达,且在OE3和OE6中表达量最高(图4)。以基因组DNA为模板,qRT-PCR结果表明,OE3和OE6均为单拷贝株系,因此选取这两个株系用于后续实验。

图2 抗性烟草筛选Fig.2 Selection of resistant N. tabacum A:生芽培养 Shoot induction; B: 生根培养 Root induction; C: 移栽 Transplantation in soil.

图3 转基因烟草PCR鉴定Fig.3 Validation of transgenic N. tabacum CK-:阴性对照Negative control; CK+:阳性对照Positive control; 1-11: 转基因植株Transgenic tobacco.
2.3 转基因烟草表型观察及指标测定
2.3.1 过表达ZjSGR加速烟草叶绿素降解 在相同的生长条件下,OE3和OE6两个转基因株系与野生型相比叶片呈现出明显黄化的现象(图5)。为研究过表达ZjSGR基因对烟草叶绿素的影响,测定了叶片叶绿素含量,结果显示野生型烟草的叶绿素含量明显高于转基因烟草(图6)。
2.3.2 ZjSGR定位于叶绿体 利用转基因烟草,在激光共聚焦显微镜下观察了ZjSGR蛋白的亚细胞定位情况。在激光共聚焦显微镜下,叶绿体由于自发荧光的存在而呈红色球状;35S::ZjSGR:YFP呈黄色球状颗粒,在融合场下能与叶绿体重合,结果表明ZjSGR定位于叶绿体(图7)。

图4 转基因烟草qRT-PCR鉴定Fig.4 qRT-PCR analysis of transgenic N. tabacum OE:转基因烟草 Transgenic tobacco. 下同 The same below.

图5 转基因烟草表型观察Fig.5 Phenotype observation of transgenic N. tabacum WT:野生型烟草Wild type. 下同 The same below.
2.3.3 过表达ZjSGR使叶绿体结构发育异常 为研究ZjSGR的过表达是否会引起叶绿体结构的变化,本研究利用透射电镜(TEM)进行了叶绿体超微结构的观察。透射电镜观察表明,野生型的叶绿体环绕在细胞内表面且结构比较稳定,有明显的淀粉颗粒,叶绿体基粒片层堆叠紧密、颜色较深。然而,转基因烟草的叶绿体结构异常,有泡状化的趋势。淀粉颗粒不明显,叶绿体基粒数目和堆叠层数较少。透射电镜结果表明,过表达ZjSGR基因使烟草叶片叶绿体发育异常,结构稳定性遭到破坏(图8)。
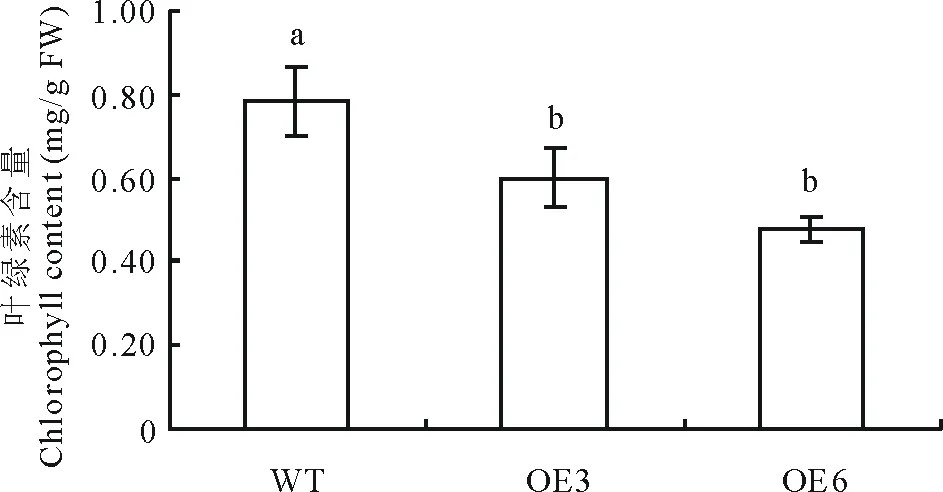
图6 转基因烟草叶绿素测定Fig.6 Determination of chlorophyll contents in transgenic N. tabacum 图中不同字母表示差异显著(P≤0.05),下同。Different letters represent significant difference (P≤0.05). The same below.
2.3.4 过表达ZjSGR降低烟草光合效率 经Li-Cor 6400测定,转基因烟草的净光合速率明显低于野生型,OE3和OE6分别约为WT的63.77%和61.93%(图9)。转基因烟草的气孔导度明显高于WT,OE3和OE6分别是WT的3.73和2.83倍。OE3和OE6转基因烟草的胞间二氧化碳浓度分别是WT的3.54和3.19倍;蒸腾速率分别是WT的4.56和2.63倍。
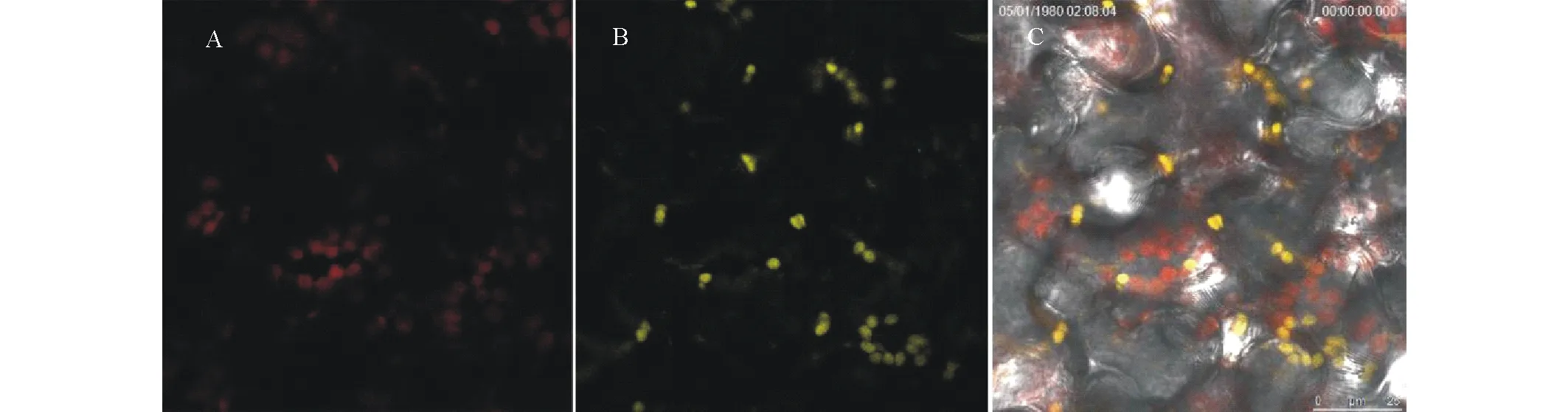
图7 ZjSGR亚细胞定位Fig.7 Subcellular localization of ZjSGR A: 叶绿体自发荧光 Chloroplast autofluorescence; B: 激发光下 35S::ZjSGR:YFP 的荧光 Ultraviolet field; C: 融合场 Merged.

图 8 转基因烟草叶绿体结构Fig.8 TEM analysis of the ultrastructure of chloroplasts

图9 转基因烟草光合指标测定Fig.9 Determination of photosynthesis system in ZjSGR-overexpressing N. tabacum
2.3.5 过表达ZjSGR促进烟草衰老 为研究ZjSGR对转基因烟草衰老程度的影响,本研究利用实时荧光定量技术分析了SAG113、SAG12、NCED和AAO3的相对表达情况。结果表明,转基因烟草的这些基因表达量均明显高于WT(图10)。其中,OE3和OE6中SAG113的表达量分别是WT的8.88和24.8倍;SAG12的表达量为WT的11.68和23.64倍;NCED为WT的7.21和29.73倍;AAO3为WT的1.58和1.42倍。

图10 转基因烟草相关衰老基因的表达量分析Fig.10 Determination of senescence associated genes in ZjSGR-overexpressing N. tabacum
3 讨论
目前为止,有关滞绿基因的研究多集中在模式植物和农作物,这些滞绿基因的发现加深了对叶绿素降解途径的认识和理解[1,12]。本研究中的日本结缕草滞绿基因ZjSGR编码区长831 bp,编码276个氨基酸残基,属于STAY-GREEN超家族。前人的研究表明,SGR基因在调控叶绿素降解和加速植物衰老进程中行使重要的功能,但结缕草SGR基因的功能有待进一步确定。
本研究利用DNA重组技术构建了ZjSGR的植物表达载体,并成功转化了烟草。对转基因烟草的形态及生理生化指标进行了测定,在相同的生长环境下转基因烟草与对照相比叶片表现出明显的黄化现象。叶绿素测定结果证明了过表达ZjSGR基因可加速叶绿素的降解,这与拟南芥[4]、水稻[3]和苜蓿[1]中SGR的研究一致。亚细胞定位观察结果表明ZjSGR定位于叶绿体,与预测结果一致,且与拟南芥和水稻中滞绿基因的亚细胞定位情况一致[3-4]。透射电镜观察结果表明过表达ZjSGR破坏了叶绿体结构的稳定性,这与过表达水稻SGR促进了本生烟草叶绿体结构分解的研究结果一致[3]。
叶绿体是植物进行光合作用的场所,并且是植物叶片中蛋白质最富集的细胞器,叶绿体结构的降解会对下游反应产生十分重要的影响[13]。经光合仪测定,转基因烟草的净光合速率明显低于野生型,表明过表达ZjSGR基因抑制了烟草的光合速率。Zhou等[1]利用RNA干扰技术抑制苜蓿SGR基因的表达,从而使得苜蓿光合速率提高,本研究的结果与此一致。转基因烟草的胞间二氧化碳浓度明显高于野生型,说明转基因烟草的光化学和生理生化反应也受到了抑制,这可能与叶绿体结构遭到破坏以及组分发生降解有关[14]。此外,转基因烟草的气孔导度和蒸腾速率明显高于野生型,说明过表达ZjSGR基因可提高植物的气孔导度和蒸腾速率,其中的机理还需进一步的研究。
SAG113在衰老组织中高度表达,并可受到内源ABA的诱导,表明SAG113在促进植物衰老过程中可发挥重要的作用[15]。过表达SAG113可促进拟南芥衰老,并提高叶片失水速度[15]。SAG12仅在衰老叶片中表达,是一个植物衰老的标记基因,其启动子常用来构建驱动ipt基因的表达载体来调控植物衰老[16-17]。NCED是控制ABA合成的一个关键基因,而AAO3控制ABA合成的最后一步,在调控植物衰老过程中行使重要的功能[18-19]。本研究发现,与野生型相比转ZjSGR基因的烟草中SAG113,SAG12,NCED和AAO3的表达量明显升高,说明ZjSGR促进了转基因烟草的衰老进程。
4 结论
本研究成功构建了植物表达载体35S::ZjSGR:YFP,利用农杆菌介导的方法成功转化了烟草。qRT-PCR结果表明,ZjSGR可在烟草中异源表达,并且转基因烟草叶绿素加速降解,光合作用受到明显抑制。亚细胞定位结果显示ZjSGR定位于叶绿体,透射电镜观察实验进一步证明过表达ZjSGR可促进叶绿体结构降解。过表达ZjSGR提高了SAG113,SAG12,NCED和AAO3的表达量,加速了转基因烟草的衰老进程。本研究证明ZjSGR可加速叶绿素降解,促进植物衰老,是调控叶绿素降解和植物衰老进程的一个重要功能基因。
References:
[1] Zhou C, Han L, Pislariu C,etal. From model to crop: functional analysis of a STAY-GREEN gene in the model legumeMedicagotruncatulaand effective use of the gene for alfalfa improvement. Plant Physiology, 2011, 157(3): 1483-1496.
[2] Christ B, Hörtensteiner S. Mechanism and significance of chlorophyll breakdown. Journal of Plant Growth Regulation, 2014, 33(1): 4-20.
[3] Park S, Yu J, Park J,etal. The senescence-induced staygreen protein regulates chlorophyll degradation. The Plant Cell Online, 2007, 19(5): 1649-1664.
[4] Ren G, An K, Liao Y,etal. Identification of a novel chloroplast protein AtNYE1 regulating chlorophyll degradation during leaf senescence inArabidopsis. Plant Physiology, 2007, 144(3): 1429-1441.
[5] Luo Z, Zhang J, Li J,etal. A STAY-GREEN protein SlSGR1 regulates lycopene and β-carotene accumulation by interacting directly with SlPSY1 during ripening processes in tomato. New Physiologist, 2013, 198(2): 442-452.
[6] Teng K, Chang Z H, Li X,etal. Functional and RNA-sequencing analysis revealed expression of a novel stay-green gene fromZoysiajaponica(ZjSGR) caused chlorophyll degradation and accelerated senescence inArabidopsis. Frontiers in Plant Science, 2016, (7): 1894.
[7] Zhang L, Teng K, Xiao G Z,etal. Transformation ofZjADHgene intoArabidopsisthalianaand cold-tolerance analysis of transgenic plants. Acta Prataculturae Sinica, 2016, 25(11): 43-49. 张兰, 滕珂, 肖国增, 等. 日本结缕草ZjADH基因对拟南芥的转化及其耐寒性分析. 草业学报, 2016, 25(11): 43-49.
[8] Zhang Y B, Sun X B, Fan B,etal. Cloning and expression ofZjNACfromZoysiajaponica. Acta Prataculturae Sinica, 2016, 25(4): 239-245. 张胤冰, 孙鑫博, 樊波, 等. 结缕草ZjNAC基因的克隆与表达分析. 草业学报, 2016, 25(4): 239-245.
[9] Teng K, Tan P H, Xiao G Z,etal. Heterologous expression of a novelZoysiajaponicasalt-induced glycine-rich RNA-binding protein gene,ZjGRP, caused salt sensitivity inArabidopsis. Plant Cell Reports, 2017, 36(1): 179-191.
[10] Wang S, Xie Z X, Xie L J,etal. Detection method of exogenous gene in transgenic tobacco by real-time fluorescence quantitative PCR. Journal of Southern Agriculture, 2015, 46(5): 745-749. 王盛, 谢芝勋, 谢丽基, 等. 转基因烟草中外源基因实时荧光定量PCR检测方法的建立. 南方农业学报, 2015, 46(5): 745-749.
[11] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod. Methods, 2001, 25(4): 402-408.
[12] Ren G, Zhou Q, Wu S,etal. Reverse genetic identification of CRN1 and its distinctive role in chlorophyll degradation inArabidopsis. Journal of Integrative Plant Biology, 2010, 52(5): 496-504.
[13] Jibran R, Sullivan K L, Crowhurst R,etal. Staying green postharvest: How three mutations in theArabidopsischlorophyll b reductase geneNYC1 delay degreening by distinct mechanisms. Journal of Experimental Botany, 2015, 66(21): 6849-6862.
[14] Guo D P, Guo Y P, Zhao J P,etal. Photosynthetic rate and chlorophyll fluorescence in leaves of stem mustard (Brassicajunceavar. tsatsai) after turnip mosaic virus infection. Plant Science, 2004, 168(1): 57-63.
[15] Zhang K, Xia X, Zhang Y,etal. An ABA-regulated and Golgi-localized protein phosphatase controls water loss during leaf senescence inArabidopsis. Plant Journal, 2012, 69(4): 667-678.
[16] Gan S, Amasino R M. Inhibition of leaf senescence by autoregulated production of cytokinin. Science, 1996, 270(5244): 1986-1988.
[17] Xu Y, Tian J, Gianfagna T,etal. Effects of SAG12-ipt expression on cytokinin production, growth and senescence of creeping bentgrass (AgrostisstoloniferaL.) under heat stress. Plant Growth Regulation, 2009, 57(3): 281-291.
[18] Zhang M, Leng P, Zhang G,etal. Cloning and functional analysis of 9-cis-epoxycarotenoid dioxygenase (NCED) genes encoding a key enzyme during abscisic acid biosynthesis from peach and grape fruits. Journal of Plant Physiology, 2009, 166(12): 1241-1252.
[19] Seo M, Koshiba T. TheArabidopsisaldehyde oxidase 3 (AAO3) gene product catalyzes the final step in abscisic acid biosynthesis in leaves. Proceedings of the National Academy of Sciences, 2000, 97(23): 12908-12913.
Functional analysis of the stay-green geneZjSGRfromZoysiajaponicausing transgenicNicotianatabacum
TAN Peng-Hui1, YUAN Li-Li2, FAN Bo2, YU An-Dong1, DONG Di1, TENG Ke1*, CHAO Yue-Hui1*
1.InstituteofTurfgrassScience,BeijingForestryUniversity,Beijing100083,China; 2.ShenzhenGuoyiParkDevelopmentsCO.,LTD,Shenzhen518038,China
In green plants,SGRis a key gene with roles in chlorophyll degradation, plant development, senescence, and responses to abiotic stresses. In this study, the coding domain sequence ofZjSGRfromZoysiajaponicawas inserted into the 3302Y vector, yielding the plant expression vector 35S::ZjSGR:YFP, by DNA recombination technology. The construct was introduced into tobacco plants byAgrobacteriumtumefaciens-mediated transformation. The transgenic plants were confirmed to harbor the construct by PCR, and qRT-PCR analyses confirmed thatZjSGRwas successfully heterologously expressed in the transgenic tobacco plants. The transgenic plants showed a rapid yellowing phenotype corresponding to a lower chlorophyll content and lower photosynthetic rate. Subcellular localization analyses showed that ZjSGR was localized in the chloroplasts in stably transformed tobacco plants. Transmission electron microscope analyses revealed that the chloroplasts in transgenic plants showed retarded development and decomposition processes. Analyses of gene transcript levels by qRT-PCR showed that the transcript levels ofSAG113,SAG12,NECD, andAAO3 were higher inZjSGR-overexpressing tobacco plants than in control plants. The results of this study highlight the important roles ofZjSGRin controlling chlorophyll degradation and senescence in plants.
Zoysiajaponica; stay green gene; transgenicNicotianatabacum; chlorophyll; senescence
10.11686/cyxb2016492
http://cyxb.lzu.edu.cn
2016-12-26;改回日期:2017-02-10
深圳市科技计划项目(JCYJ20160331151245672,JSGG20160229155434792)资助。
檀鹏辉(1993-),女,河北邢台人,在读硕士。E-mail:penghuitan@bjfu.edu.cn*通信作者Corresponding author. E-mail: tengke@bjfu.edu.cn,chaoyuehui@163.com
檀鹏辉, 袁丽丽, 樊波, 于安东, 董笛, 滕珂, 晁跃辉. 日本结缕草滞绿基因ZjSGR对烟草的转化及功能分析. 草业学报, 2017, 26(5): 155-162.
TAN Peng-Hui, YUAN Li-Li, FAN Bo, YU An-Dong, DONG Di, TENG Ke, CHAO Yue-Hui. Functional analysis of the stay-green geneZjSGRfromZoysiajaponicausing transgenicNicotianatabacum. Acta Prataculturae Sinica, 2017, 26(5): 155-162.
