花椰菜2种雄性不育系花器特征及花药发育的细胞学研究
2017-05-23陶兴林谢志军朱惠霞刘明霞张金文胡立敏
陶兴林,谢志军,朱惠霞,刘明霞,张金文,胡立敏
(1.甘肃农业大学甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070;2.甘肃省农业科学院蔬菜研究所,甘肃 兰州 730070;3.农业部园艺作物生物学与种质创制西北地区科学观测实验站,甘肃 兰州 730070)
花椰菜2种雄性不育系花器特征及花药发育的细胞学研究
陶兴林1,2,3,谢志军2,3,朱惠霞2,3,刘明霞2,3,张金文1*,胡立敏2,3
(1.甘肃农业大学甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070;2.甘肃省农业科学院蔬菜研究所,甘肃 兰州 730070;3.农业部园艺作物生物学与种质创制西北地区科学观测实验站,甘肃 兰州 730070)
本试验以花椰菜细胞质雄性不育系09-R9、保持系09-24和温敏细胞核雄性不育系GS-19为试验材料,采用形态学和细胞学方法研究2种雄性不育系的形态特征和花药发育的细胞学特点。结果表明,2种雄性不育系在育性转换、花器形态特征及花药发育的细胞学特征都存在着差异。不同温度处理的09-R9、09-24和GS-19之间的育性转换存在差异。09-R9和09-24的育性不受温度影响,09-R9表现为不育,09-24完全可育;GS-19的育性受温度影响,高温(20 ℃)不育,低温(15 ℃)育性恢复。GS-19和09-R9花蕾和花药大小差异显著,GS-19花蕾和花药显著小于09-R9;不育株与其可育株花的差异达到显著水平,不育株花显著小于可育株。显微结构观察发现2种雄性不育系之间的花药败育时期和方式不同,09-R9花药早期可以形成外形正常的花粉囊,但囊内物质随着花蕾的发育逐渐解体,最终这种不正常的花粉囊全部解体消失,花药发育受阻于花粉母细胞形成之前,属于无花粉囊败育类型。GS-19的花药发育过程有花粉母细胞的分化,能形成正常花粉囊,不产生花粉粒或者产生微量的无生活力的花粉粒,花药发育受阻于花粉母细胞到四分体时期,属于花粉母细胞败育类型。超微结构观察发现,不育系09-R9和高温条件下不育系GS-19花药败育相似,发生在花粉母细胞减数分裂时期,没有四分体的形成,形成了花粉粒外壁发育异常的“拟小孢子”,最后“拟小孢子”逐渐降解,只剩下花粉空壳。说明2种雄性不育系的败育方式有差异,但是败育时期一致,花药发育均受阻于四分体形成之前。
花椰菜;雄性不育系;花器特征;花药发育;细胞学
我国大部分农村正处于由传统农耕模式向“种草养畜”模式的转型时期,存在饲料来源严重缺乏等问题,冬季青饲料的缺乏更是严重制约了畜牧业的发展。因此,如能把花椰菜(Brassicaoleraceavar.botrytis)菜叶作为越冬青饲料加以开发,既可以实现花椰菜的综合利用,又有助于畜牧业的发展。花椰菜是一种非常重要的十字花科蔬菜作物,被公认为是最有营养的作物之一,特别是钙、抗氧化剂、维生素A、维生素K、胡萝卜素、核黄素及铁的含量很丰富[1-4]。此外,花椰菜菜叶具有良好的适口性,其干物质中粗蛋白、粗纤维、粗脂肪、粗灰分以及无氮浸出物的含量分别为19.95%,6.53%,3.53%,13.37%及57.01%,具有良好的饲料开发价值。我国分布地区广,品种类型丰富,具有非常明显的杂种优势,是杂种优势利用潜力很大的一类作物,而雄性不育途径是培育花椰菜新品种的主要途径之一。2005年,课题组从花椰菜种质资源圃里发现了几株温度敏感的不育株,后经多代自交选育成育性稳定的温敏核不育系GS-19[5],属高温不育类型。此外,通过回交转育的方法,对引进的细胞质雄性不育材料经过7代以上的转育和选择,获得了花椰菜细胞质雄性不育系09-R9,并对其花药败育进行了初步研究[6]。目前,这两种雄性不育系已经在生产中进行了应用[7-8],但导致花药败育的确切时期还不清楚。
作物的雄性不育类型较多,许多学者对其败育时期和方式进行了大量研究,发现不同作物或者同一作物不同的雄性不育系之间也有差异。对水稻(Oryzasativa)[9-10]、小麦(Triticumaestivum)[11]、油菜(Brassicacampestris)[12-14]、玉米(Zeamays)[15]、茄子(Solanummelongena)[16]、辣椒(Capsicumannuum)[17]、甘蓝(Brassicaoleracea)[18]等作物的雄性不育系细胞学研究较多。明确不同类型花椰菜雄性不育系形态特征、败育时期与细胞学特征,在花椰菜雄性不育系的研究和利用过程中具有重要意义。因此,本试验以饲菜兼用型花椰菜细胞质雄性不育系09-R9和温敏核雄性不育系GS-19为试验材料,用形态学和细胞学方法研究了花椰菜2种雄性不育系09-R9和GS-19的花器形态及花药败育过程,确定其败育类型和特点,为花椰菜雄性不育系进一步研究和应用奠定基础,促使花椰菜两系法杂交育种工作向更深层次推进。
1 材料与方法
1.1 试验材料及处理
本试验选取的饲菜兼用型花椰菜细胞质雄性不育系09-R9、保持系09-24,温敏核雄性不育系GS-19均是甘肃省农业科学院蔬菜研究所选育和提供。其中细胞质雄性不育系09-R9育性稳定,不产生花粉粒,育性变化不受环境条件影响,09-24是09-R9的保持系。温敏核雄性不育系GS-19的育性表现与温度有关,温度高于18 ℃表现为不育,温度低于16 ℃时表现为完全可育。
1.2 育性转换观察
2014年3月花盆直播细胞质雄性不育系09-R9、保持系09-24、温敏核雄性不育系GS-19,每个材料播20盆。显球后分别移入20 ℃(16 h光照/8 h黑暗)和15 ℃(16 h光照/8 h黑暗)的人工智能气候箱中,开花期观察统计育性情况,可育率为可育花朵占每株随机抽取100朵花的百分数,每株重复3次,取10盆的平均值。
1.3 花器特征观察
在09-R9、09-24及GS-19的盛花期分别采摘不育株与可育株开花前3~4 d的花蕾和当天完全开放的花各10朵,用游标卡尺测量花蕾、花冠、花丝及花药等花器各部分大小,进行比较分析。
1.4 花药发育的显微结构观察研究
花药发育过程的观察采用常规石蜡切片技术。在盛花期,取可育(对照)和不育株不同大小花蕾(0.5,1,3,5和7 mm)迅速投入卡诺氏(Carnoy’s)液中固定24 h,然后转到70%酒精4 ℃保存。制作石蜡切片时,依次使用50%, 70%, 85%, 95%, 100%各级乙醇液脱水各15 min;用二甲苯透明2次,每次30 min。浸蜡和石蜡包埋后,用Leica旋转式切片机切片,切片厚度4~5 μm。贴片后将载玻片投入二甲苯中脱蜡(3 min),苏木精染色后投入二甲苯中3 min至透明,加拿大树胶封藏。制好的石蜡切片在OLYMPUS BX53显微镜下观察并照相。
1.5 花药发育的超微结构观察研究
在盛花期,取GS-19不育和可育株不同发育时期的花药,在4 ℃冰箱中用体积分数为2%戊二醛固定2 h,磷酸盐缓冲溶液(phosphate buffered saline,简称PBS)洗3次,每次10 min;再浸泡于体积分数为1%饿酸溶液中,4 ℃下2 h左右;用体积分数为10%,20%,30%,40%,50%,60%,70%,80%,90%,100%的系列乙醇各脱水10 min,用Epon818树脂包埋,超薄切片,醋酸铀和柠檬酸铅双染色,制好的透射电镜标本在透射电镜(EM100C JEOL Tokyo)下观察。
“为美好生活加油”是中国石化的企业使命,中国石化青工委也积极践行绿色低碳战略,广泛传播绿色环保理念,倡导绿色生活方式,组织动员青年开展“光盘行动”、植绿护绿、绿色出行、垃圾分类等环保实践,大力开展以绿色生产为主题的“青年文明号”“青年绿色生产示范岗”创建活动,提升青年环保意识和环保技能,助力绿色企业创建。
1.6 数据处理
试验结果为3次重复的平均值,使用 Excel 2010 软件整理统计试验数据、计算标准偏差并绘制图表,用 SPSS 18.0 软件进行方差分析和多重差异显著性分析。
2 结果与分析
2.1 2种花椰菜雄性不育系的育性转换

图1 不同温度处理雄性不育系的育性分析Fig.1 Fertility analysis of male sterile line in different temperature 不同字母表示差异显著(P<0.05),下同。The different letters mean significant difference at P<0.05.The same below.
由图1可以看出,2个温度处理后的细胞质雄性不育系09-R9和温敏核雄性不育系GS-19之间的育性变化存在差异。细胞质不育系09-R9和保持系09-24的育性不受温度影响,09-R9可育率为0,始终保持完全不育,其保持系09-24可育率为100%,育性完全正常。温敏核雄性不育系GS-19在2个温度条件下可育率发生了显著的变化,在15 ℃条件下,可育率为100%, 20 ℃可育率为0,完全不育,说明育性转换受温度控制。
2.2 2种花椰菜雄性不育系的花器形态差异分析
由图2和图3可以看出, 2种花椰菜雄性不育系的花蕾和花药大小之间差异显著,温敏核不育系GS-19不育株的花蕾和花药显著小于细胞质不育系09-R9,花冠大小和花柱长短无显著差异,但是与其可育株之间差异显著,花器显著小于可育株。2种雄性不育系的不育株和可育株的花蕾大小、花冠开度及花药大小都有明显的差异,不育株花的各个组成部分明显小于可育株。GS-19的花为白色,15 ℃条件下,开花前花蕾正常大小,开花后明显看到柱头和雄蕊,产生大量花粉;20 ℃条件下,开花前花蕾小于可育时期花蕾,开花后只能看到柱头,看不到雄蕊,剥开花瓣后,发现雄蕊萎缩于雌蕊基部,花药干瘪,不能形成花粉。09-R9 的花为黄色,育性表现与温度没有关系,完全不育,开花前花蕾小于可育时期花蕾,开花后只能看到柱头,看不到雄蕊,剥开花瓣后,发现雄蕊萎缩于雌蕊基部,花药干瘪,不能形成花粉粒;而保持系09-24正好相反,育性同样不受温度影响,育性完全正常,花的各部分组成完全正常。
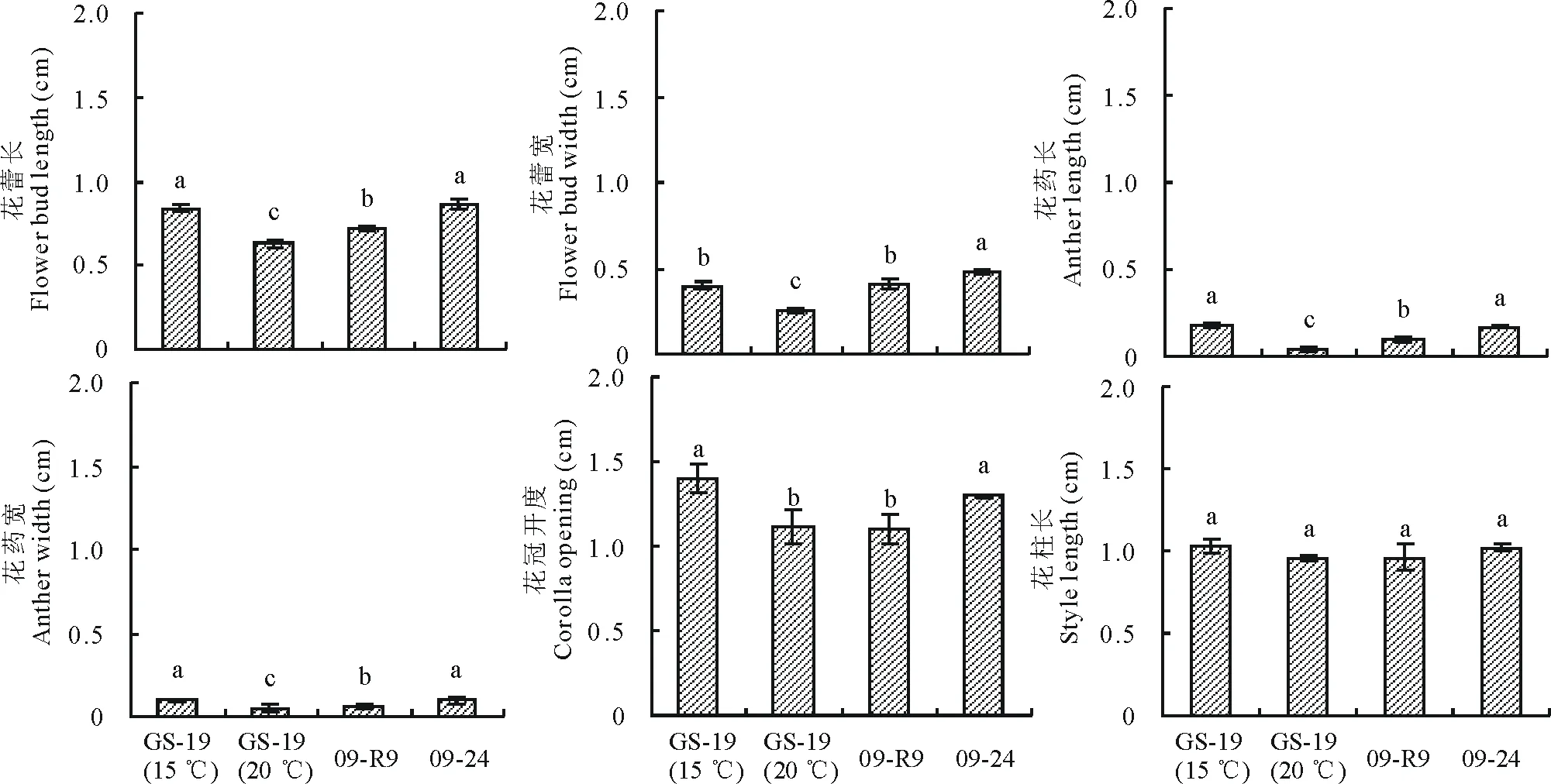
图2 花椰菜雄性不育花和花蕾的比较Fig.2 Flowers compare of male sterile line in cauliflower
2.3 花药发育的显微结构观察
2.3.1 保持系09-24花药的发育过程 保持系09-24花药发育早期(花蕾大小为0.5 mm),花药的4个角隅处分化和形成细胞质浓厚,体积大的造孢细胞,花药的横切面呈四棱型。当花蕾长约 1.0 mm 时,花药的角隅处分化形成清晰的药室,绒毡层细胞的细胞质浓厚,颜色明显深于药室内壁和中层,造孢细胞分裂形成花粉母细胞,花粉母细胞进行减数分裂,形成四分体,被绒毡层包围,此时花药横切面呈蝴蝶形(图4A),随着绒毡层细胞开始解体向内收缩,四分体孢子从中释放出来,刚分离出来的小孢子外形不规则,但很快变成圆形或近圆形,成为单核花粉粒 (图4B)。在即将成熟花药中,单核花粉粒进行核分裂,形成成熟花粉粒,花粉粒呈圆形,且染色很深(图4C)。

图3 花椰菜雄性不育系的花器形态比较Fig.3 Flowers of the male sterile line in cauliflower 上Top:花蕾Flower bud;中Middle:花Flower;下Bottom:雄蕊Stamen.

图4 保持系09-24的花药发育显微结构Fig.4 Micrographs of anther development of the 09-24 A:四分体时期的花药(75×) Anther of tetrad (75×);B:单核花粉粒期花药(150×) Anther of mononuclear pollen (150×);C:花粉粒成熟期花药(600×) Anther of mature pollen (600×).
2.3.3 温敏核雄性不育系GS-19花药发育特性 在低温下(15 ℃),GS-19花药发育完全正常,发育早期呈四棱形,由孢原细胞经过平周分裂形成造孢细胞和生周缘细胞。当花蕾长约 1.0 mm 时,花药进一步分化出4个药室,药室的壁层已分化完全,药室内的细胞染色均匀。花粉母细胞能进行正常减数分裂,形成大量的四分体,且四分体的细胞质浓,染色深(图6A)。四分体孢子从中释放出来,刚分离出来的小孢子外形不规则,但很快变成圆形或近圆形,成为单核花粉粒,在此发育过程中,绒毡层细胞逐渐向内收缩 (图6B),在即将成熟花药中,绒毡层逐步解体,细胞体积逐渐增大,进行核分裂,形成成熟花粉粒,花粉粒呈圆形,且染色很深(图6C)。
在高温(20 ℃)条件下,GS-19花药发育受阻,完全不育。花药发育早期,和低温条件下一样,分裂能力较强的胞原细胞经过分裂形成正常的造孢细胞,该时期的雄蕊也呈四棱形。造孢细胞进一步分化出4个药室,药室的壁层已分化完全,药室内的细胞染色较浅,药室形状不规则。花粉母细胞虽然也能进行正常减数分裂,形成四分体,但是四分体的细胞质不浓,染色浅(图7A)。染色较浅的四分体为圆形或近圆形,只有个别能形成单核花粉粒,在此发育过程中,绒毡层细胞逐渐向内收缩 (图7B)。形成的少量单核花粉粒不能进一步发育形成成熟花粉粒,绒毡层未解体,只留下一个空的花粉囊,花粉囊壁出现加厚的现象(图7C)。
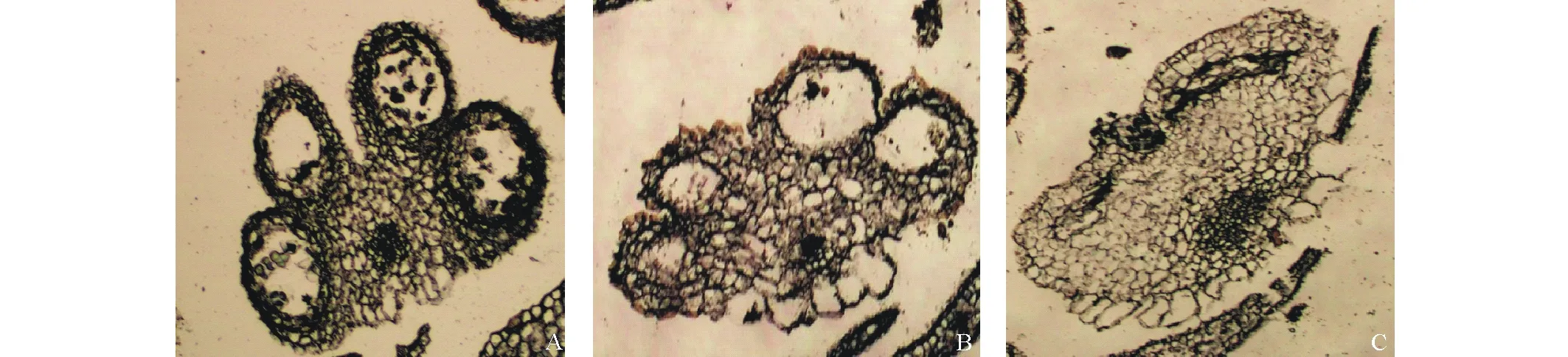
图5 花椰菜细胞质雄性不育系09-R9的花药发育显微结构Fig.5 Micrographs of anther development of the 09-R9 A:四分体时期的花药(75×) Anther of tetrad (75×); B:单核花粉粒期花药(150×) Anther of mononuclear pollen (150×);C:花粉粒成熟期花药(600×) Anther of mature pollen (600×).

图6 低温条件下GS-19的花药发育显微结构Fig.6 Micrographs of anther development of the GS-19 in low temperature (15 ℃) A:四分体时期的花药(75×) Anther of tetrad (75×);B:单核花粉粒期花药(150×) Anther of mononuclear pollen (150×);C:花粉粒成熟期花药(600×) Anther of mature pollen (600×).

图7 高温条件下GS-19不育株的花药发育显微结构Fig.7 Micrographs of anther development of the GS-19 in high temperature (20 ℃) A:四分体时期的花药(75×) Anther of tetrad (75×);B:单核花粉粒期花药(150×) Anther of mononuclear pollen (150×); C:花粉粒成熟期花药(600×) Anther of mature pollen (600×).
2.4 花药发育的超微结构观察
2.4.1 保持系09-24花药的发育过程 保持系09-24花药发育的初期,造孢细胞呈多边形,核大质体多,从外围形成液泡,并有胼胝质壁包裹,绒毡层发达,部分细胞有双核仁,无壁由膜包裹,呈分泌细胞状态,内含物分解后呈点状分布在膜上,再从膜上逐渐释放出供孢子发育(图8A)。到四分体时期,四分孢子被共同的胼胝质包围,壁外侧出现了一层有缺口的电子致密带,其上沉积了大量的黑色箭状物质。四分孢子中细胞器含量丰富,质体高度发育,绒毡层胞质进一步浓缩成一团,着色很深 (图8B),四分体孢子分裂形成正常的单核花粉粒。小孢子发育后期,中央大液泡逐渐变小至消失,细胞内含物逐渐增多至布满整个细胞,小孢子经过不对称有丝分裂形成成熟花粉粒,花粉粒细胞的内壁物质在局部向内侧扩展并显著增厚,绒毡层细胞消失,成熟花粉粒呈圆形(图8C)。

图8 09-24的花药发育超微结构Fig.8 Ultrastructure of anther development of the 09-24 A:花粉母细胞形成期Pollen mother cell formation;B:单核花粉粒期Mononuclear pollen;C:花粉粒成熟期Mature pollen;Ep:外表皮Epidermis;En:药室内壁Endothecium;MMC:花粉母细胞Pollen mother cell;T:绒毡层Tapetum;Msp:小孢子Microspore;PG:成熟花粉粒Mature pollen grain.
2.4.2 细胞质雄性不育系09-R9花药败育的细胞学观察 细胞质雄性不育系09-R9花药发育初期和保持系09-24一致,造孢细胞呈多边形,核大质体多,从外围形成液泡,并有胼胝质壁包裹,绒毡层发达,部分细胞有双核仁,无壁由膜包裹,呈分泌细胞状态,内含物分解呈点状分布在膜上,再从膜上逐渐释放出供孢子发育(图9A)。随着花药的发育,四分孢子形成后也被共同的胼胝质包围,壁外侧也见有一层带缺口的电子致密带,但其上沉积了大量茸毛状物质。四分孢子分裂形成的单核花粉粒中细胞器较可育少,但液泡明显比可育多(图9B)。花粉粒形成过程中,小孢子细胞愈发皱缩,内含物消失,不能形成正常的花粉粒(图9C)。

图9 09-R9的花药发育超微结构Fig.9 Ultrastructure of anther development of the 09-R9 A:花粉母细胞形成期Pollen mother cell formation;B:单核花粉粒期Mononuclear pollen;C:花粉粒成熟期Mature pollen;Ep:外表皮Epidermis;En:药室内壁Endothecium;MMC:花粉母细胞Pollen mother cell;T:绒毡层Tapetum;Msp:小孢子Microspore;PG:成熟花粉粒Mature pollen grain.
2.4.3 温敏核雄性不育系GS-19花药发育特性 在低温条件下(15 ℃),GS-19花药发育完全正常。花药发育初期,雄蕊原基分化为4层,从外到内依次是表皮、药室内壁、中层和绒毡层。绒毡层细胞呈长方形,排列整齐,核大,核仁染色明显,有的细胞含有两个或多个核。花粉母细胞的形态与周围的药壁细胞明显不同,细胞排列整齐而有序,细胞壁形状规则,细胞核大,核仁染色明显,没有明显的液泡(图10A)。随着小孢子发育,四分孢子被共同的胼胝质包围,外侧出现了一层有缺口的电子致密带,其上沉积了大量的黑色箭状物质。四分孢子分裂形成单核花粉粒,单核花粉粒中细胞器含量丰富,染色深,质体内部明显可见一些电子密度较高的物质,绒毡层胞质进一步浓缩成一团,着色很深,出现个别“空腔”现象(图10B)。小孢子进一步发育,中央大液泡逐渐变小至消失,细胞内含物逐渐增多至布满整个细胞,小孢子经过不对称有丝分裂形成成熟花粉粒,花粉粒细胞的内壁物质在局部向内侧扩展并显著增厚,萌发孔形成,绒毡层细胞愈加降解至基本消失,花粉粒呈圆形(图10C)。
在高温(20 ℃)条件下,GS-19花药发育受阻,完全不育。花药发育早期,和低温条件下一样,雄蕊原基已分化出4层,从外到内依次是表皮、药室内壁、中层和绒毡层。绒毡层细胞呈长方形,排列整齐,核大,核仁染色明显。花粉母细胞的形态与周围的药壁细胞明显不同,细胞排列整齐而有序,细胞壁形状规则,细胞核大,核仁染色明显,没有明显的液泡(图11A)。随着花药的进一步发育,四分体孢子形成后也被共同的胼胝质包围,壁外侧也见有一层带缺口的电子致密带,但其上沉积了大量茸毛状物质。四分孢子分裂形成单核花粉粒,单核花粉粒中细胞器较可育少,但液泡明显比可育多,可见液泡吞噬现象,绒毡层未解体(图11B)。开花前,绒毡层完全解体,形成的花粉粒内含物消失,只剩下壁外侧有一层带缺口的电子致密带,不能形成正常的花粉粒(图11C)。

图10 低温条件下GS-19的花药发育超微结构Fig.10 Ultrastructure of anther development of the GS-19 in low temperature (15 ℃) A:花粉母细胞形成期Pollen mother cell formation;B:单核花粉粒期Mononuclear pollen;C:花粉粒成熟期Mature pollen;Ep:外表皮Epidermis;En:药室内壁Endothecium;MMC:花粉母细胞Pollen mother cell;T:绒毡层Tapetum;Msp:小孢子Microspore;PG:成熟花粉粒Mature pollen grain.

图11 高温条件下GS-19花药发育超微结构Fig.11 Ultrastructure of anther development of the GS-19 in high temperature (20 ℃) A:花粉母细胞形成期Pollen mother cell formation;B:单核花粉粒期Mononuclear pollen;C:花粉粒成熟期Mature pollen;Ep:外表皮Epidermis;En:药室内壁Endothecium;MMC:花粉母细胞Pollen mother cell;T:绒毡层Tapetum;Msp:小孢子Microspore;PG:成熟花粉粒Mature pollen grain.
3 讨论
本研究发现花椰菜细胞质雄性不育系09-R9的育性不受温度的影响,始终都保持不育的特性;而温敏核雄性不育系GS-19的育性受温度控制,高温(20 ℃)条件下表现为不育,低温(15 ℃)条件下育性恢复。这一结果与甘蓝型油菜温敏核不育系SP2S[13]和TE5A[14]、细胞质雄性不育系392A[12]的育性转换结果一致,都表现为高温不育、低温育性恢复。但油菜温敏核雄性不育系Hui you50S的育性转换研究结果表现出低温不育、高温可育的现象[19]。为进一步对温敏核雄性不育系GS-19利用,在制种过程中要注意温度条件,避免影响种子的纯度。
花器形态特征是雄性不育和可育区别的直接表型,研究表明雄性不育的花明显小于可育株,不育花器形态有花冠退化型、雄蕊萎缩型、花粉败育型3种[20-21]。本研究发现,细胞质雄性不育系09-R9和高温下温敏核不育系GS-19的花显著小于保持系09-24和低温下温敏核不育系GS-19,尤其是花的发育后期,2种不育株的雄蕊萎缩于雌蕊基部,柱头外露,花期看不到雄蕊,花药干瘪,不能形成花粉,属于前人研究中的雄蕊萎缩型。童旭宏等[22]观察了陆地棉(Gossypiumhirsutum)的G22A,H109A和1793A三个不育系均表现花瓣小,花丝短,柱头明显外露,败育彻底,无花粉;张体德等[23]发现芝麻(Sesamumindicum)细胞核雄性不育系ms86-1的花器也是不育株小于可育株,本研究结果与此完全相同。
随着花椰菜不同雄性不育系的发现,花药发育的细胞学研究也显得非常重要。目前,雄性不育败育研究主要集中在油菜、小麦、水稻等大田作物中,主要有无花粉囊型、花粉母细胞败育型和单核败育型3种。本研究发现,在花蕾发育早期(≤1 mm)时,育性正常的保持系09-24和低温条件下的温敏核雄性不育系GS-19处于孢原时期和造孢时期,能分化形成造孢细胞和壁细胞,该时期细胞质雄性不育系09-R9和高温条件下的GS-19的花药发育也正常。随着花蕾的继续发育(>1 mm),细胞质雄性不育系09-R9在花粉母细胞早期,细胞质开始浓缩解体,大部分不能进行减数分裂,只能形成少量染色较浅的四分体,花粉囊也逐步解体,无花粉粒形成,属于无花粉囊败育类型,已经研究发现的典型无花粉囊型油菜不育系有533S[24]、宜3A[25]、212A[26]、Shaan-GMS[27]、9012[28]、BnaC.Tic40[29]、BnMs3[30]等。高温条件下温敏核雄性不育系GS-19的花粉母细胞虽然也能进行正常减数分裂,形成四分体,但是四分体的细胞质不浓,染色浅,只有个别能形成单核花粉粒,属于花粉母细胞败育类型,与温敏核不育系小麦 BNS[11]和BNS366[31]、甘蓝 Ogura CMS[32]的败育类型一致,此外,在水稻[30]、小麦[33]、高粱(Sorghumbicolor)[34]、大豆(Glycinemax)[35]、红菜薹(Brassicacompestrisvar.purpurea)[36]等农作物的雄性不育系也是因为减数分裂过程出现问题,导致花粉母细胞不能形成四分体,本试验结果与此一致。也存在一些其他的温敏核雄性不育水稻、小麦、甘蓝型油菜的花药发育的败育类型属于单核败育型[9,19,37],也进一步证实了余凤群等[38]关于细胞核雄性不育系属花粉母细胞败育型的结论。
我国虽然是世界上花椰菜种植面积最大的国家,但对花椰菜的利用仅限于食用花球,导致大量茎叶均被抛弃,造成了严重的资源浪费和环境污染。因此,本研究通过对菜饲兼用型花椰菜温敏核雄性不育系的研究,培育出花球性状优良,叶片生长势强的花椰菜新品种,既保障了我国高原夏菜产业健康发展,又可以推动畜牧业的发展,实现了花椰菜综合利用,对我国大部分农村正处于由传统农耕模式向“种草养畜”模式的转型过程中存在饲料来源严重缺乏等问题解决具有重要的研究意义。
References:
[1] Kumar P, Srivastava D K. Biotechnological advancement in genetic improvement of broccoli (BrassicaoleraceaL. var.italica), an important vegetable crop. Biotechnology Letters, 2016, 38: 1049-1063.
[2] Vallejo F, Garcia-viguera C, Tomas-barberan F A. Changes in broccoli (Brassicaoleraceavar.italica) health-promoting compounds with inflorescence development. Journal of Agricultural and Food Chemistry, 2003, 51: 3776-3782.
[3] Abdel-wahhab M A, Aly S E. Antioxidants and radical scavenging properties of vegetable extracts in rats fed aflatoxin-contaminated diet. Journal of Agricultural and Food Chemistry, 2003, 51: 2409-2414.
[4] Li J, Jia H Y, Xie J M,etal. Effects of partial substitution of mineral fertilizer by bio-fertilizer on yield, quality, photosynthesis and fertilizer utilization rate in broccoli. Acta Prataculturae Sinica, 2015, 24(1): 47-55. 李杰, 贾豪语, 颉建明, 等. 生物肥部分替代化肥对花椰菜产量、品质、光合特性及肥料利用率的影响. 草业学报, 2015, 24(1): 47-55.
[5] Tao X L, Hu L M, Hou D,etal. Breeding of the cauliflower thermo-sensitive male sterile line GS-19.Bulletin of Agricultural Science and Technology, 2010, (11): 59-60. 陶兴林, 胡立敏, 侯栋, 等. 花椰菜温敏雄性不育系GS-19的选育. 农业科技通讯, 2010, (11): 59-60.
[6] Zhu H X, Tao X L, Hu L M. Studies on cytology of cytoplasmic male sterility of cauliflowers (Brassicaoleraceavar.botrytisL.). China Vegetables, 2011, (18): 64-67. 朱惠霞, 陶兴林, 胡立敏. 花椰菜细胞质雄性不育系的细胞学研究. 中国蔬菜, 2011, (18): 64-67.
[7] Hu L M, Tao X L, Zhu H X,etal. A new cauliflower F1 hybrid ‘Shenxue No. 3’. China Vegetables, 2015, (1): 55-56. 胡立敏, 陶兴林, 朱惠霞, 等. 花椰菜新品种‘圣雪3 号’的选育. 中国蔬菜, 2015, (1): 55-56.
[8] Hu L M, Tao X L, Zhu H X,etal. A new cauliflower cultivar ‘Shengxue 4’. Acta Horticulturae Sinica, 2015, 42(5): 1007-1008. 胡立敏, 陶兴林, 朱惠霞, 等. 花椰菜新品种‘圣雪 4 号’. 园艺学报, 2015, 42(5): 1007-1008.
[9] Shi Y, Zhao S, Yao J. Premature tapetum degeneration: a major cause of abortive pollen development in photo-period sensitive genic male sterility in rice. Journal of Integrative Plant Biology, 2009, 51(8): 774-781.
[10] Zhou H, Liu Q, Li J,etal. Photoperiod- and thermo-sensitive genic male sterility in rice are caused by a point mutation in a novel non-coding RNA that produces a small RNA. Cell Research, 2012, 22(4): 649-660.
[11] Li D X, Deng X L, Li G,etal. Observation in fertile and sterile anthers of a thermo-sensitive genic male-sterile wheat (TriticumastivumL). Chinese Journal of Cell Biology, 2012, 34(9): 880-885. 李东霄, 邓小莉, 李淦, 等. 温敏核不育小麦可育花药和败育花药发育观察. 中国细胞生物学学报, 2012, 34(9): 880-885.
[12] Nie M J, Wang G H, Zhu W P. Cytology research on the anther abortion of three male sterility lines in rapeseed (BrassicanapusL.). Scientia Agricultura Sinica, 2007, 40(7): 1543-1549. 聂明建, 王国槐, 朱卫平. 甘蓝型油菜 3 种类型雄性不育系花药败育的细胞学研究.中国农业科学, 2007, 40(7): 1543-1549.
[13] Yu C, Guo Y, Ge J,etal. Characterization of a new temperature-sensitive male sterile line SP2S in rapeseed (BrassicanapusL.). Euphytica, 2015, 206(2): 473-485.
[14] Li K Q, Zeng X H, Yuan R,etal. Cytological researches on the anther development of a thermo- sensitive genic male sterile line TE5A inBrassicanapus. Scientia Agricultura Sinica, 2016, 49(12): 2408-2417. 李可琪, 曾新华, 袁荣, 等. 甘蓝型油菜温敏细胞核雄性不育系 TE5A花药发育的细胞学研究. 中国农业科学, 2016, 49(12): 2408-2417.
[15] Timofejeva L S, Kibbe D S, Lee S,etal. Cytological characterization and allelism testing of anther developmental mutants identified in a screen of maize male sterile lines. G3 (Bethesda), 2013, 3(2): 231-249.
[16] Chen X P, Luo S X, Xuan S X,etal. Cytological observation of pollen abortion in eggplant male-sterile lines. Journal of Plant Genetic Resources, 2013, 14(4): 754-758. 陈雪平, 罗双霞, 轩淑欣, 等. 茄子雄性不育系花粉败育的细胞学观察.植物遗传资源学报, 2013, 14(4): 754-758.
[17] He C Z, Liu Z M, Xiong X Y,etal. Cytologic observations on anther development of 9704A a cytoplasmic male sterile lin inCapsicumannumL. Acta Horticulturae Sinica, 2008, 35(4): 521-528. 何长征, 刘志敏, 熊兴耀, 等. 辣椒细胞质雄性不育系9704A花药发育的细胞观察. 园艺学报, 2008, 35(4): 521-528.
[18] Wang T T, Cai X F, Zhang J H,etal. The culture and early male sterile identification of distant hybrid embryos derived fromBrassicaoleraceavar.capitataL. and male sterile line inB.juncea. Acta Horticulturae Sinica, 2010, 37(10): 1661-1666. 王涛涛, 蔡晓峰, 张俊红, 等. 芥菜型油菜雄性不育系与甘蓝远缘杂交胚培养及早代育性鉴定. 园艺学报, 2010, 37(10): 1661-1666.
[19] Ge J, Guo Y F, Yu C Y,etal. Cytological observation of anther development of photoperiod/thermo sensitive male sterile line Huiyou50S inBrassicanapusL. Acta Agronomica Sinica, 2012, 38(3): 541-548. 葛娟, 郭英芬, 于澄宇, 等. 甘蓝型油菜光、温敏雄性不育系Huiyou50S花粉败育的细胞学观察. 作物学报, 2012, 38(3): 541-548.
[20] Nivison H T, Hanson M R. Identification of a mitochondrial protein associated with cytoplasmic male sterility in petunia. Plant Cell, 1989, 1(11): 1121-1130.
[21] Zhou C J, Zhang Y L. Studies on several properties of radish male-sterility. Acta Horticulturae Sinica, 1994, 21(1): 13-16. 周长久, 张友良. 萝卜雄性不育的几种特性研究. 园艺学报, 1994, 21(1): 13-16.
[22] Tong X H, Qin L, Kong G C,etal. Studies on the morphological and anatomic characters of a novel CMS inGossypiumhirsutumL. Cotton Science, 2009, 21(2): 83-88. 童旭宏, 秦利, 孔广超, 等. 新型陆地棉细胞质雄性不育系花器形态学和细胞学观察.棉花学报, 2009, 21(2): 83-88.
[23] Zhang T D, Zhang H Y, Zheng Y Z,etal. The cytological observation on the morphology of the flowers and the microspore development in sesame nuclear male-sterile lines ‘ms86-1’. Chinese Agricultural Science Bulletin, 2010, 26(23): 64-68. 张体德, 张海洋, 郑永战, 等. 芝麻细胞核雄性不育系ms86-1的花器形态及小孢子发育的细胞学观察.中国农学通报, 2010, 26(23): 64-68.
[24] Dong J G, Dong Z S, Liu X X,etal. Cytological studies on anther development of ecological male sterile line 533S inBrassicanapusL. Journal of Northeast SCI-TECH University of Agriculture and Forestry: Natural Science Edition, 2004, 32(7): 61-66. 董军刚, 董振生, 刘绚霞, 等. 甘蓝型油菜生态雄性不育系533S花药发育的细胞学研究. 西北农林科技大学学报: 自然科学版, 2004, 32(7): 61-66.
[25] Yang G S, Qu B, Fu T D. Anatomical studies on the anther’s development of the dominant genic male sterile line YI-3A inBrassicanapusL. Journal of Huazhong Agricultural University, 1999, 18(6): 520-523. 杨光圣, 瞿波, 傅廷栋. 三个甘蓝型油菜隐性细胞核雄性不育系小孢子发生的细胞学研究. 华中农业大学学报, 1999, 18(6): 520-523.
[26] Liu Y, Dong Z S, Zhang G W,etal. Cytological study on growth of anther of CMS 212A inBrassicanapusL. Acta Agriculturae Boreali-occidentalis Sinica, 2005, 14(1): 33-37. 刘燕, 董振生, 张改文, 等. 甘蓝型油菜 CMS 212A 花药发育的细胞学研究.西北农业学报, 2005, 14(1): 33-37.
[27] Xiao Z D, Xin X Y, Chen H Y,etal. Cytological investigation of anther development in DGMS line Shaan-GMS inBrassicanapusL. Czech Journal of Genetics and Plant Breeding, 2013, 49: 16-23.
[28] Wan L L, Xia X Y, Hong D F,etal. Abnormal vacuolization of the tapetum during the tetrad stage is associated with male sterility in the recessive genic male sterileBrassicanapusL. line 9012A. Journal of Plant Biology, 2010, 53: 121-133.
[29] Dun X L, Zhou Z F, Xia S Q,etal. Bna C.Tic40, a plastid inner membrane translocon originating fromBrassicaoleracea, is essential for tapetal function and microspore development inBrassicanapus. The Plant Journal, 2011, 68: 532-545.
[30] Zhou Z F, Dun X L, Xia S Q,etal. BnMs3 is required for tapetal differentiation and degradation, microspore separation, and pollen wall biosynthesis inBrassicanapus. Journal of Experimental Botany, 2012, 63: 2041-2058.
[31] He X M, Zhou M L, Yu C Q,etal. Cytological observation on pollen male fertility abortion of thermo-sensitive male sterile wheat line BNS366. Journal of Triticeae Crops, 2014, 34(4): 460-466. 贺晓敏, 周美兰, 余传启, 等. 温敏雄性不育小麦BNS366花粉败育的细胞学观察. 麦类作物学报, 2014, 34(4): 460-466.
[32] Ma Y, Kang J G, Wu J,etal. Identification of tapetum-specific genes by comparing global gene expression of four different male sterile lines inBrassicaoleracea. Plant Molecular Biology, 2015, 87(6): 541-554.
[33] Fan J Q, Zhang L P, Zhao C P,etal. Studies on mieosis pollen mother cells in photoperiod-temperature sensitive genic male sterile wheat line BS366. Chinese Journal of Cell Biology, 2011, 33(6): 622-628. 樊建青, 张立平, 赵昌平, 等. 光温敏核雄性不育小麦 BS366 花粉母细胞减数分裂的细胞学研究.中国细胞生物学学报, 2011, 33(6): 622-628.
[34] Liang X H, Yi Z B, Zhao W J,etal. Cytological observation of microsporogenesis and its chromosomal behavior in meiosis of A2 cytoplasmic-male sterile line in sorghum. Acta Agronomica Sinica, 2006, 32(8): 1107-1110. 梁小红, 仪治本, 赵威军, 等. 高粱 A2 型细胞质雄性不育系小孢子发生的细胞学观察和减数分裂染色体行为分析.作物学报, 2006, 32(8): 1107-1110.
[35] Wang F, Wei B G, Li G Q,etal. A cytological observation of the pollen mother cells of the photoperiod-sensitive male sterile soybean plant of 88-428BY-827. Scientia Agricultura Sinica, 2004, 37(8): 1110-1113. 王芳, 卫保国, 李贵全, 等. 大豆光敏雄性不育株 88-428BY-827小孢子母细胞的细胞学观察. 中国农业科学, 2004, 37(8): 1110-1113.
[36] Tian F F, Xu Y J, Yuan L,etal. The cytom orphology study of anther abortion in male-sterile lines of Hong Cai-tai (BrassicacampestrisL.ssp.chinensisL.var.utilisTsen et Lee.).Journal of Wuhan Botanical Research, 2004, 22(3): 269-272. 田福发, 徐跃进, 袁黎, 等. 红菜薹雄性不育系花药败育的细胞形态学观察. 武汉植物学研究, 2004, 22(3): 269-272.
[37] He G L, He H H, Liu Y B. The cytological study of photoperiod-sensitive genic sterile rice Nongken 58S. Acta Agriculturae Universitis Jiangxiensis, 2001, 23(1): 24-27. 贺国良, 贺浩华, 刘宜柏. 光敏核不育水稻农垦58S细胞学研究. 江西农业大学学报, 2001, 23(1): 24-27.
[38] Yu F Q, Fu T D. Cytomorphological research on anther development of several male-sterile lines inBrassicanapusL. Journal of Wuhan Botanical Research, 1990, 8(3): 209-216. 余凤群, 傅廷栋. 甘蓝型油菜几个雄性不育系花药发育的细胞形态学研究. 武汉植物学研究, 1990, 8(3): 209-216.
Flower and anther characteristics of two male sterile lines of cauliflower, a dual-purpose vegetable and forage crop
TAO Xing-Lin1,2,3, XIE Zhi-Jun2,3, ZHU Hui-Xia2,3, LIU Ming-Xia2,3, ZHANG Jin-Wen1*, HU Li-Min2,3
1.GansuKeyLabofCropImprovement&GermplasmEnhancement,GansuAgriculturalUniversity,Lanzhou730070,China; 2.InstituteofVegetable,GansuAcademyofAgriculturalScience,Lanzhou730070,China; 3.LanzhouResearchStationofHorticulturalCropBiologyandGermplasmEnhancement,Lanzhou730070,China
The aim of this study was to analyze the morphological characteristics and cytological characteristics of anther development in two male sterile lines of cauliflower (Brassicaoleraceavar.botrytis). The cauliflower cytoplasmic male sterile line 09-R9, the maintainer line 09-24, and the temperature-sensitive genetic male sterile line GS-19 were used as the test materials, and morphological and cytological techniques were used to study anther development. There were differences between the two male sterile lines in fertility transition, flower morphology, and anther development. The three lines showed variations in fertility under different temperature treatments. The sterility of 09-R9 and 09-24 was not affected by temperature; 09-R9 was always sterile, and 09-24 was completely fertile. GS-19 was affected by temperature, and was sterile at high temperature (20 ℃) but fertile at a lower temperature (15 ℃). The buds and anthers were smaller in GS-19 than in 09-R9. Sterile plants differed from fertile plants, and there were significantly fewer flowers on sterile plants than on fertile plants. Microstructural observations showed that the anthers abortive stages and types differed between the two male sterile lines. 09-R9 formed a normal-shaped pollen sac at the early anther stage, but the materials within pollen sacs gradually disintegrated as buds developed, and the pollen sacs finally disappeared. The development of anthers was blocked before the formation of the pollen mother cell, so this line showed an abortive-type sterility without pollen sacs. The anther development of GS-19 showed differentiation of the pollen mother cell and normal pollen sac formation, but this line produced very small amounts of non-viable pollen and no viable pollen. In this line, the pollen mother cells did not undergo meiosis to form tetrads, but formed pseudo microspores with abnormal pollen exines. As the anthers developed, the pseudo microspores gradually decayed until only the empty shells remained. The anther development of GS-19 was blocked between the pollen mother cell stage and the tetrad stage, and so it was an abortive-type sterility of the pollen mother cell. These ultrastructural observations revealed the similarities and differences in anther abortion between the male sterile lines 09-R9 and GS-19 under high-temperature conditions.
cauliflower (Brassicaoleraceavar.botrytis); male sterility line; flower characteristics; anther development; cytology
10.11686/cyxb2016439
http://cyxb.lzu.edu.cn
2016-11-22;改回日期:2017-03-13
国家自然科学基金项目(31460519),农业部园艺作物生物学与种质创制西北地区科学观测试验站项目(2015-A2621-620321-G1203-066)和甘肃省农业科学院科技创新工程学科团队项目(2014GAAS07)资助。
陶兴林(1977-),男,甘肃华池人,副研究员,在读博士。 E-mail:taoxinglin77@126.com*通信作者Corresponding author. E-mail: jwzhang305@163.com
陶兴林, 谢志军, 朱惠霞, 刘明霞, 张金文, 胡立敏. 花椰菜2种雄性不育系花器特征及花药发育的细胞学研究. 草业学报, 2017, 26(5): 144-154.
TAO Xing-Lin, XIE Zhi-Jun, ZHU Hui-Xia, LIU Ming-Xia, ZHANG Jin-Wen, HU Li-Min. Flower and anther characteristics of two male sterile lines of cauliflower, a dual-purpose vegetable and forage crop. Acta Prataculturae Sinica, 2017, 26(5): 144-154.
