外源无机盐与硫胺素对枝叶去除后紫花苜蓿的再生性影响
2017-05-23赵威李亚鸽王馨李涛
赵威,李亚鸽,王馨,李涛
(1.河南科技大学农学院/牡丹学院,河南 洛阳 471023;2.山西农业大学林学院,山西 晋中 030800)
外源无机盐与硫胺素对枝叶去除后紫花苜蓿的再生性影响
赵威1*,李亚鸽1,王馨1,李涛2
(1.河南科技大学农学院/牡丹学院,河南 洛阳 471023;2.山西农业大学林学院,山西 晋中 030800)
放牧活动是包含牧食折损、枝叶去除、唾液沉积等多个过程的融合,而觅食者分泌的唾液对牧草具有潜在影响。本试验选择外源无机盐与硫胺素处理作为试验组,以去离子水与羊唾液处理为参考对照,并将4种溶液涂抹作用于不同枝叶去除水平的紫花苜蓿截面处,探究植食性动物(羊)唾液中的无机盐与硫胺素是否对紫花苜蓿的再生性产生影响,分析枝叶去除与羊唾液是如何诱导植物的补偿再生,同时探寻紫花苜蓿从形态与生理上对无机盐和硫胺素的差异响应。试验结果表明,1)与单一的枝叶去除处理相比,在羊唾液的催化作用下,枝叶去除后的紫花苜蓿再生能力明显提高,其中硫胺素是羊唾液中的有效成分;2)相对于外源无机盐,硫胺素对枝叶去除紫花苜蓿牧草有更为显著的正效应,紫花苜蓿地上累积生物量显著增加,茎叶比差异也达到了4.3~7.9倍;在80%枝叶去除水平下,总分蘖数大约是无机盐组的1.56倍;3)不同处理下紫花苜蓿的生理指标差异性不均一。在各项处理中,紫花苜蓿的叶绿素含量值都接近49.3 mg/g;在20%枝叶去除水平下,清水与羊唾液处理均促进根系可溶性糖含量大幅度增加;对于无机盐组,POD活性随着枝叶去除水平呈递增变化,而硫胺素处理没有引起POD活性的改变。通过本研究,期望进一步了解紫花苜蓿响应放牧的内在机制,为改善人工草地现状和提高牧草的农业效益提供参考,同时也为放牧生态学的发展提供理论支持。
枝叶去除;紫花苜蓿;无机盐;硫胺素;再生性
素有“牧草之王”美誉的紫花苜蓿(Medicagosativa, ‘Phabulous’)简称苜蓿,是目前我国种植面积最为广泛的豆科牧草之一[1]。综合国内外报道可知,有关苜蓿的研究主要集中在生理特性、品种选育、基因改良、环境适应性等方面,并将传统试验方法与新基因技术相结合,大大地增加了对苜蓿的全面了解[2-8]。在对草地放牧生态系统的研究中,植食性动物与牧草是草地生态系统的主体,它们互为作用,相互影响[9]。前者啃食牧草,能够引起牧草的防御反应,增强植株损伤后快速补偿生长的能力;而牧草则通过形态改变与生理响应来应对牲畜采食,保证其生存和繁衍[10]。同时,动物的粪便还可以给植物提供天然肥料,提高牧草的株高和干重[11]。总之,在两者的共同作用下,既可以维持草地生态系统的生态平衡,也可保证畜牧业经济的可持续发展[12]。
但目前有关草畜互作的研究仍具有一定局限性,因为放牧活动是包含牧食折损、枝叶去除、唾液沉积等多个过程的融合[13-15],而不仅仅是单一地研究枝叶去除作用[16-21]。在放牧过程中,草食动物直接摄取牧草的茎叶,常常伴随有草食动物的唾液遗留在损伤断面上。已有研究证明,草食动物的唾液对植物的再生具有一定的正效应[21-24]。Teng等[22]研究去叶后羊草(Leymuschinensis)对绵羊唾液的生长反应,发现绵羊唾液对羊草植株具有短暂的积极影响。Zhang等[23]的研究结果也表明,施加绵羊唾液可以显著增强冷蒿(Artemisiafrigida)和羊草的地上与地下净初级生产力,而且促进其光合产物向植株地上部分分配。同时,Lamy等[25]和Alonso-Díaz等[26]也分析研究了植食性动物唾液蛋白与其觅食行为的关系,发现两者密切相关,而且与觅食的植物物种有一定关联。昆虫唾液能够使植物产生特异性生化反应[27],刺吸式昆虫唾液中的蛋白酶和氨基酸能够诱发植物产生虫瘿[28]。相反,桃蚜(Myzuspersicae)唾液成分可以诱导拟南芥(Arabidopsisthaliana)的防御反应[29]。
动物唾液中可能存在的刺激植物生长的有效物质包括:α-淀粉酶、牛血清蛋白(BSA)、硫胺素、无机盐等。岩衣藻(Ascophyllumnodosum)可利用蜗牛唾液中的α-淀粉酶诱导自身发生化学变化,使体内参与防御动物牧食的海藻多酚水平升高[30]。在草食动物唾液中有一种重要而丰富的成分——牛血清蛋白(BSA),它能够促进枝叶去除后植物的恢复,也常被用作中间媒介来研究动物与植物之间的相互作用[14,31]。Huang等[32]应用RNA测序揭示,在基因或细胞水平上,牛血清蛋白沉积参与影响植物细胞的凋亡与氧化变化。Mcnaughton[33]选取唾液中的另一种成分——硫胺素喷洒于枝叶去除处理的植物上,发现硫胺素、氮和磷使植物的总产量分别提高了43%,52%和33%,而且枝叶去除与其他因子具有强烈的交互作用。此外,应用外源硫胺素还能够促进玉米(Zeamays)的生长和抗氧化防御系统,100 mg/L的硫胺素溶液可以有效缓解盐胁迫对玉米的毒害作用[34]。吴红艳等[35]利用不同的无机盐溶液培养鱼腥藻595(Anabaenasp.595),2 d后观察到显著的细胞学效应,例如细胞膨大、液泡化明显等。总的来说,硫胺素是植物体内多种重要酶的辅酶,而无机盐是植物生长的必需物质,它们都参与植物的多个生理代谢过程,常作为外源物质处理不同的植物。
前人的研究多采用单个因素的控制试验,仅仅考虑了动物唾液或其中某种成分的效应,而没有充分考虑以动物唾液作为对照从而深入探究唾液中究竟哪种物质是最直接有效的成分。本试验选择4种溶液包括羊唾液、硫胺素、无机盐、清水处理枝叶去除后的紫花苜蓿,其中清水和羊唾液作为参考对照,旨在研究外源的无机盐和硫胺素对紫花苜蓿生理与形态上的影响变化,探讨紫花苜蓿响应放牧的内在机制与唾液中的有效物质,为改善人工草地现状和提高豆科牧草的农业效益提供参考,同时也为放牧生态学的发展提供理论支持。
1 材料与方法
1.1 试验地概况
试验点位于洛阳市河南科技大学农学院试验田,属于暖温带南缘向北亚热带过渡地带,温带大陆性气候。 年均温14.2 ℃,年均降水量600 mm(主要集中在夏季),无霜期218 d,平均年日照时间为2200 h。在试验田中选定的是一块土质均匀且近年无深根类农作物种植的区域,保证土壤良好肥力。之后初步处理掉明显杂草,用铁锹松土30 cm深并进行平整,留作试验备用。
1.2 试验材料
本试验开始于2010年3月,选择紫花苜蓿(皇冠)为研究材料,是多年生豆科牧草,抗逆性强,适应范围广,在多种气候类型与土壤中生长良好。试验所用材料是第二年实生苗(第1年3月播种,次年6-10月处理测量),栽培方式为行播,间距为30 cm。种植过程中不进行施肥处理,仅在幼苗期少量浇水,并进行间苗,保留长势良好和株型一致的幼苗,保证试验处理前材料的一致性。后期紫花苜蓿均自然生长。
1.3 试验设计
采用两因素完全随机的试验设计,因素一是枝叶去除水平(0%,20%,50%和80%),因素二是溶液涂抹处理[植食性动物(羊)唾液、硫胺素、无机盐和清水],试验着重考虑同一枝叶去除水平下外源物质的作用。试验设置5次重复,每个重复有10株紫花苜蓿幼苗。羊唾液由河南科技大学动物科技学院畜牧场提供,该溶液现用现取,以保证其内含物的活性;硫胺素溶液由分析纯固体试剂配制而成,其浓度为10 mg/L;使用KCl与NaHCO3混合配置成K+约为0.24 g/L、Na+约为3.03 g/L、HCO3-约为7.17 g/L的无机盐溶液,其pH值范围为8.0~8.5;清水组为去离子水,避免无机盐离子的干扰。紫花苜蓿处理前平均高度约为33 cm,设定4个枝叶去除水平即0%,20%,50%,80%,换之留茬高度分别是33,26,17,7 cm。枝叶去除后在损伤截面处立即进行4种溶液的涂抹处理,为了防止昆虫和鸟的干扰,涂抹后立即用牛皮纸信封袋将断口顶端罩住,下用牛皮筋扎好,第2天清晨取下。本试验自6月中旬至10月上旬共分为两部分(室外试验与室内试验)进行,处理的时间间隔是15 d,总计分别进行5次枝叶去除和5次涂抹,同时观察并测定紫花苜蓿的各项形态与生理指标变化。
1.4 试验指标测定
1.4.1 形态指标 累积地上生物量的测定:每次枝叶去除处理前,在紫花苜蓿周围铺设一大块纸张,按照设定的枝叶去除水平,小心用枝剪去除掉地上部分,进行茎叶分离,然后分别装入牛皮纸信封袋中并标注,带回试验室在70 ℃烘箱中干燥24 h,之后取出称重。5次枝叶去除处理的茎叶总重与最后收获的地上部分生物量干重之和,即为累积地上生物量。
地下生物量的测定:在最后收获地上生物量之后,采用挖掘法获得地下根系,在每个重复中随机选取3株,小心挖掘以保证根系的完整性。为保留好细根,放到120目(0.125 mm)筛网中清水多次冲洗掉表面泥土,后续处理同累积地上生物量的测定。求得3株根系地下生物量的平均值,再乘以10,即为每个重复的累积地下生物量。
总分蘖数的测定:总分蘖数是指紫花苜蓿处理后新长出的嫩芽数,在近地表处仔细清查紫花苜蓿的芽数。
茎叶比的测定:在累积地上生物量的测定中,茎叶分离,分别烘干与称重,茎叶比是累积地上部分的茎重与其叶重的比值。
1.4.2 生理指标 根系可溶性糖含量的测定:随机选择每个处理中的5株紫花苜蓿,取一定量的根系放于研钵中进行研磨,具体操作采用蒽酮法[36]。
叶片叶绿素含量的测定:利用SPAD-502(Minolta,Osaka,Japan)进行测定,对照组所有随机选择,而试验组则是在留茬叶片中随机选择,为5次重复。
根系活力测定:从试验田带回的植物根系立即进行活力测定,方法采用甲烯蓝法[37]。
过氧化物酶活性的测定:采用愈创木酚法[38]。
1.5 统计分析
采用SPSS (SPSS Inc., Chicago, IL, USA) 统计软件进行数理统计。不同枝叶去除水平下紫花苜蓿各项指标的变化运用one-way ANOVA分析方法,结果的差异显著性表示为:P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。同时,利用Excel 2007软件进行统计绘图。
2 结果分析
2.1 紫花苜蓿累积地上生物量与地上地下生物量比变化
通过对紫花苜蓿完整生长期5次不同水平的枝叶去除与4种溶液涂抹处理,紫花苜蓿累积地上生物量的变化如图1A所示。在4种溶液的涂抹处理下,硫胺素溶液对累积地上生物量的影响显著,尤其是轻度枝叶去除水平,其对紫花苜蓿地上生物量积累具有最明显的正效应(P<0.01)。无机盐处理组的地上生物量在80%枝叶去除水平时积累较低。羊唾液涂抹枝叶去除后的紫花苜蓿,它的累积地上生物量变化随枝叶去除程度加重呈缓慢上升的趋势,但是在20%枝叶去除水平时,其变化低于清水涂抹处理(P<0.05)。
对于整株紫花苜蓿来说,其地上部分的枝叶去除与溶液处理必将引起地下根系的动态响应,枝叶去除后紫花苜蓿的累积地上生物量与地下根系生物量的比值变化如图1B所示。随着枝叶去除程度的增强,涂抹了4种溶液的紫花苜蓿地上地下生物量比值分别逐渐增大,其中硫胺素溶液的作用效果较显著。而在轻度枝叶去除水平下,除硫胺素之外的3种溶液对紫花苜蓿地上地下生物量比值的影响没有显著差异(P>0.05)。
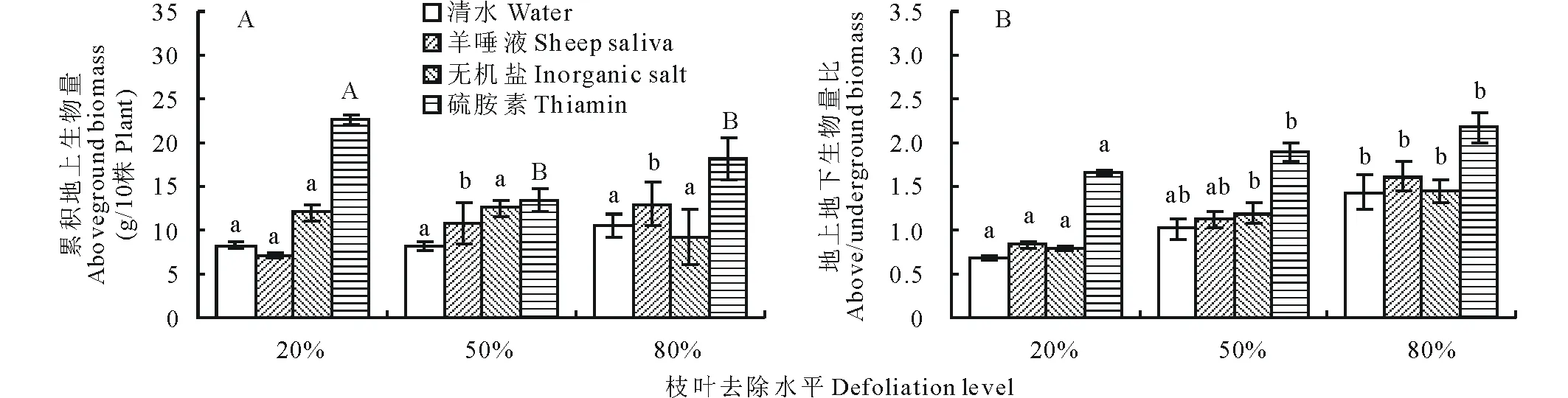
图1 不同处理下紫花苜蓿的累积地上生物量与地上地下生物量比的变化Fig.1 Changes of the accumulative aboveground biomass and above/underground biomass ration of defoliated alfalfa under different treatments 不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),下同。The different small letters mean significant difference at P<0.05, and the different capital letters mean extremely significant difference at P<0.01, the same below.
2.2 紫花苜蓿茎叶比与总分蘖数变化
不同试验处理下紫花苜蓿的茎叶比变化如图2A所示。在轻度、中度、重度3种枝叶去除程度处理中,清水、无机盐与羊唾液的涂抹处理没有对紫花苜蓿的茎叶比产生显著影响(P>0.05),同时,其比值有微弱的减小变化。根据图示,可以观察到无论在何种枝叶去除水平下,硫胺素对茎叶比的诱导作用最为显著,在重度枝叶去除水平下,紫花苜蓿的茎叶比达到最大值(P<0.01)。
为了直观地展示出4种溶液处理对紫花苜蓿地上植株部分的影响,在第5次试验处理后清查了植株的最终收获分蘖情况(图2B)。经过溶液涂抹和枝叶去除试验处理的紫花苜蓿,地上植株的最终分蘖数目变化没有一致的规律。羊唾液作用下,紫花苜蓿的最终分蘖数大于其他处理,差异达到显著(P<0.05)。随着枝叶去除程度的增强,羊唾液处理的紫花苜蓿最终分蘖数目逐渐减小,而在3种枝叶去除水平下,硫胺素与无机盐处理组的紫花苜蓿总分蘖数几乎没有变化,其中重度枝叶去除处理条件下,无机盐导致紫花苜蓿的最终分蘖数小于清水组。

图2 不同处理下紫花苜蓿的茎叶比与总分蘖数变化Fig.2 Changes of the stem/leaf ratio and total tiller numbers of defoliated alfalfa under different treatments
2.3 紫花苜蓿叶片叶绿素含量和根系可溶性糖含量变化
在没有枝叶去除处理与溶液涂抹的情况下,紫花苜蓿的叶绿素含量值是49.3 mg/g左右。图3A中,在任一枝叶去除水平或者溶液涂抹处理中,紫花苜蓿的叶绿素含量值都接近49.3 mg/g。
不同溶液处理下枝叶去除后紫花苜蓿的根系可溶性糖含量变化不一(图3B),无机盐和硫胺素溶液不影响其可溶性糖含量,而在20%枝叶去除水平下,清水和羊唾液处理使其可溶性糖含量达到了最大值0.18%,且该值大于没有任何处理下的可溶性糖含量值0.175%,此外,在80%枝叶去除水平下,羊唾液的作用也相当明显,达到0.179%。

图3 不同处理下紫花苜蓿叶片叶绿素与根系可溶性糖含量的变化Fig.3 Changes of leaf chlorophyll content and root soluble sugar content of defoliated alfalfa under different treatments
2.4 紫花苜蓿叶片过氧化物酶(POD)活性及根系活力变化
紫花苜蓿叶片的过氧化物酶活性受不同水平的枝叶去除处理和4种溶液涂抹处理的影响(图4A)。按照枝叶去除程度递增变化,无机盐涂抹后紫花苜蓿叶片的POD活性呈增加变化,与之不同的是,硫胺素涂抹后其叶片的POD活性没有变化(P>0.05)。除了硫胺素处理的其他3种溶液在50%枝叶去除水平下,紫花苜蓿的过氧化物酶活性显著较高。
在对紫花苜蓿地上部分进行不同程度枝叶去除与溶液涂抹处理的过程中,也引起了地下根系活力不同程度的变化(图4B)。可以观察到,在3种枝叶去除程度处理下,清水组的紫花苜蓿根系活力明显较大,其他3组溶液处理对紫花苜蓿根系活力的影响效果较低且不均匀。而羊唾液处理组除中等枝叶去除程度外,其紫花苜蓿的根系均处于较低的活力水平。

图4 不同处理下紫花苜蓿POD活性与根系活力的变化Fig.4 Change of leaf peroxidase activity and root vitality of defoliated alfalfa under different treatments
3 结论与讨论
紫花苜蓿具有补偿性生长策略以应对枝叶去除胁迫[20]。试验对清水组与羊唾液组进行比较,分析唾液诱导紫花苜蓿再生的响应过程,同时,进行羊唾液、无机盐与硫胺素的对比,进而分析无机盐与硫胺素是否是羊唾液中影响紫花苜蓿生长的关键有效成分。结果显示,清水组随着枝叶去除强度的加大,累积地上生物量有小幅度的增加,其变化小于羊唾液作用下的程度。这与张震[21]的研究结果一致,小叶锦鸡儿(Caraganamicrophylla)经过枝叶去除与绵羊唾液处理后植株净地上生物量增加。在硫胺素的诱导作用下,紫花苜蓿的形态学指标各项测量值均大于无机盐组。除50%枝叶去除水平外,羊唾液对植株个体总分蘖数的诱导作用显著,在硫胺素的诱导作用下,与无机盐组的植株茎叶比差异达到了4.3~7.9倍。这一结果说明,枝叶去除激发了紫花苜蓿补偿再生的开始,随着羊唾液与硫胺素发挥作用,加速紫花苜蓿遭受枝叶去除胁迫后形态上的恢复。其他的研究也得到了类似的结果,在枝叶去除与羊唾液交互作用下,羊草的分蘖数显著较高[22-24]。随着枝叶去除强度与频次的增加,垂穗草(Boutelouacurtipendula)逐渐对硫胺素开始产生正向响应[39]。Rooke[40]进行了木本植物幼苗对山羊唾液的生长响应研究,在枝叶去除与唾液的先后处理下,幼苗的芽生长显著增强,其叶片的产生也明显加快比单一的枝叶去除处理。使用0.4 g/L浓度的硫胺素处理遭受防腐剂胁迫的小麦(Triticumaestivum)幼苗,发现小麦的生理与形态指标均出现良性转变,此研究证明,硫胺素可以缓解不良胁迫对小麦幼苗生长的抑制作用[41]。与无机盐处理相比,硫胺素处理更有利于植物抵御外界侵扰,增强牧草对自身的保护[42]。
随着枝叶去除水平的不断提高,羊唾液对紫花苜蓿根系可溶性糖含量逐渐发挥显著作用,差值甚至达到了0.066%;硫胺素与无机盐处理下,紫花苜蓿的可溶性糖含量变化没有明显的规律,其中在中等程度的枝叶去除处理下,根系可溶性糖含量略有降低。迟文峰等[43]的研究表明,紫花苜蓿的枝叶去除次数和可溶性糖含量具有显著的负相关关系,本试验结果也有相似的变化趋势,但是在羊唾液或硫胺素的作用下,打破了负相关关系。因此,羊唾液或硫胺素在一定程度上能够改善枝叶去除后紫花苜蓿根系的可溶性糖含量降低的不利状况,这对于苜蓿利用根系物质进行地上部分的再生十分有利。与此同时,仅在适度的枝叶去除水平下,过氧化物酶活性会由于羊唾液的存在而有所增加。它们的变化表明草食动物对牧草生长与代谢的影响依赖于放牧强度[33]。在无机盐涂抹后的紫花苜蓿叶片中过氧化物酶活性逐渐增加,而硫胺素施加前后过氧化物酶活性没有变化。因此,这可能是由于无机盐涂抹在植株损伤处,改变了损伤处组织与细胞的钠钾等离子浓度,从而可能诱导植株体内一些酶的活性发生变化。在本试验的4种溶液处理中,发现紫花苜蓿的叶绿素含量没有显著变化,几乎与空白处理的叶绿素含量值相等。即使在重度枝叶去除处理中,4种溶液的涂抹处理都没有使其叶绿素含量值出现较大波动,分析该结果有两种原因:其一,紫花苜蓿在枝叶去除后的短时间内光合速率快速恢复[17],光合作用能够及时补偿紫花苜蓿的枝叶去除损伤,也证明了紫花苜蓿良好的再生能力、耐枝叶去除、适应性强[44];其二,试验不是持续取样分析,光合速率的变化具有瞬时性,叶片叶绿素含量可在较短周期内恢复正常。与地上部分叶片的变化相反,根系活力没有因为羊唾液涂抹产生积极的效应。地上与地下部分如此差异的变化,揭示紫花苜蓿的地上部分似乎能够对羊唾液做出更迅速且有效的正反馈。另一项研究从侧面也反映出该现象,唾液显著提高了冷蒿与羊草的地上净初级生产力,而且增大了地上与地下净初级生产力的比例[23]。
综上所述,枝叶去除是刺激紫花苜蓿补偿再生的有效因子之一[33,45],硫胺素是羊唾液中的有效成分,能够加速紫花苜蓿牧食后迅速恢复,而无机盐似乎没有显著的效应。然而,对此有学者持有不同的观点,Detling等[45]验证野牛唾液对牧草的再生是否具有潜在影响,没有观察到唾液对牧草的叶片、根、分蘖、光合产物分配等的显著影响。通过光合速率的提高得到植物的补偿性生长,但是叶绿素含量及根系活力是否发生变化以及在重度枝叶去除时测量到的异常变化,除了试验误差之外,有待进一步深入探究其原因。
长期放牧不仅诱导植物的形态与生理变化,而且深刻体现在植物的遗传进化上,进而保证植物物种对牧食的抗逆性与生存繁衍[10]。草地植物响应植食性动物牧食行为的种种变化,表明二者之间存在一定的协同进化关系[30]。从维持草畜平衡与草地生态系统稳定性的角度出发,结合分子生理学探索牧草与家畜相互作用的分子机制,是今后放牧生态学研究的必然趋势。Liu等[14]的研究发现,植物在分子水平上通过信号转导、miRNA调控、激素合成、代谢等响应放牧,可能对牧食折损、唾液沉积、去叶有不同的分子响应机制。Fan等[15]的研究结果也表明,唾液沉积能够诱导植物体内与胁迫相关的蛋白质差异表达,而且在转录水平上,相关的基因也可以被调节。因此,期望未来的研究可以从以下3个方面着手:第一,鉴于唾液成分的复杂性,分别进行某种植物对多种动物唾液成分的响应试验,同时选择不同的植物物种进行响应差异对比;第二,进行更加精巧细化的非模拟控制的野外实际放牧试验,明确家畜啃食后其唾液残留对牧草的再生性产生的积极作用;第三,在分子层面上,尝试通过分子生物学方法,寻找与放牧胁迫相关的基因和蛋白,运用基因工程技术,改良缺乏这些基因的牧草物种。总之,更为深入地研究植物与动物的相互关系在分子水平上的变化,预测动植物相互作用下的遗传变化趋势,是十分必要和有意义的。
References:
[1] Zhao G Q, Mu P, Zhang B. Research progress onMedicagosativagenetic engineering. Acta Prataculturae Sinica, 2006, 15(6): 9-18. 赵桂琴, 慕平, 张勃. 紫花苜蓿基因工程研究进展. 草业学报, 2006, 15(6): 9-18.
[2] Wang X, Ma Y X, Li J. Nutrient components and the main biological characteristics of alfalfa. Pratacultural Science, 2003, 20(10): 39-41. 王鑫, 马永祥, 李娟. 紫花苜蓿营养成分及主要生物学特性. 草业科学, 2003, 20(10): 39-41.
[3] Han R H, Lu X S, Gao G J,etal. Photosynthetic physiological response of alfalfa (Medicagosativa) to drought stress. Acta Ecologica Sinica, 2007, 27(12): 5229-5237. 韩瑞宏, 卢欣石, 高桂娟, 等. 紫花苜蓿(Medicagosativa)对干旱胁迫的光合生理响应. 生态学报, 2007, 27(12): 5229-5237.
[4] Li W R, Zhang S Q, Ding S Y,etal. Root morphological variation and water use in alfalfa under drought stress. Acta Ecologica Sinica, 2010, 30(19): 5140-5150. 李文娆, 张岁岐, 丁圣彦, 等. 干旱胁迫下紫花苜蓿根系形态变化及与水分利用的关系. 生态学报, 2010, 30(19): 5140-5150.
[5] Zhang L Q, Zhang F Y, Hasi A. Research progress on alfalfa salt tolerance. Acta Prataculturae Sinica, 2012, 21(6): 296-305. 张立全, 张凤英, 哈斯阿古拉. 紫花苜蓿耐盐性研究进展. 草业学报, 2012, 21(6): 296-305.
[6] Galili S, Guenoune D, Wininger S,etal. Enhanced levels of free and protein-bound threonine in transgenic alfalfa (MedicagosativaL.) expressing a bacterial feedback-insensitive aspartate kinase gene. Transgenic Research, 2000, 9(2): 137-144.
[7] Zhang Y F, Liang Z W, Sui L,etal. Effect on physiological characteristic ofMedicagosativaunder saline-alkali stress at seeding stage. Acta Prataculturae Sinica, 2009, 18(4): 230-235. 张永锋, 梁正伟, 隋丽, 等. 盐碱胁迫对苗期紫花苜蓿生理特性的影响. 草业学报, 2009, 18(4): 230-235.
[8] Deng X K, Qiao D R, Li L,etal. The effect of chilling stress on physiological characters ofMedicagosativa. Journal of Sichuan University: Natural Science Edition, 2005, 42(1): 190-194. 邓雪柯, 乔代蓉, 李良, 等. 低温胁迫对紫花苜蓿生理特性影响的研究. 四川大学学报:自然科学版, 2005, 42(1): 190-194.
[9] Xia J X. Grazing ecology and its application in pasture management. Grassland of China, 1993, (4): 64-70. 夏景新. 放牧生态学与牧场管理. 中国草地学报, 1993, (4): 64-70.
[10] Ma Y S, Zhang S T. Responses of plant from individual to community level to grazing: a review. Chinese Journal of Ecology, 2009, 28(1): 113-121. 马银山, 张世挺. 植物从个体到群落水平对放牧的响应. 生态学杂志, 2009, 28(1): 113-121.
[11] Jiang S C, Zhou D W. Effect of cattle dung on the grazing behaviour of livestock in songnen grassland. Grassland of China, 2002, 24(1): 41-45. 姜世成, 周道玮. 草原牛粪对牲畜取食影响的研究. 中国草地学报, 2002, 24(1): 41-45.
[12] Xi L, Xu Z, Zheng Y. Effects of grazing on grassland plant community. Prataculture & Animal Husbandry, 2008, (10): 1-5. 锡林图雅, 徐柱, 郑阳. 放牧对草地植物群落的影响. 草业与畜牧, 2008, (10): 1-5.
[13] Liu W, Zhang Z, Chen S,etal. Global transcriptome profiling analysis reveals insight into saliva-responsive genes in alfalfa. Plant Cell Reports, 2016, 35(3): 561-571.
[14] Liu G S, Huang X, Chen S Y,etal. How do plants respond to grazing at a molecular level[C]. Revitalising Grasslands to Sustain Our Communities: Proceedings 22nd International Grassland Congress. Sydney: Csiro Publishing, 2013.
[15] Fan W H, Cui W T, Li X F,etal. Proteomics analysis of rice seedling responses to ovine saliva. Journal of Plant Physiology, 2011, 168(5): 500-509.
[16] Qi Z Q, Yu Y X, Zeng Z H,etal. Yield, hay quality and regrowth of establishingMedicagosativaunder four harvest schedules. Acta Prataculturae Sinica, 2010, 19(1): 134-142. 戚志强, 玉永雄, 曾昭海, 等. 紫花苜蓿建植期四种枝叶去除频次下的产量、品质及再生性研究. 草业学报, 2010, 19(1): 134-142.
[17] He S B, Liu G L, Yang H M. Changes and mechanism in response of photosynthetic rates of lucerne residue to cutting under different water treatments. Acta Prataculturae Sinica, 2009, 18(6): 192-197. 何树斌, 刘国利, 杨惠敏. 不同水分处理下紫花苜蓿枝叶去除后残茬的光合变化及其机制. 草业学报, 2009, 18(6): 192-197.
[18] Yang J Z. The influence of defoliation intensity on sward regrowth for perennial ryegrass and tall fescue. Grassland of China, 1997, (4): 33-36. 杨锦忠. 枝叶去除强度对多年生黑麦草和高羊茅再生能力影响的研究. 中国草地学报, 1997, (4): 33-36.
[19] Bao W Y, Zhao M L, Hong M,etal. Effect of cutting on yield and compensatory growth of artificial pasture. Grassland of China, 2015, 37(5): 46-51. 包乌云, 赵萌莉, 红梅, 等. 枝叶去除对人工草地产量和补偿性生长的影响. 中国草地学报, 2015, 37(5): 46-51.
[20] Yue C J, Li S B, Cai J J,etal. Research progress of clipping effect on compensating growth reflection on alfalfa. Journal of Agricultural Sciences, 2009, 30(4): 73-77. 岳彩娟, 李生宝, 蔡进军, 等. 枝叶去除对紫花苜蓿的补偿效应研究进展. 农业科学研究, 2009, 30(4): 73-77.
[21] Zhang Z. Biological Responses ofCaraganamicrophyllato Different Grazing Intensities[D]. Beijing: Graduate University of Chinese Academy of Sciences (Institute of Botany), 2006. 张震. 小叶锦鸡儿对不同放牧强度的生物学响应[D]. 北京: 中国科学院研究生院(植物研究所), 2006.
[22] Teng X, Ba L, Wang D,etal. Growth responses ofLeymuschinensis(Trin.) Tzvelev to sheep saliva after defoliation. The Rangeland Journal, 2010, 32(4): 419-426.
[23] Zhang Z, Wang S P, Jiang G M,etal. Responses ofArtemisiafrigidaWilld. (compositae) andLeymuschinensis(Trin.) Tzvel. (poaceae) to sheep saliva. Journal of Arid Environments, 2007, 70(1): 111-119.
[24] Liu J, Wang L, Wang D,etal. Plants can benefit from herbivory: stimulatory effects of sheep saliva on growth ofLeymuschinensis. Plos One, 2012, 7(1): 108.
[25] Lamy E, Costa G D, Santos R,etal. Sheep and goat saliva proteome analysis: a useful tool for ingestive behavior research. Physiology & Behavior, 2009, 98(4): 393-401.
[26] Alonso-Díaz M A, Torres-Acosta J F J, Sandoval-Castro C A,etal. Amino acid profile of the protein from whole saliva of goats and sheep and its interaction with tannic acid and tannins extracted from the fodder of tropical plants. Small Ruminant Research, 2012, 103(1): 69-74.
[27] Yin H D, Huang C H, Xue K,etal. Roles of insect salivary components in insect-plant interactions. Acta Entomologica Sinica, 2006, 49(5): 843-849. 殷海娣, 黄翠虹, 薛堃, 等. 昆虫唾液成分在昆虫与植物关系中的作用. 昆虫学报, 2006, 49(5): 843-849.
[28] Yan Y, Liu W X, Wan F H. Roles of salivary components in piercing-sucking insect-plant interactions. Acta Entomologica Sinica, 2008, 51(5): 537-544. 严盈, 刘万学, 万方浩. 唾液成分在刺吸式昆虫与植物关系中的作用. 昆虫学报, 2008, 51(5): 537-544.
[29] Vos M D, Jander G.Myzuspersicae(green peach aphid) salivary components induce defense responses inArabidopsisthaliana. Plant Cell & Environment, 2009, 32(11): 1548-1560.
[30] Coleman R A, Ramchunder S J, Moody A J,etal. An enzyme in snail saliva induces herbivore-resistance in a marine alga. Functional Ecology, 2007, 21(1): 101-106.
[31] Huang X. Plant Responses to Animal Saliva Component-Bovine Serum Albumin after Grazing[D]. Beijing: University of Chinese Academy of Sciences, 2013. 黄欣. 枝叶去除后植物对动物唾液成分——牛血清白蛋白的响应[D]. 北京: 中国科学院大学, 2013.
[32] Huang X, Peng X, Zhang L,etal. Bovine serum albumin in saliva mediates grazing response inLeymuschinensisrevealed by RNA sequencing. BMC Genomics, 2014, 15(1): 1-17.
[33] Mcnaughton S J. Interactive regulation of grass yield and chemical properties by defoliation, a salivary chemical, and inorganic nutrition. Oecologia, 1985, 65(4): 478-486.
[34] Kaya C, Ashraf M, Sonmez O,etal. Exogenous application of thiamin promotes growth and antioxidative defense system at initial phases of development in salt-stressed plants of two maize cultivars differing in salinity tolerance. Acta Physiologiae Plant, 2015, 37(1): 1-12.
[35] Wu H Y, Zhao Y J, Guo H L,etal. The cellular effect ofAnabaenasp.595 induced by inorganic salts. Chinese Bulletin of Botany, 2003, 20(2): 205-211. 吴红艳, 赵以军, 郭厚良, 等. 无机盐诱导鱼腥藻595(Anabaenasp.595)的细胞学效应. 植物学报, 2003, 20(2): 205-211.
[36] Kong X S, Yi X F. Experimental Techniques of Plant Physiology[M]. Beijing: China Agriculture Press, 2008: 135-136. 孔祥生, 易现峰. 植物生理学实验技术[M]. 北京: 中国农业出版社, 2008: 135-136.
[37] Chen C, Dong W Y, Zheng J X. Root absorption capacity of the haiziping naturalPhyllostachyspubescensclonal population. Guizhou Agricultural Sciences, 2012, 40(7): 186-187. 陈冲, 董文渊, 郑进烜. 海子坪天然毛竹无性系种群根系的吸收能力. 贵州农业科学, 2012, 40(7): 186-187.
[38] Huang Z, Dai S H, Ma L K,etal. Changes of peroxidase activity in the seed germination of watermelon. Hunan Agricultural Sciences, 2010, (9): 43-45. 黄智, 戴思慧, 马凌珂, 等. 西瓜种子萌发过氧化物酶活性变化的研究. 湖南农业科学, 2010, (9): 43-45.
[39] Reardon P O, Leinweber C L, Merrill L B. Response of sideoats grama to animal saliva and thiamine. Journal of Range Management, 1974, 27(5): 400-401.
[40] Rooke T. Growth responses of a woody species to clipping and goat saliva. African Journal of Ecology, 2003, 41(4): 324-328.
[41] Hu C H, Liu Z H, Wang H X,etal. Effects of exogenous thiamine on alleviating the preservative stress of seedling growth of wheat. Journal of Triticeae Crops, 2014, 34(4): 535-539. 胡春红, 刘中华, 王红星, 等. 外源硫胺素对防腐剂胁迫小麦幼苗生长的缓解效应. 麦类作物学报, 2014, 34(4): 535-539.
[42] Zhou C J, Wang L Q, Li S X,etal. Effect of organic acids and vitamin on some physiological and biochemical characteristics of wheat. Acta Botanica Boreali-Occidentalia Sinica, 1999, 19(4): 623-628. 周春菊, 王林权, 李生秀, 等. 有机酸和维生素对小麦某些生理生化特性的影响. 西北植物学报, 1999, 19(4): 623-628.
[43] Chi W F, Cui G W. Effect of different cutting frequency on soluble sugar content and winter survival rate of alfalfa. Prataculture & Animal Husbandry, 2006, (3): 4-6. 迟文峰, 崔国文. 不同枝叶去除次数对紫花苜蓿根系中可溶性糖含量及越冬率影响的研究. 草业与畜牧, 2006, (3): 4-6.
[44] Haung Y X, Zhou D W, Yue X Q,etal. Study on regrowth characteristics of different alfalfa cultivars. Acta Prataculturae Sinica, 2007, 16(6): 14-22. 黄迎新, 周道玮, 岳秀泉, 等. 不同苜蓿品种再生特性的研究. 草业学报, 2007, 16(6): 14-22.
[45] Detling J K, Dyer M I, Procter-Gregg C,etal. Plant-herbivore interactions: examination of potential effects of bison saliva on regrowth ofBoutelouagracilis(H.B.K.) lag. Oecologia, 1980, 45(1): 26-31.
Effects of exogenous inorganic salts and thiamine on the regrowth of defoliated alfalfa
ZHAO Wei1*, LI Ya-Ge1, WANG Xin1, LI Tao2
1.CollegeofAgriculture(CollegeofTreePeony),HenanUniversityofScienceandTechnology,Luoyang471023,China; 2.CollegeofForestry,ShanxiAgriculturalUniversity,Jinzhong030800,China
Grazing integrates multiple processes including bruising, defoliation, and the deposition of saliva, which may affect the regrowth of forage grasses. In this study, alfalfa plants defoliated at different intensities were treated with exogenous inorganic salts and with thiamine (treatment groups), and deionized water and sheep saliva (control groups). The aim of this study was to determine whether a herbivorous animal’s (sheep) saliva, especially its components (inorganic salts and thiamine) positively affect alfalfa regrowth. We also analyzed how the defoliation and sheep saliva interaction induced compensatory regrowth, and evaluated the morphological and physiological differentiation of defoliated alfalfa after treatment with inorganic salts and thiamine. Our results showed that, compared with alfalfa in the defoliation-only treatment, that in the saliva+defoliation treatment showed significantly better regrowth due to an effective ingredient in saliva (thiamine). Compared with defoliated alfalfa treated with exogenous inorganic salts, that treated with thiamine grew better, as indicated by the significantly greater aboveground biomass, 4.3-7.9-times greater stem/leaf ratio, and 1.56-times higher total tiller number at the 80% defoliation level. The physiological characteristics of defoliated alfalfa did not vary widely among treatments. In all treatments, the chlorophyll content of defoliated alfalfa was close to 49.3 mg/g. At the 20% defoliation level, alfalfa plants treated with sheep saliva and with water showed significantly increased soluble sugars contents in the roots, compared with those in the inorganic salts and thiamine treatments. Treatment with inorganic salts led to a progressive increase in peroxidase activity as the defoliation intensity increased, while treatment with thiamine did not affect peroxidase activity. These results increase our understanding of the functional mechanism of the alfalfa response to herbivore grazing. These results provide a reference for improving the status of artificial grassland and for improving the agricultural efficiency of cultivated forage grasses. The results of this study provide theoretical support for the development of ecologically sound grazing regimes.
defoliation; alfalfa; inorganic salt; thiamin; regrowth
10.11686/cyxb2016429
http://cyxb.lzu.edu.cn
2016-11-14;改回日期:2016-12-15
NSFC-河南人才培养联合基金(U1304306),中国科学院战略性先导科技专项子课题(XDA05050400)和河南科技大学学科提升振兴A计划项目资助。
赵威(1975-),男,内蒙古巴彦淖尔人,副教授,博士。E-mail: zhwibcas@163.com*通信作者Corresponding author. E-mail: zhwibcas@163.com
赵威, 李亚鸽, 王馨, 李涛. 外源无机盐与硫胺素对枝叶去除后紫花苜蓿的再生性影响. 草业学报, 2017, 26(5): 100-108.
ZHAO Wei, LI Ya-Ge, WANG Xin, LI Tao. Effects of exogenous inorganic salts and thiamine on the regrowth of defoliated alfalfa. Acta Prataculturae Sinica, 2017, 26(5): 100-108.
